山仙颗粒对大鼠肝癌前病变Wnt/β-catenin信号通路相关蛋白表达水平的影响
2020-12-13潘艳芳贾晓涛应小平孟博博
潘艳芳,贾晓涛,芮 冉,应小平,方 艳,孟博博
(1.陕西中医药大学基础医学院,陕西咸阳 712046;2.西安市中心医院神经内科,陕西西安 710006)
原发性肝癌是全球第四大导致癌症死亡的主要原因。在过去几年中,大多数国家的5年生存率不到20%[1-2]。在我国,由于乙肝病毒的高感染率而导致慢性肝病、肝硬化、肝癌的高发性[3-4]。肝炎-肝纤维化-肝癌前病变-肝癌是慢性肝病的恶性发展过程,在目前尚不能治愈肝癌的情况下,世界著名科学杂志提出“预防肿瘤的发生比治疗肿瘤更重要”[5]。肝癌前疾病是指具有恶性转变可能的肝脏良性病变,包括肝硬化、肝细胞的再生结节、腺瘤样增生等[6]。若能及时阻断其病理进程,则可有效预防肝癌发生。现代研究发现,肝癌前疾病的发生发展及恶化与信号通路的改变、血管生成及机体免疫微环境的异常、端粒酶活性的表达等因素密切相关[7-8]。其中,Wnt/β-catenin信号通路的改变在肝组织恶性改变中的作用尤为重要。研究发现,该信号通路不仅能调节正常肝细胞的再生,且能通过活化肝星状细胞、激发细胞外基质的形成、改变肝内胆管形态等促进肝癌前疾病的发生发展[9-11]。因此课题组设想,是否可以通过下调Wnt/β-catenin信号通路相关蛋白以抑制或逆转其恶变。山仙颗粒是陕西中医药大学附属医院中西医结合肿瘤内科团队研发的抗肿瘤中成药,其良好的疗效使其广泛应用于陕西中医药大学附属医院肝脏及肺脏等肿瘤的治疗[12-13]。前期研究的结果,明确了山仙颗粒治疗肝癌的机理[14]。本研究拟通过制造肝癌前疾病动物模型,采用HE染色、Masson染色、实时定量PCR、Western blot等实验方法,观察山仙颗粒是否通过影响Wnt/β-catenin信号通路来抑制或逆转肝癌前疾病的发生发展。
1 材料和方法
1.1 实验动物 选取SPF雄性SD大鼠90只,体质量(190±10)g,由西安交通大学实验动物中心提供,实验动物生产许可证号SCXK (川)2015-030。
1.2 药物、试剂与仪器 山仙颗粒由西洋参、鳖甲、龟板、莪术、生山楂、仙鹤草、丹参、薏苡仁、猪苓组成,是陕西中医药大学附属医院院内制剂 (生产批号20180204),由陕西中医药大学药剂科制备,水提过滤、减压浓缩干燥,干膏得率约为25.2%,成品颗粒的临界相对湿度为62%,休止角为29.89,规格10 g/包。分别配置比例为山仙颗粒(g)∶生理盐水(mL)为1 ∶40,配成0.1、0.05、0.025 g/mL的高、中、低剂量混悬液,制备后贮存于4 ℃冰箱中备用。根据人、动物体质量计量换算法计算,大剂量组(2 g/kg)、中剂量组(1 g/kg)、小剂量组(0.5 g/kg)分别相当于临床等效剂量的4、2、1倍。二乙基亚硝胺购自梯希爱(上海)化成工业发展有限公司(生产批号20180309,规格为25 mL/瓶)。KYA1797K(S8327,美国Selleck公司);Anti-Wnt3a抗体(ab219412,英国Abcam公司);Anti-β-catenin抗体(ab6302,英国Abcam公司);Anti-c-Myc抗体 (ab32072,英国Abcam公司);Anti-GAPDH抗体 (ab9485,英国Abcam公司);RNA iso Plus试剂盒(D9108B,日本Takara公司);反转录试剂盒(D6130,日本Takara公司);罗氏Green PCR Master Mix (QPK-201,日本Toyobo公司);HE染色试剂盒(G1120,北京索莱宝科技有限公司);Masson染色试剂盒(G1340,北京索莱宝科技有限公司);RM2235石蜡切片机(德国徕卡公司);7500实时PCR系统(美国Applied Biosystems公司);蛋白电泳系统(美国Bio-Rad公司)。
1.3 主要方法
1.3.1 动物分组、造模及干预 80只SD大鼠随机分为空白组,模型组,山仙颗粒大、中、小剂量组和Wnt/βcatenin抑制剂KYA1797K (阳性对照组)。大鼠肝癌前病变模型制备[15-16]:大鼠适应性饲养1周后进入实验,将配制好的二乙基亚硝胺分别腹腔注射(50 mg/kg,2次/周)于模型组,山仙颗粒大、中、小剂量组,Wnt/β-catenin抑制剂组大鼠,空白组大鼠腹腔注射生理盐水,至16周结束。山仙颗粒大、中、小剂量组大鼠分别以中药灌胃(2、1、0.5 g/kg),每日1次;Wnt/β-catenin抑制剂组大鼠腹腔注射KYA1 797 K (25 mg/kg),每日1次;同时,空白组、模型组给予等剂量生理盐水灌胃,连续给药16周结束。
1.3.2 取材及指标测量 16周最后一次造模和用药后禁食24 h,大鼠称定质量,并用 10% 的水合氯醛(0.35 mL/kg,腹腔注射)麻醉,75%的酒精消毒腹部皮肤并放于超净工作台,开腹,下腔静脉取血送于陕西中医药大学附属医院生化科检测肝功能相关指标谷丙转氨酶(ALT)、谷草转氨酶(AST)、谷氨酰转肽酶(GGT)的变化。ALT、AST和GGT是诊断肝脏疾病的重要指标。随着肝细胞损伤情况越严重,其血清ALT、AST和GGT水平上升程度越高。腹腔内取出肝脏,称定质量、观察肝脏颜色、质地、表面是否有结节及结节数目,若有结节,取结节及其周围肝脏约0.5 cm×0.5 cm×0.5 cm 2块,如果没有结节和病变,肝脏随机取约0.5 cm×0.5 cm×0.5 cm 1块放入10% 的福尔马林中固定,石蜡包埋备,用另一块放于-80 ℃备用,其余肝脏组织放于-80 ℃保存。
1.3.3 HE染色 取各组的肝组织进行固定、脱水、浸蜡与包埋,以3 μm厚度进行切片;60 ℃烤片1 h后常规脱蜡至水。取出玻片,苏木素浸泡5~20 min进行染色,用自来水冲洗1 min,盐酸乙醇分化液分化15 s,自来水冲洗15 min,伊红染色2 min,自来水浸泡5 min。然后进行脱水与透明,中性树胶进行封片。晾干后显微镜观察。
1.3.4 Masson染色 取各组的肝组织切片脱蜡至水,用配制好的Weigert铁苏木素染色液染色5~10 min。用1%盐酸乙醇分化液分化5~15 s、水洗,Masson蓝化液返蓝3~5 min、水洗、蒸馏水洗1 min。丽春红品红染色液染色。磷钼酸溶液洗1~2 min,弱酸工作液洗1 min。直接放入苯胺蓝染色液中染色1~2 min,弱酸工作液洗1 min。常规脱水透明中性树胶进行封片;晾干后显微镜观察。然后用计算机图像分析系统对Masson染色的病理组织进行测量。测量内容:观察每×100视野下假小叶数目、纤维间隔数目和纤维间隔的平均厚度(μm)。
1.3.5 实时荧光定量PCR取出肝组织后进行RNA提取。按Trizol法提取总RNA,核酸紫外分光光度计测定经稀释的RNA提取物的OD值和含有量,判断RNA纯度,计算RNA含有量。经反转录试剂盒和罗氏Green PCR Master Mix进行反转录合成cDNA,设计合成针对不同目的片段的引物,以cDNA为模板进行Real Time PCR扩增。引物序列如下,Gapdh正向为5’ -AAGAAGGTGGTGAAGCAGGC-3’,Gapdh反向为5’ -TCCACCACCCTGTTGCTGTA-3’; Wnt-3a正向为5’ -TGCTGGACAAAGCTACCAGG-3’,Wnt-3a反向为5’ -CGAGACACCATCCCACCAAA-3’; β-catenin正向为5’ -CTGAGGACAAGCCACAGGA-3’,β-catenin反向为5’ -CACCAATGTCCAGTCCGAGA-3’; c-Myc正向为5’ -CCACCTCCAGCTTGTACCTG-3’,c-Myc反向为5’ -GGAGGACTCAGCAGAGGAGA-3’。
1.3.6 Western blot取出冻存的肝组织,将组织加蛋白裂解液进行匀浆裂解,收集蛋白,Bradford法定量。在蛋白样品中加入上样缓冲液,98 ℃煮10 min,4 ℃放置。制备12% SDS-PAGE (十二烷基硫酸钠聚丙烯酰胺)分离胶和5%浓缩胶,蛋白上样后用SDS-PAGE电泳分离蛋白,电转移至尼龙膜,然后用5%脱脂牛奶封闭0.5 h,加入一抗4℃孵育过夜。TBST (缓冲液)冲洗5 min,反复3次,加入二抗常温摇床1 h孵育,TBST冲洗5 min,反复3次,滴加化学发光剂ECL进行发光显影。灰度扫描后用ImageJ软件分析条带的灰度值,结果以各目的蛋白灰度值/GAPDH灰度值的比值表示。
1.3.7 统计学处理 采用SPSS 17.0统计软件进行分析。计量资料以()表示,多组间比较采用单因素方差分析(ANOVA)。组间两两比较采用最小显著性差异法(LSD法)。 P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠血清ALT、AST、GGT水平比较 肝癌前病变发生发展过程中,肝细胞逐渐受到损伤,肝功能逐渐下降,因此在本实验结束时,课题组采集了各组动物的静脉血,测定反映肝功能相关指标ALT、AST、GGT的变化。如表1所示,与空白组比较,模型组ALT、AST、GGT水平均明显高于空白组(P<0.01);与模型组比较,山仙颗粒小剂量组ALT、GGT均有所降低,但差异无统计学意义(P>0.05)。而山仙颗粒大、中剂量组ALT、AST、GGT均降低明显,差异具有统计学意义(P<0.01,P<0.05)。与模型组比较,Wnt/β-catenin抑制剂KYA1797K组ALT、AST、GGT均降低明显,差异具有统计学意义(P<0.01)。这些结果表明山仙颗粒大、中剂量能够明显减低二乙基亚硝胺所致的肝癌前病变模型大鼠肝功能的下降。
表1 各组大鼠血清中ALT、AST、GGT水平(,n=15)

表1 各组大鼠血清中ALT、AST、GGT水平(,n=15)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
2.2 肝脏总体外观 如图1所示,空白组大鼠肝脏颜色鲜红,表面光滑且无结节;模型组大鼠肝脏颜色暗红,表面不光滑且有大量大小不等的结节;山仙颗粒小剂量组大鼠肝脏颜色暗红,表面凹凸不平,可见较多大小不等的结节。山仙颗粒中剂量组大鼠肝脏颜色较暗红,表面可见大小不等的结节,其结节数少于模型组和山仙颗粒小剂量组;山仙颗粒大剂量组肝脏颜色稍暗红,表面不光滑,有颗粒感,可见若干小结节。Wnt/β-catenin抑制剂KYA1797K组肝脏颜色变暗,表面不光滑,可见少量小结节,其结节数明显比模型组减少。这些结果表明大、中剂量山仙颗粒能够明显缓解二乙基亚硝胺所致的肝癌前病变模型大鼠肝脏的病变程度。
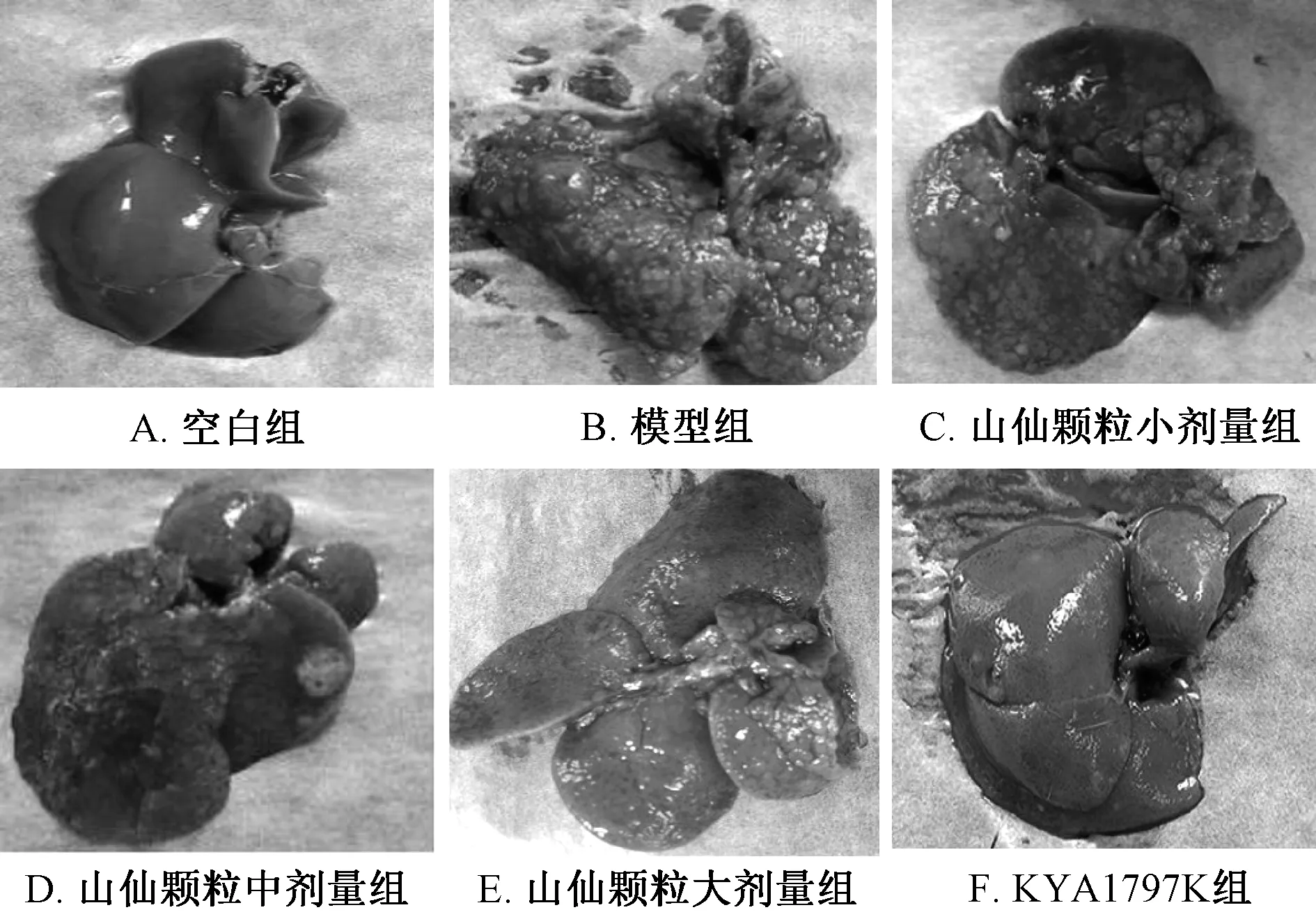
图1 各组大鼠肝脏的总体外观
2.3 HE染色结果 为了进一步观察肝脏微细结构的变化,将各组大鼠的肝组织做成石蜡切片进行HE染色,如图2所示,光镜下观察,空白组大鼠的肝细胞形态正常,沿中央静脉呈放射状排列,无明显的水肿、脂变、坏死和纤维增生;模型组大鼠肝细胞排列紊乱,可见水肿、脂变,肝组织内有大量假小叶形成;山仙颗粒小剂量组大鼠肝细胞排列紊乱,可见大量肝细胞水肿、脂变、坏死,肝组织内有假小叶生成,但较模型组少;山仙颗粒中剂量组大鼠肝细胞排列紊乱较模型组轻,肝组织中未见明显假小叶,可见大量纤维增生、水肿、脂变、坏死,但较模型组和山仙颗粒小剂量组减轻;山仙颗粒大剂量组大鼠肝细胞排列基本正常,肝脏内有少量纤维增生、细胞水肿、脂变、坏死,其程度比中剂量山仙颗粒减轻。KYA1797K组大鼠肝细胞排列基本正常,肝脏内有少量纤维增生、细胞水肿、脂变、坏死,其程度比模型组和山仙颗粒小、中剂量组减轻。这些结果表明山仙颗粒大、中剂量能够明显改善二乙基亚硝胺所致的肝癌前病变模型大鼠肝脏的病理损伤程度。

图2 各组大鼠肝脏组织HE染色(×200)
2.4 Masson染色结果 如图3所示,空白组大鼠肝细胞索排列整齐,肝小叶结构完整清晰。模型组大鼠肝组织中纤维增生明显,蓝色纤维明显增多、增粗,汇管区显著增宽,广泛假小叶形成,形成纤维间隔破坏界板,分割包绕肝小叶。与模型组比较,KYA1797K组和山仙颗粒中、高剂量组假小叶数目均明显减少,纤维间隔的数目和厚度也明显减少(P<0.05、 P<0.01),见表2。这些结果表明山仙颗粒大、中剂量能够减少二乙基亚硝胺所致的肝癌前病变模型大鼠肝脏的纤维化程度。
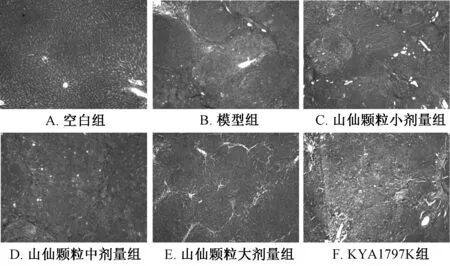
图3 各组大鼠肝脏组织Masson染色(×100)
2.5 大鼠肝组织中Wnt-3a、 β-catenin和c-MycmRNA的表达水平 从慢性肝炎发展到肝细胞癌的过程中,Wnt/βcatenin信号通路被持续激活,为了检测山仙颗粒对二乙基亚硝胺引起的肝脏损伤发挥保护作用的机制研究,本研究检测了各组大鼠肝组织中Wnt/β-catenin信号通路关键分于Wnt-3a、 β-catenin和c-Myc的表达。如图4所示,与正常组比较,模型组Wnt-3a、 β-catenin和C-MycmRNA的表达显著升高(P<0.01);与模型组比较,山仙颗粒小剂量组Wnt-3a、 β-catenin和c-MycmRNA的表达无显著差异(P>0.05),山仙颗粒中剂量组Wnt-3a、 β-catenin和c-MycmRNA的表达明显降低(P<0.05)。山仙颗粒大剂量组Wnt-3a、 β-catenin和c-MycmRNA的表达下降的更显著(P<0.01)。KYA1797K组Wnt-3a、 β-catenin和c-MycmRNA的表达也显著降低(P<0.01)。这些结果表明山仙颗粒能够剂量依赖性减少二乙基亚硝胺所致的肝癌前病变模型大鼠Wnt-3a、 β-catenin和c-MycmRNA的表达。
表2 各组大鼠肝组织的假小叶和纤维间隔数目(,n=15)

表2 各组大鼠肝组织的假小叶和纤维间隔数目(,n=15)
注:与空白组比较,** P<0.01;与模型组比较,# P<0.05,##P<0.01。

图4 实时定量PCR检测各种动物肝组织中Wnt-3a、 β-catenin、 c-MycmRNA水平
2.6 大鼠肝组织中Wnt-3a、β-catenin和c-Myc蛋白的表达水平 Western blot检测及图像分析结果显示(图5),与空白组比较,模型组Wnt-3a、β-catenin、c-Myc蛋白表达量明显增加(P<0.01);与模型组比较,山仙颗粒大、中剂量组Wnt-3a、β-catenin、c-Myc蛋白表达量降低,差异明显(P<0.01,P<0.05),而山仙颗粒小剂量组Wnt-3a、β-catenin、c-Myc蛋白表达量差异均不明显(P>0.05)。与模型组比较,KYA1797K组Wnt-3a、β-catenin和c-Myc蛋白的表达也显著降低(P<0.01)。这些结果表明山仙颗粒能够剂量依赖性抑制二乙基亚硝胺所致的肝癌前病变模型大鼠Wnt/β-catenin信号通路相关蛋白Wnt-3a、β-catenin和c-Myc表达水平。
3 讨论
癌前病变是指某些具有癌变潜在可能性的良性病变或疾病,若长期不能治愈即有可能转变为癌。如果能早期发现和及时治愈癌前病变和疾病,对肿瘤的预防具有重要意义。本研究采用腹腔注射二乙基亚硝胺成功诱导了具有肝硬化背景的肝癌前病变模型,并观察了山仙颗粒对肝癌前病变的影响,结果发现山仙颗粒中、大剂量能够明显改善肝癌前病变大鼠的肝功能和缓解其肝脏病变损伤程度。
癌前疾病的发生发展及恶化与信号通路的改变密切相关。Wnt/β-catenin信号通路在肝脏再生和肝癌的发生发展过程中都具有重要的作用,本研究首次观察了山仙颗粒对肝癌前病变大鼠Wnt/β-catenin信号通路的影响,探讨其治疗肝癌前病变的作用机制。Wnt-3a为该信号通路的重要蛋白,研究证实在Wnt配体的刺激下,Wnt-3a与跨膜卷曲蛋白受体(FZD)等结合,从而影响糖原合成激酶3的活性,抑制β-catenin的降解,使其在细胞质中大量聚集,βcatenin聚集量增加到一定程度时其可进入细胞核内,从而激活该通路下游靶基因c-Myc、cyclinD1等,促进肝癌的发生发展[17]。据报道,肝硬化患者肝脏中β-catenin明显增高,而通过各种方法抑制β-catenin的表达可有效改善肝硬化的进展[18]。研究发现,β-catenin在细胞质和细胞核的聚积是Wnt/β-catenin信号通路活化的核心事件,且在肝脏非纤维化组织中β-catenin的表达呈弱阳性,在肝硬化组织中其阳性表达增加,而在肝癌组织中其呈中等强度表达,使用其通路抑制剂后该蛋白的表达明显减弱[19]。本研究中给大鼠腹腔注射KYA1797K,Wnt/β-catenin信号通路的一个高度选择性抑制剂[20],结果发现Wnt/β-catenin信号通路的抑制确实能够减轻二乙基亚硝胺所致大鼠肝脏的损伤。
山仙颗粒包括西洋参、丹参、莪术、鳖甲、龟板、生山楂、仙鹤草、薏苡仁、猪苓、全方药物配伍严谨,诸药合用,共同达到活血化瘀、益气养阴、扶正祛邪的功效。本实验证明,山仙颗粒能够明显能够改善肝癌前病变大鼠肝脏的纤维化程度,降低变性、坏死的肝细胞数目,减少异型增生结节的数目和体积。qPCR及Western blot结果显示,模型组大鼠的Wnt-3a、 β-catenin和c-MycmRNA及蛋白表达量较空白组显著升高(P<0.01),山仙颗粒对其具有显著的下调作用(P<0.05)。综上所述,山仙颗粒能够抑制肝细胞异常增生及肝硬化形成,有效抑制肝癌前病变的发生、发展,其作用机制与其调控Wnt/β-catenin信号通路密切相关。

图5 Western blot检测各组大鼠肝组织中Wnt-3a、β-catenin、c-Myc蛋白表达水平
