雷公藤多苷通过Wnt/β-catenin缓解IL-1β 诱导的软骨细胞损伤
2020-12-13齐秀春曹玉净艾进伟李浩亮
齐秀春,陈 昕,曹玉净,李 扬,艾进伟,李浩亮
(河南省中医院骨伤科,河南郑州 450002)
创伤性关节炎是踝关节骨折治疗后容易发生的一种并发症,主要呈现出严重的肿胀和疼痛,危害踝关节的功能,影响患者的身体健康和正常生活[1]。它主要表现为关节软骨的变性和破坏,受损的软骨组织修复与再生能力较弱,因此创伤后造成的软骨损伤及退变成为临床修复的难题[2]。雷公藤多苷是从卫矛科植物雷公藤Tripterygium wilfordiiHook.f.中提取的一种水-氯仿提取物,具有较强的抗炎及免疫抑制作用[3-4]。因此,本研究拟通过体外培养软骨细胞并加入白介素1β(IL-1β)模拟创伤性关节炎时软骨细胞的环境,检测不同浓度雷公藤多苷对软骨细胞活性和功能的影响,以期为创伤性关节炎的治疗提供理论依据。
1 材料
1.1 动物 SD大鼠(雄性,4周,体质量60~80 g)购自河南省中医院中心实验室(使用许可证号SYXK (豫)2016-0009)。
1.2 药物与试剂 雷公藤多苷片购于江苏美通制药有限公司(批号151206,规格10 mg/片),加入少量DMEM培养液充分溶解,以0.45 μm滤膜过滤除菌,用含10%胎牛血清的DMEM培养液分别稀释至5、10、25、50 μg/mL。DMEM低糖培养基(批号 C11885500BT )、胎牛血清 (批号C20012500BT)、含50 U/mL青霉素和100 μg/mL链霉素的双抗(批号15140-122)、胰蛋白酶(批号25200-056)购于美国Gibco公司;氯化锂(LiCl)溶液(批号R00473,规格1 mol/L)购自北京雷根生物技术有限公司,蒸馏水稀释至20 mmol/L;CCK-8细胞活性检测试剂盒 (批号KGA317)、LDH检测试剂盒 (批号KGT02424)、Annexin V-FITC细胞凋亡检测试剂盒 (批号KGA1012)购自江苏凯基生物技术股份有限公司;Col-Ⅱ(批号69-98687)、葡萄糖氨基聚糖(glycosaminoglycan,GAG)(批号69-98547)、COX-2 (批号69-36228)、iNOS (批号69-98762)ELISA检测试剂盒,BCA蛋白检测试剂盒(批号69-97682)购自武汉默沙克生物科技有限公司;ECL显色剂(批号P0018FS)购于上海碧云天生物技术有限公司;兔抗鼠MMP13 (批号ab219620)、Aggrecan(Acan)(批号ab186414)、Sox9 (批号ab185966)单克隆抗体及辣根过氧化物酶标记的羊抗鼠IgG(批号ab172730)购于英国Abcam公司。
2 方法
2.1 软骨细胞分离培养 将SD大鼠处死,消毒后剪开膝关节,用刀片刮取关节表面软骨,放入加有PBS的培养皿中,清除表面血污及附着组织,用PBS溶液冲洗后,将软骨剪切到1 mm3大小的组织块放入无菌培养皿内,加入0.25% 胰蛋白酶在恒温摇箱中37 ℃下摇荡消化30 min。弃去上清液,加入2 mg/mL的Ⅱ型胶原酶,放入恒温摇箱中37 ℃下摇荡消化2~4 h,低温离心5 min后弃去上清液,DMEM培养液冲洗3次,加入含有10%胎牛血清的DMEM培养基。将含有完全培养基的组织块均匀铺在培养瓶内,再加入适量完全培养基,继续放在培养箱中静置培养,每2~3天换液1次,待组织块中软骨细胞长出后,传代培养,取第3代软骨细胞进行后续实验。
2.2 分组、造模及CCK-8检测软骨细胞存活率取第3代软骨细胞,以2×103/孔接种于96孔板中,分别用不同浓度雷公藤多苷(0、5、10、25、50 μg/mL)处理24 h,其中未加雷公藤多苷的细胞组作为对照组,每孔加入20 μL CCK-8溶液,用加了相应量细胞培养液和CCK-8溶液但没有加入细胞的孔作为空白对照,继续孵育培养2~4 h。在酶联免疫检测仪上检测450 nm处的吸光度值(OD)。细胞存活率=[(OD给药组-OD空白组)/(OD对照组-OD空白组)]×100%。第3代软骨细胞分为对照组、模型组(10 ng/mL IL-1β)、雷公藤多苷组 (10、50 μg/mL雷公藤多苷)、LiCl组(50 μg/mL雷公藤多苷+20 mmol/L LiCl),加入10 ng/mL IL-1β 诱导软骨细胞24 h,给药组加入相应药物继续处理24 h。按上述CCK-8法,检测各组细胞存活率。
2.3 LDH释放率检测 取第3代软骨细胞,以5×104/孔的浓度接种于培养瓶中,按照“2.2” 项下分组处理细胞,根据LDH检测试剂盒检测各组细胞中LDH释放量。LDH释放率=[细胞上清液中LDH水平/ (细胞上清液LDH水平+细胞裂解液中LDH水平)]×100%,结果以实验组与对照组LDH释放率的比值来表示。
2.4 流式细胞仪检测细胞凋亡检测 取第3代软骨细胞,按照 “2.2” 项下分组处理细胞后,0.25%胰蛋白酶加入到各组的培养皿中消化收集细胞,按照Annexin V-FITC/PI凋亡检测试剂盒的说明书进行操作,将细胞重悬后加入Annexin V-FITC和PI,室温避光条件下分别孵育15、5 min。最后,通过流式细胞仪检测细胞凋亡。
2.5 检测细胞培养上清液中COX-2和iNOS的水平 取第3代软骨细胞,按照“2.2” 项下分组处理细胞后,收集细胞培养上清液,按照ELISA试剂盒说明书进行操作,检测细胞培养上清液中COX-2和iNOS的水平。
2.6 葡萄糖氨基聚糖 (glucose aminoglycan,GAG)水平检测 取第3代软骨细胞,按照“2.2”项下分组处理细胞后,换液时的培养液100 μL,加入至含1.5 mL 1.5% 阿利新蓝染液的试管内,室温放置10 min,酶标仪在490 nm波长处吸光度值(OD)。以硫酸软骨素制作标准对照曲线,计算出各组细胞培养液GAG水平。
2.7 Western blot检测蛋白表达 取第3代软骨细胞,按照“2.2” 项下分组处理细胞后,收集细胞总蛋白,BCA试剂盒检测蛋白浓度,每孔上样量为20 μg,进行SDS-PAGE电泳,转移至PVDF膜,将PVDF膜于5% 脱脂奶粉4 ℃封闭过夜,加入Wnt3a (1 ∶800)和β-catenin抗体 (1 ∶1 000)4 ℃孵育过夜,TBST洗涤,加入辣根过氧化物酶标记的羊抗鼠IgG摇床孵育1 h,常规洗膜化学发光试剂显色。Quantity One软件分析灰度值。
2.8 RT-PCR检测mRNA表达 取第3代软骨细胞,按照“2.2” 项下分组处理细胞后,收集细胞并提取总RNA,按照M-MLV逆转录试剂盒说明转录cDNA,引物序列为MMP13 (正向5′-CTTCCCAACCGTATTGATGC-3′,反向5′-TTTGGAAGACCCAGTTCAGA-3′); Acan(正向 5′-TCGAGGACA GCGAGGCC-3′,反向 5′-TCGAGGGTGTAGCGTGTAGAGA-3′); Sox-9 (正向 5′-TACGACTGGAC GCTGGTGCC-3′,反向 5′-CCGTTCTTCACCGACTTCCTCC-3′); GAPDH(正向5′-ATG TTCGTCATGGGTGTGAA-3′,反向5′-GGTGCTAAGCAGTTGGTGGT-3′。取cDNA进行扩增。反应条件为预变性95 ℃、30 s;变性65 ℃、3 s,退火72 ℃30 s,共40个循环。用2-ΔΔCt法计算出各个mRNA的相对表达量。
2.9 统计学分析 应用SPSS17.0统计软件进行统计学分析,所有细胞实验每组设3个复孔,每个实验独立实验重复3次,计量资料以()表示,使用GraphPad Prism 7.0制图,多组间比较用单因素方差分析,两两比较采用LSD-t检验,以P≤0.05为差异具有统计学意义。
3 结果
3.1 雷公藤多苷对IL-1β 诱导软骨细胞增殖和毒性影响 CCK-8检测结果表明,与对照组比较,雷公藤多苷(5、10、25、50 μg/mL)作用之后,软骨细胞存活率及细胞内LDH水平无变化(图1A~1B)。与对照组比较,模型组细胞存活率降低(P<0.05)LDH释放升高(P<0.05);与模型组比较,雷公藤多苷(50 μg/mL)干预后,细胞存活率升高(P<0.05),LDH释放降低(P<0.05)(图1C~1D)。
3.2 雷公藤多苷抑制IL-1β 诱导的软骨细胞凋亡流式细胞仪检测结果表明,与对照组比较,模型组细胞凋亡率上升(P<0.05),而雷公藤多苷作用之后,细胞凋亡率降低(P<0.05)。结果表明,雷公藤多苷可以降低IL-1β 诱导的细胞凋亡。见图2。
3.3 雷公藤多苷缓解IL-1β 诱导的软骨细胞退化及炎症反应 与对照组比较,模型组GAG水平降低,而雷公藤多苷作用之后,细胞中GAG水平上升(图3A,P<0.05);与对照组比较,模型组COX-2和iNOS水平升高,而雷公藤多苷作用之后,细胞中COX-2和iNOS水平降低(图3B,P<0.05);与对照组比较,模型组细胞中MMP13 mRNA升高,Acan、 Sox-9 mRNA下降,而雷公藤多苷作用后,细胞中MMP13 mRNA降低,Acan、Sox-9 mRNA上升(图3C,P<0.05)。结果表明,雷公藤多苷可以降低IL-1β 诱导的软骨退化及炎症反应。
3.4 雷公藤多苷抑制IL-1β 诱导软骨细胞中Wnt/β-catenin通路的激活 Western blot结果表明,与对照组比较,模型组细胞中Wnt3a和β-catenin的表达上调,而雷公藤多苷作用之后细胞中Wnt3a和β-catenin表达下降(P<0.05),见图4。结果表明雷公藤多苷可以抑制IL-1β 诱导软骨细胞中Wnt/β-catenin通路的激活。
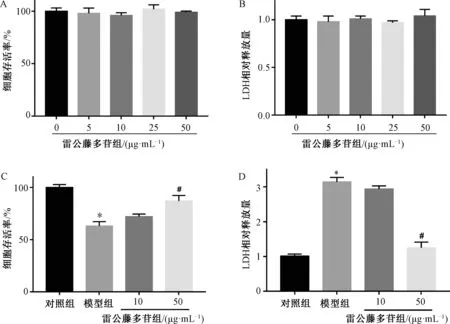
图1 雷公藤多苷对IL-1β 诱导软骨细胞增殖和毒性影响(n=3)Fig.1 Effects of tripterygium glycosides on the proliferation and cytotoxicity of IL-1β-induced chondrocytes (n=3)
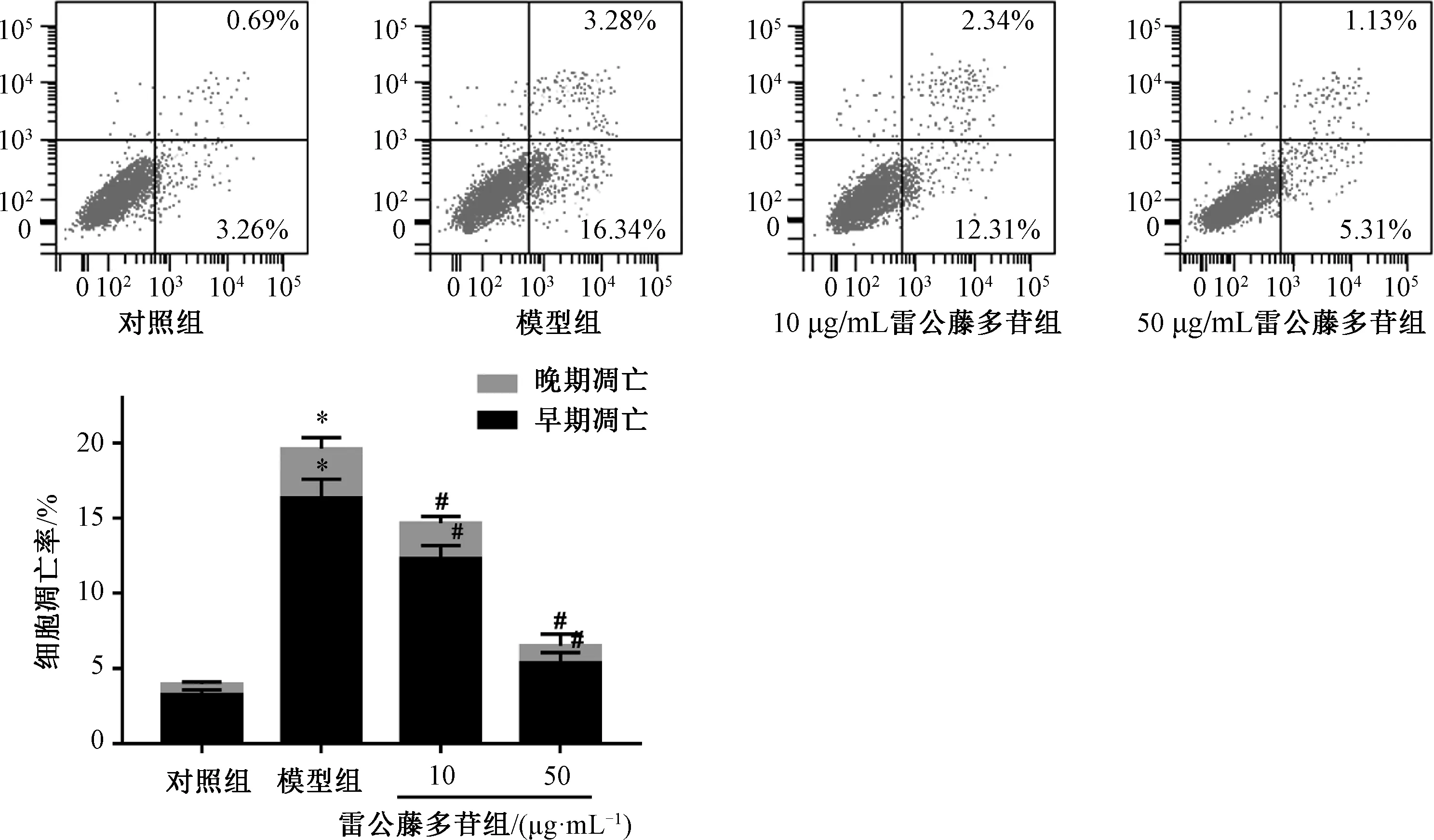
图2 雷公藤多苷对IL-1β 诱导的软骨细胞凋亡的影响(n=3)Fig.2 Effects of tripterygium glycosides on the apoptosis of IL-1β-induced chondrocytes (n=3)
3.5 雷公藤多苷通过抑制Wnt/β-catenin通路缓解IL-1β 诱导的软骨细胞损伤 为了检测雷公藤多苷是否通过抑制Wnt/β-catenin通路缓解IL-1β 诱导的软骨细胞损伤,将Wnt/β-catenin通路激动剂LiCl作用于雷公藤多苷干预的IL-1β 诱导的软骨细胞。Western blot结果表明,LiCl作用之后细胞中Wnt3a和β-catenin的表达上升(图5A,P<0.05);与雷公藤多苷组比较,LiCl激动剂作用之后细胞存活率降低(P<0.05),LDH释放上升(P<0.05),细胞凋亡率增加(P<0.05),GAG水平及Acan、Sox-9 mRNA降低 (P<0.05),MMP13 mRNA及COX-2、iNOS水平上升(P<0.05),均逆转了雷公藤多苷对IL-1β 诱导的细胞损伤的缓解作用。结果表明,雷公藤多苷通过抑制Wnt/β-catenin通路缓解IL-1β 诱导的软骨细胞损伤。
4 结论
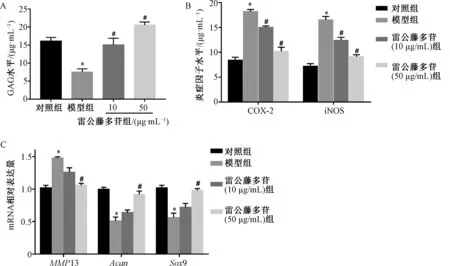
图3 雷公藤多苷对IL-1β 诱导的软骨细胞退化及炎症反应的影响(n=3)Fig.3 Effects of tripterygium glycosides on the degeneration and inflammation of IL-1β-induced chondrocytes (n=3)
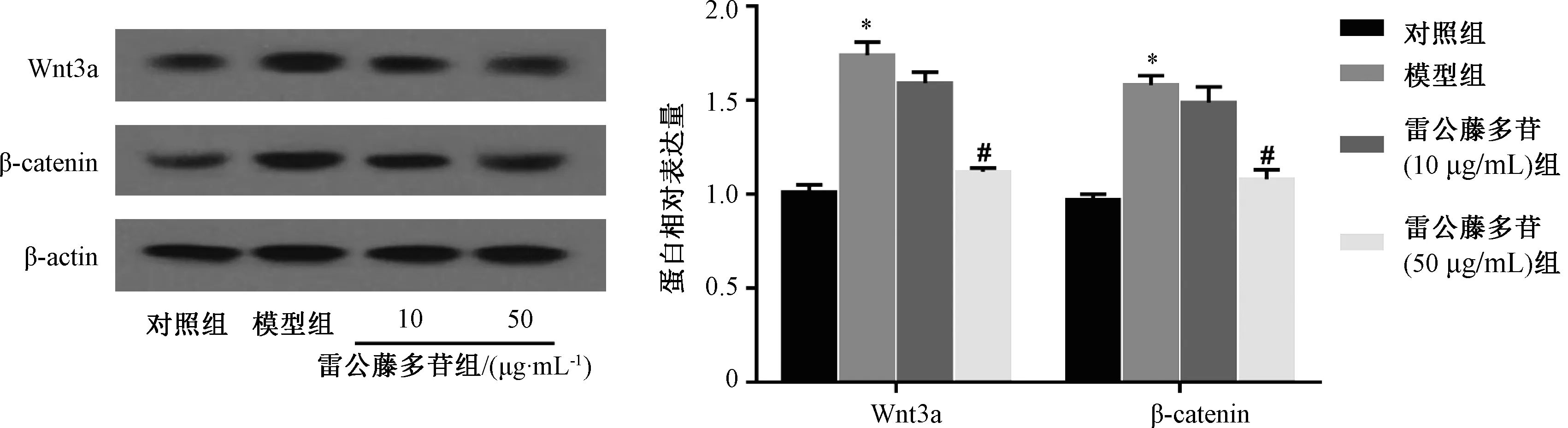
图4 雷公藤多苷对IL-1β 诱导软骨细胞中Wnt/β-catenin通路的影响(n=3)Fig.4 Effects of tripterygium glycosides on Wnt/β-catenin Pathway of IL-1β-induced chondrocytes (n=3)
关节软骨是固态的结缔组织,由分布在其中的特异性软骨细胞及大量的细胞外基质组成。软骨基质中含有水分、蛋白多糖和胶原纤维,还包括一些脂肪、蛋白质、糖蛋白和无机盐等[5-6]。创伤性关节炎导致的软骨、滑膜损伤及变性将导致关节功能障碍,其中炎症是创伤性关节炎病理变化过程中的重要环节[7]。因此,本研究通过IL-1β 诱导软骨细胞模拟创伤性关节炎发生的软骨细胞环境,探究雷公藤多苷对创伤性关节炎软骨细胞的保护作用及其潜在的分子机制。
雷公藤多苷具有抗炎、抗肿瘤和免疫抑制等多种生物功能,其活性主要由二萜内酯、生物碱和三萜等多种有效成分协同产生。在临床上,雷公藤多苷主要用于风湿性关节炎、急性肾小球肾炎和强直性脊柱炎等自身免疫性疾病和炎症性疾病的治疗[8]。有研究表明,使用雷公藤多苷治疗关节炎模型大鼠之后,大鼠的足肿胀度、关节炎症指数均显著降低,且其机制可能是雷公藤多苷上调了调节性T细胞以及炎性细胞抑制因子白介素10水平[9]。环氧合酶(Cyclooxygenase-2,COX-2)是前列腺素合成和起始步骤的关键酶,而前列腺素与滑膜、软骨破坏,关节周围组织炎症等病变过程息息相关[10]。诱导型一氧化氮合成酶 (induced nitric oxide synthase,iNOS)在软骨细胞损伤和退变中发挥重要作用。目前很多研究证实,iNOS抑制剂的应用有助于炎性软骨代谢的恢复。iNOS抑制剂能抑制iNOS的表达,减少软骨细胞产生NO的同时,抑制基质金属蛋白酶(MMPs)和胶原酶的活性及基因表达,使软骨细胞合成蛋白多糖的能力逐渐恢复,并能抑制自由基和IL-1β 诱发的软骨细胞凋亡[11-12]。葡萄糖氨基聚糖(GAG)是软骨基质的主要成分,软骨基质合成关键基因Acan、Sox-9蛋白等的水平均作为关节炎症中软骨损伤的指标受到广泛的研究[13-14]。另外,MMP13是唯一能够裂解胶原分子中三维螺旋结构的酶,对胶原具有特异性,软骨破坏中研究较多[15]。本研究表明,IL-1β诱导之后,软骨细胞的增殖活性降低,细胞凋亡率增加,COX-2,iNOS的表达水平提高,GAG、Acan和Sox-9的水平降低,而雷公藤多苷作用之后细胞活性上升,炎性相关COX-2、iNOS的表达水平降低,GAG、Acan和Sox-9的水平提高。结果表明,雷公藤多苷能够保护IL-1β 诱导的软骨损伤。
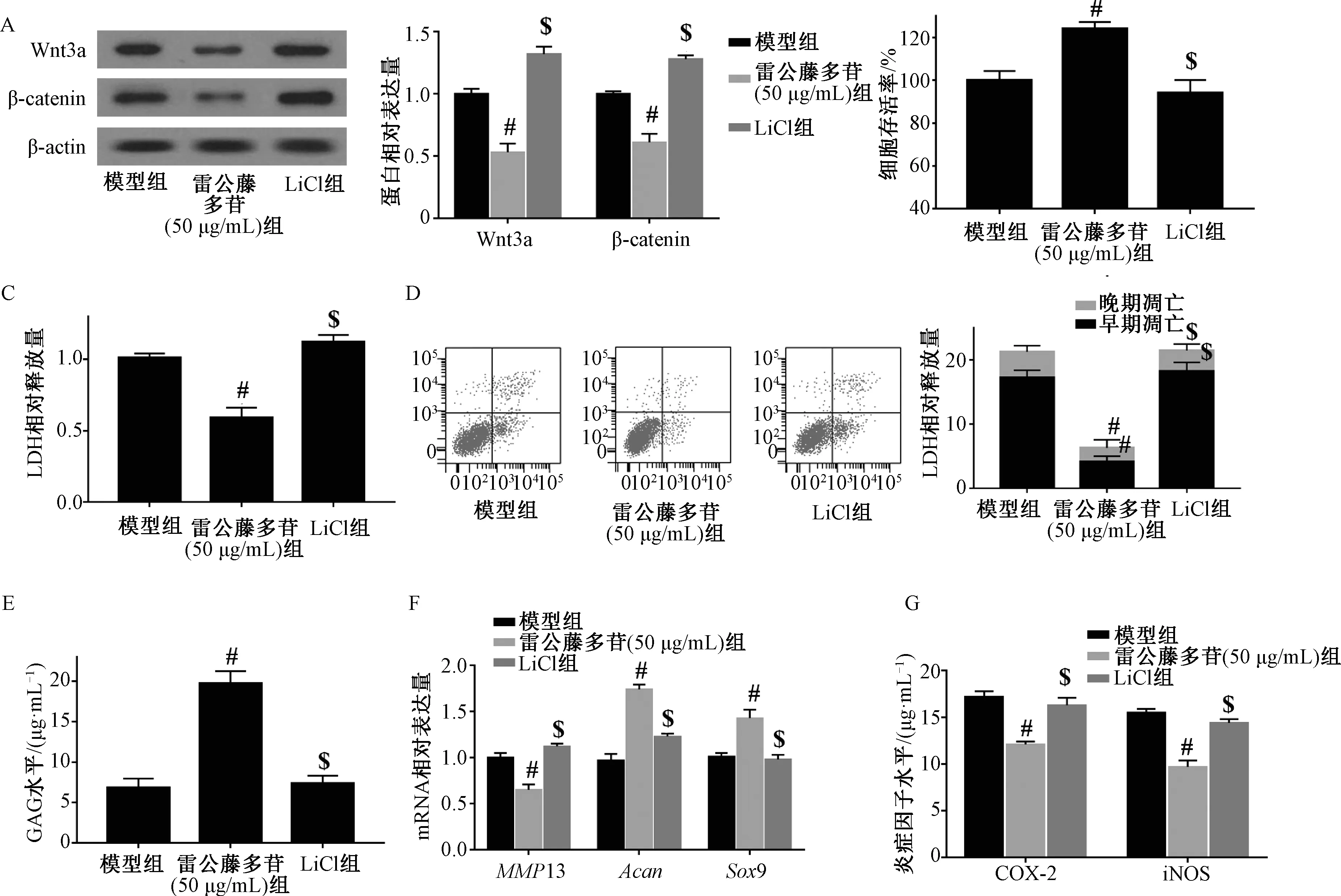
图5 雷公藤多苷通过抑制Wnt/β-catenin通路缓解IL-1β 诱导的软骨细胞损伤(n=3)Fig.5 Alleviation of IL-1β-induced chondrocyte injury by tripterygium glycosides via Wnt/β-catenin pathway inhibition (n=3)
Wnt信号通路包含多种通路系统,调节生细胞形态与功能的分化与维持、免疫、应激等过程,其中典型的Wnt/β-catenin通路在关节炎中具有至关重要的作用[16]。Wnt/β-catenin通路的激活增强肿瘤坏死因子(TNF)-α 的分泌,促进MMP的生成,从而导致细胞外基质降解,引起关节软骨破坏。有研究表明,雷公藤多苷能够通过抑制Wnt/β-catenin通路延缓糖尿病肾病的进展[17]。为了检测Wnt/β-catenin通路的抑制是否同样参与了雷公藤多苷对IL-1β 诱导的软骨细胞损伤的保护作用,我们将Wnt/β-catenin通路的激活剂作用于雷公藤多苷处理的软骨细胞损伤模型中,结果表明,Wnt/β-catenin通路的激活剂反转了雷公藤多苷对IL-1β 诱导的软骨细胞的保护作用。
综上所述,雷公藤多苷可能通过抑制Wnt/βcatenin通路反转IL-1β 诱导的软骨细胞活性降低、LDH分泌和细胞凋亡率的增加,以及GAG、MMP13、Acan、Sox-9水平的降低和COX-2,iNOS水平的上升等,以期这一结果为创伤性关节炎的临床治疗提供理论支持。
