珍宝丸联合电针对急性脊髓损伤大鼠行为学和BrdU、Nestin、GFAP表达的影响
2020-12-13赖增娇滕秀英刘国斌
赖增娇,滕秀英,刘国斌
(1.内蒙古民族大学附属医院,内蒙古通辽 028000;2.黑龙江中医药大学附属第二医院,黑龙江哈尔滨 150001;3.内蒙古通辽市科尔沁区第一人民医院,内蒙古通辽 028000)
急性脊髓损伤是临床常见的急重症,多发生于交通事故、高处坠落等事故中,可影响肢体功能,甚至可导致瘫痪。调查[1]显示,全球急性脊髓损伤的发病率约为每百万人中有3.6~195例,且该病的发生率仍逐渐增长,由此所致的肢体运动障碍和死亡人数也越来越多,已引起高度重视。目前临床上对此类患者多采用减压手术或营养脊髓神经、促脊髓神经生长等保守治疗,有一定疗效,但仍存在较大的提升空间。蒙药珍宝丸具有安神活络、清热凉血等功效,在既往研究中被证实对急性脊髓损伤具有辅助治疗作用[2],可改善患者的康复效果,且在动物实验中也证实该药物可改善急性脊髓损伤大鼠模型的行为学[3]。电针是基于经络学说的一种脉冲电刺激疗法,可改善血流、增强损伤的脊髓神经的自我修复功能,还可改善患者的运动功能[4]。有研究[5-7]提示,5-溴-2-脱氧尿嘧啶核苷(BrdU)、巢蛋白 (Nestin)、胶质纤维酸性蛋白(GFAP)表达是脊髓神经细胞生长、增殖和分化的重要参考指标,在急性脊髓损伤后上述指标表达均有所升高以促进脊髓神经细胞的生长、增殖和分化,加快损伤组织修复,已被作为急性脊髓损伤的治疗靶点应用于动物实验中[8]。为尝试探讨增疗效的方案,本研究特尝试将蒙药珍宝丸与电针联用治疗急性脊髓损伤大鼠,并观察其效果,探讨对脊髓损伤组织BrdU、Nestin、GFAP表达的影响。
1 材料
1.1 动物 45只成年SD大鼠,雌雄各半,无特定病原体(SPF)级,10周龄,体质量180~230 g,购自北京维通利华实验动物技术有限公司,生产许可证号SCXK (京)2018-0001。
1.2 药物与试剂 蒙药珍宝丸(内蒙古蒙药股份有限公司,国药准字Z1502410,规格6 g/丸,批号171205003);苏木素-伊红(HE)染色试剂盒(碧云天生物技术研究所,批号1706135A);末端脱氧核苷酸转移酶介导的生物素脱氧尿嘧啶核苷酸缺口末端标记(TUNEL)染色试剂盒(美国Roche公司,批号1710178);兔抗鼠血管性血友病因子(vWF)、BrdU、Nestin、GFAP单克隆抗体和山羊抗兔vWF、BrdU、Nestin、GFAP多克隆抗体(辣根过氧化物酶标记)(美国Abcam公司,批号1710115002、1711125001、1711017010、1710018007、1710014007、1712017008、1712151002、1711019004);RNAiso Plus提取试剂盒(大连宝生物工程有限公司,批号1710145001);BrdU、Nestin、GFAP、内参(βactin)引物委托深圳晶美生物技术有限公司合成;蛋白定量试剂盒(北京普利莱基因技术有限公司,批号170812)。
1.3 仪器 G-6805型电针治疗仪(北京科苑达医疗器械有限公司);不锈钢打击杆(天津州杰技术发展有限公司定制);Magnetion (德国西门子公司);CH20 BIM型光学显微镜、BX63型荧光显微镜(日本Olympus公司);7500型聚合酶链反应(PCR)仪(美国ABI公司);Allegra X-15R型低温高度离心机(美国Beckman公司);Mini-PROTEAN Tetra Cell型蛋白质凝胶电泳仪(美国Bio-Rad公司);凝胶系统成像分析软件(美国Alpha公司)。
2 方法
2.1 造模及分组 取45只SD成年大鼠随机分为正常对照组、模型组、丸剂组、电针组、联合组。以水合氯醛腹腔注射麻醉,仰卧位固定大鼠于手术台上,常规术前准备,沿着T7~T11椎体中线做纵行切口,切开2 cm,逐层切开皮肤和椎旁肌肉,注意避免损伤血管,接着切除T8~T10棘突和椎板,冲洗伤口后压迫止血。取10 cm不锈钢打击杆垂直下降击打暴露脊髓中心的位置,注意每只大鼠建模时打击高度需一致,均为10 cm,打击物质量为10 g。建模后出现痉挛性摆尾反射,双后肢回缩性扑动,迟缓性瘫痪[9],即为造模成功。与此同时,正常对照组仅暴露脊髓,无击打操作。
2.2 治疗 丸剂组予以蒙药珍宝丸治疗,取蒙药珍宝丸以开水浸泡,制作悬液,剂量0.54 g/kg,溶于1 mL/100 g大鼠体质量的温开水中灌胃,于术后23 h予以治疗,此后每间隔24 h给药1次,共1周;电针组予以电针干预,选取大椎穴(位于第7颈椎和第1胸椎间背部正中)、命门穴(位于第2腰椎棘突下),大椎穴向下斜刺、命门穴向上斜刺,分别接入阳极、阴极,持续脉冲电流刺激,于术后23 h予以治疗,针刺30 min,留针30 min,此后每间隔24 h治疗1次,共1周;联合组予以蒙药珍宝丸联合电针治疗,具体方法分别同丸剂组、电针组。
2.3 治疗前后行为学 分别于治疗前(确认建模成功后,正常对照组同一时刻)、治疗后采用后肢运动功能评分(Basso Beattie Bresnahan,BBB)量表评价[10],评分范围为0~21分,0分表示后肢完全无活动,21分表示后肢活动完全正常,运动功能评分量表评分越高认为行为学越佳,每只大鼠均评价3次,每2次时间间隔至少5 min,求平均值。
2.4 治疗后损伤脊髓组织病理变化和脊髓细胞凋亡率 采用HE染色法观察损伤脊髓组织病理变化,采用TUNEL法检测脊髓细胞凋亡率。常规腹腔麻醉,取T11~T13段损伤部位的脊髓组织,留取样本,保存于-80 ℃的超低温冰箱中。取1 mg组织固定、冲洗、脱水,二甲苯透明处理后石蜡包埋,制作石蜡切片,层厚4 μm,严格按照HE染色法试剂盒操作,最后以中性树胶封固,于光学显微镜下观察病理变化。将无明显神经细胞损伤划为0级,将有散在、轻微神经细胞损伤划为1级,将有片状神经细胞损伤划为2级,将有严重神经细胞损伤划为3级。同法取组织制作石蜡切片,严格按照TUNEL检测试剂盒操作,于光学显微镜下随机取5个不重复的视野计算阳性染色细胞率,即为脊髓细胞凋亡率。
2.5 治疗后损伤区域血管生成 采用免疫荧光染色法检测。取待检测组织,脱水包埋,液氮速冻,切片后平铺于防脱载玻片上。室温下干燥,于摇床上振摇清洗3次,5 min/次,透膜后采用PBS清洗3次,5 min/次。加入2 mol/L盐酸溶液,孵育30 min、37 ℃。加入0.1 mmol/L硼酸钠溶液,中和反应10 min,采用PBS清洗3次,5 min/次。以10%浓度小牛血清蛋白封闭,加入一抗(兔抗鼠vWF单克隆抗体),湿盒孵育,4 ℃过夜,PBS清洗后加入二抗(辣根过氧化物酶标记的山羊抗兔vWF多克隆抗体),湿盒孵育,37 ℃、1 h,PBS清洗。吹干,封片,4 ℃避光,干燥后以荧光显微镜采集图像,统计vWF阳性血管数目。
2.6 损伤脊髓组织BrdU、 Nestin、 GFAPmRNA表达 采用逆转录实时荧光定量PCR检测。同法取组织,采用RNAiso Plus提取总RNA,配置反应体系,共10 μL,逆转录合成cDNA。以β-actin为内参,取待检测基因的上下游引物配置反应体系,共25 μL,实施PCR反应,反应体系为95 ℃预变性30 s,95 ℃ (5 s)、60 ℃ (30 s),共40个循环,最后55 ℃ (90 s)。对扩增产物实施凝胶电泳验证,并绘制溶解曲线,采用2-△△Ct法计算目的基因的相对表达量。引物序列见表1。

表1 引物序列Tab.1 Primer sequences
2.7 损伤脊髓组织BrdU、Nestin、GFAP蛋白表达采用Western blot法检测。取组织,液氮冷冻,加入经过预冷处理的裂解液,冰上快速匀浆并裂解1 h。将产物离心分析,并进行蛋白变性、电泳、转膜、标记处理。加入一抗(1 ∶1 000),湿盒孵育,4 ℃过夜,PBS冲洗3次,5 min/次;加入二抗(1 ∶5 000),室温孵育1 h,PBS冲洗3次,5 min/次。计算目的蛋白的相对表达量。
2.8 统计学分析 采用SPSS 25.0软件进行统计学分析,计量资料以()表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验,配对t检验检测本组内治疗前后资料。检验标准为α=0.05。
3 结果
3.1 治疗前后各组行为学 40只建模大鼠中共有33只建模成功,7只死亡,推测由于脊髓损伤过重所致,建模成功率为82.50% (33/40),将建模成功大鼠随机分为模型组(8只)、丸剂组(8只)、电针组(9只)、联合组(8只)。治疗前模型组BBB评分低于正常对照组(P<0.01),丸剂组、电针组、联合组均与模型组相近(P>0.05),治疗后模型组BBB评分较治疗前下降(P<0.01),丸剂组、电针组、联合组BBB评分均较治疗前升高(P<0.01);治疗后组间BBS评分比较,模型组低于正常对照组(P<0.01),丸剂组、电针组、联合组均高于模型组(P<0.01),联合组高于丸剂组、电针组(P<0.01)。见图1。
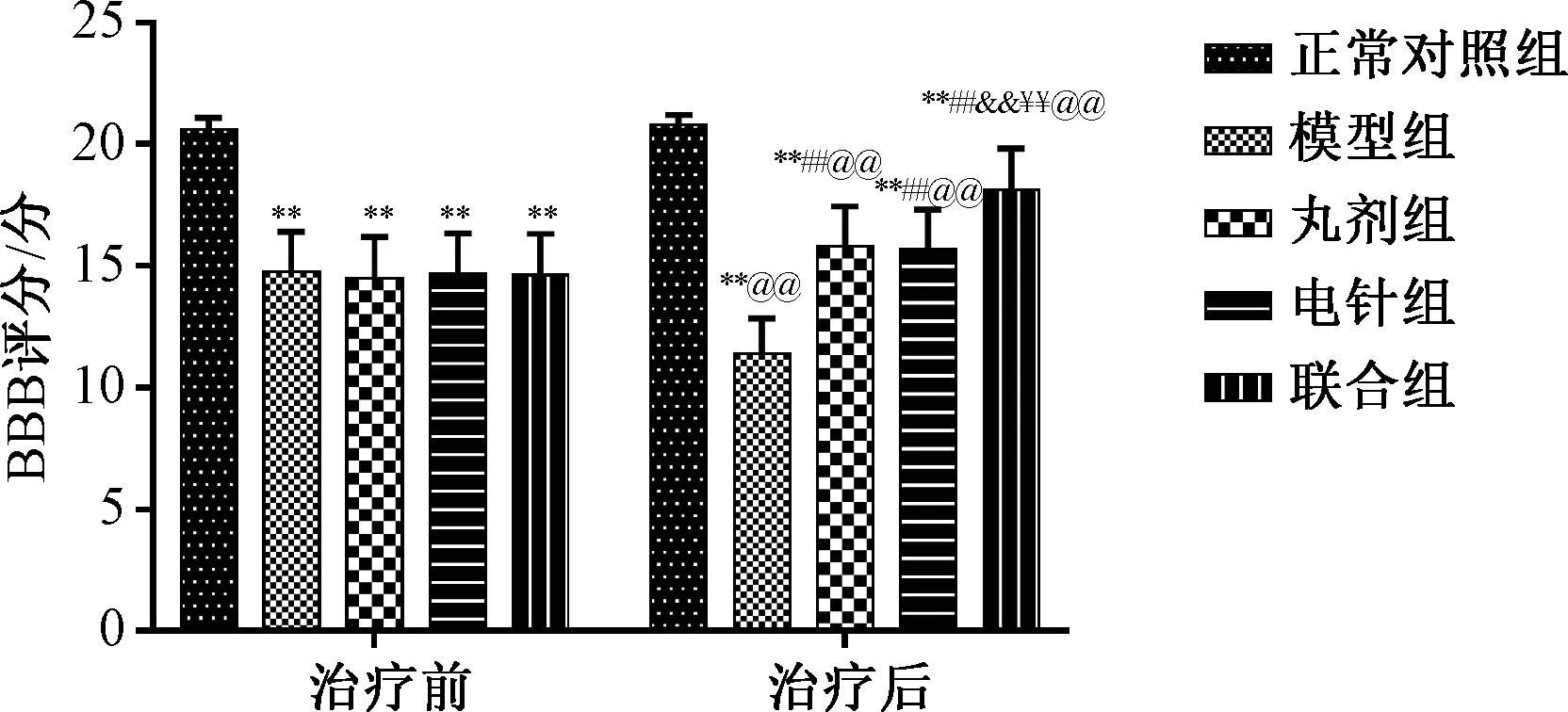
图1 治疗前后各组行为学Fig.1 Behavior of each group before and after treatment
3.2 治疗后各组损伤脊髓组织病理变化和脊髓细胞凋亡率 正常对照组大鼠神经元细胞结构完整、形态正常,灰质未见弥漫性水肿;模型组可见脊髓灰质有大量、较大空泡形成,脊髓组织的正常结构被破坏,白质中可见神经胶质细胞大量增生,受损的脊髓白质区域内可见严重微囊性病变,且神经元细胞可见严重的崩解、核碎裂表现,大量炎性细胞浸润;丸剂组和电针组可见脊髓灰质有部分、大空泡形成,白质可见神经胶质细胞增生,受损的脊髓白质区域内可见微囊性病变,且部分神经元细胞可见崩解、核碎裂表现,部分炎性细胞浸润;联合组可见脊髓灰质少量、大空泡形成,白质可见较少神经胶质细胞增生,受损的脊髓白质区域内可见较少微囊性病变,较少神经元细胞可见崩解、核碎裂表现,少量炎性细胞浸润。见图2。

图2 各组损伤脊髓组织病理变化(HE,×40)Fig.2 Pathological changes of spinal cord injury tissue in each group (HE,×40)
治疗后模型组损伤脊髓组织分级高于正常对照组(P<0.05),丸剂组、电针组和联合组均低于模型组(P<0.05),且联合组低于丸剂组、电针组(P<0.05)。见表2。治疗后模型组损伤脊髓细胞凋亡率高于正常对照组(P<0.01),丸剂组、电针组和联合组损伤脊髓细胞凋亡率均低于模型组(P<0.01),且联合组损伤脊髓细胞凋亡率低于丸剂组、电针组 (P<0.01)。见图3。
3.3 治疗后损伤区域血管生成 治疗后模型组vWF阳性血管数目多于正常对照组(P<0.01),丸剂组、电针组和联合组vWF阳性血管数目均多于模型组(P<0.01),且联合组vWF阳性血管数目多于丸剂组、电针组(P<0.01)。见图4~5。
表2 各组损伤脊髓组织病理分级()Tab.2 Pathological grade of spinal cord injury tissue in each group ()
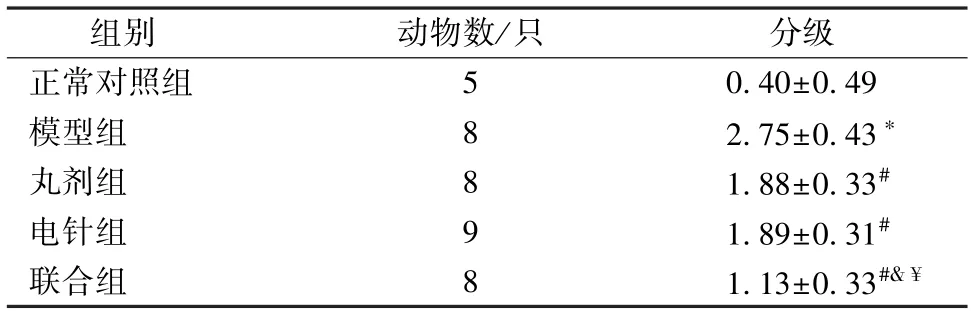
表2 各组损伤脊髓组织病理分级()Tab.2 Pathological grade of spinal cord injury tissue in each group ()
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与丸剂组比较,&P<0.05;与电针组比较,¥P<0.05。
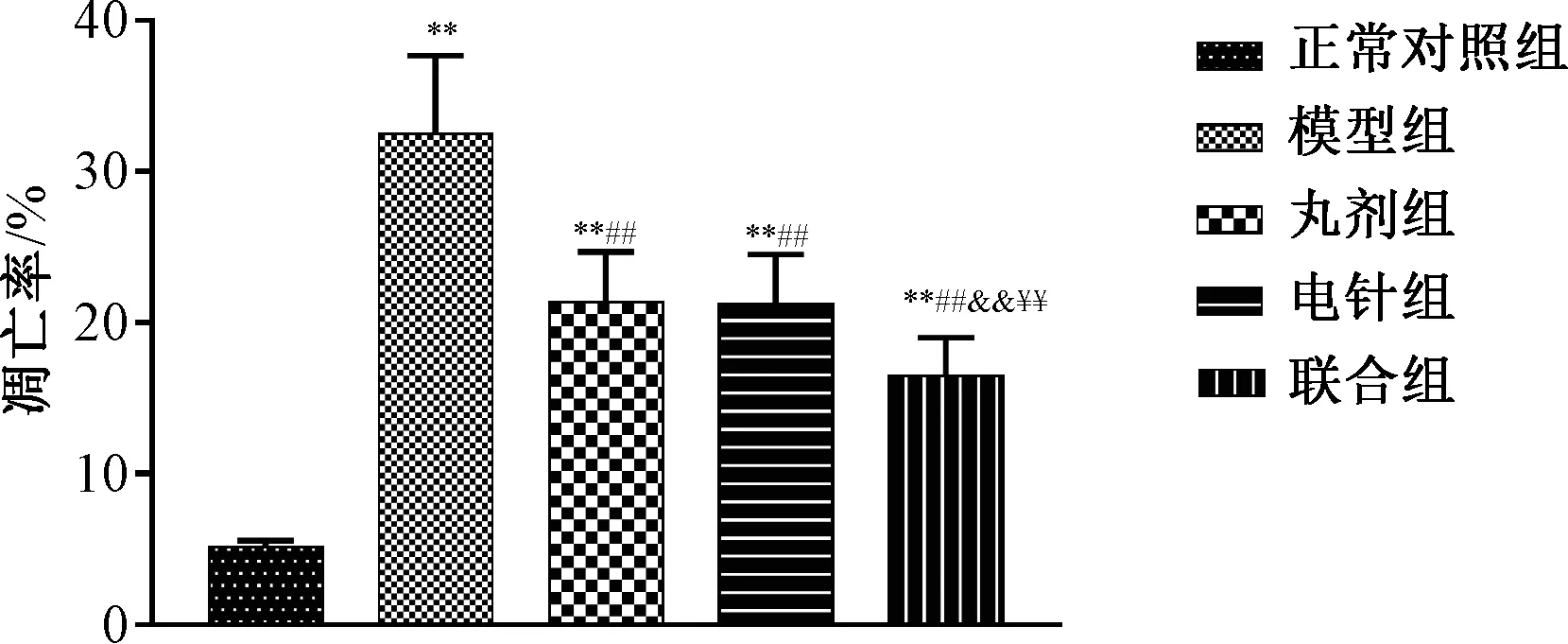
图3 各组治疗后损伤脊髓细胞凋亡率Fig.3 Post-treatment apoptosis rates of spinal cord injury tissue cells in each group
3.4 治疗后各组损伤脊髓组织BrdU、 Nestin、GFAPmRNA表达 治疗后模型组损伤脊髓组织BrdU、 Nestin、 GFAPmRNA表达均高于正常对照组(P<0.01),丸剂组、电针组和联合组损伤脊髓组织BrdU、 Nestin、 GFAPmRNA表达均高于模型组(P<0.01),且联合组损伤脊髓组织BrdU、 Nestin、 GFAPmRNA表达均高于丸剂组、电针组(P<0.01)。见图6。

图4 vWF阳性血管数目(免疫荧光染色,×100)Fig.4 Number of vWF positive blood vessel (immunofluorescence staining,×100)
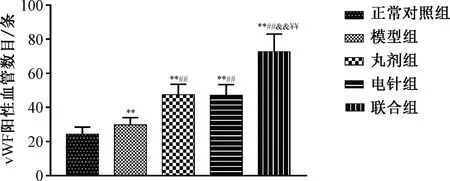
图5 各组治疗后vWF阳性血管数目Fig.5 Post-treatment number of vWF positive vessels in each group
3.5 治疗后各组损伤脊髓组织BrdU、Nestin、GFAP蛋白表达 治疗后模型组损伤脊髓组织BrdU、Nestin、GFAP蛋白表达均高于正常对照组(P<0.01),丸剂组、电针组和联合组损伤脊髓组织BrdU、Nestin、GFAP蛋白表达均高于模型组(P<0.01),且联合组损伤脊髓组织BrdU、Nestin、GFAP蛋白表达均高于丸剂组、电针组 (P<0.01)。见图7~8。
4 讨论
急性脊髓损伤后,局部神经细胞会出现某些病理性变化,如新血管生成、干细胞被激发并向损伤部位迁移等,可以为损伤组织的修复创造有利条件。但是在此过程中,由于某些因素出现拮抗作用,影响损伤脊髓组织的自我修复,如兴奋性氨基酸的毒性作用、自由基大量产生、损伤所致的严重炎症反应等[11-12]。Wan等[13]研究指出,急性脊髓损伤后常规的治疗措施难以达到理想的效果,患者往往需要较长时间的恢复过程,且肢体功能受损严重,给患者的生活质量造成极大的影响。故而该领域工作者需积极探讨新的治疗方案促进急性脊髓损伤患者脊髓功能快速恢复,改善疗效。
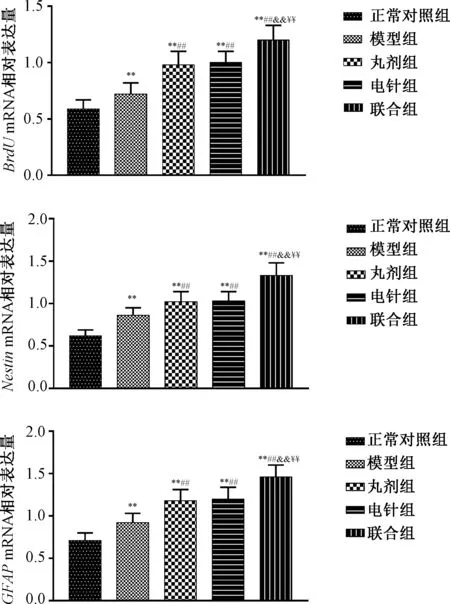
图6 各组治疗后损伤脊髓组织BrdU、 Nestin、 GFAPmRNA表达Fig.6 Post-treatment expressions of BrdU, Nestinand GFAPmRNA in spinal cord injury tissue of each group

图7 Western blot检测各组治疗后损伤脊髓组织BrdU、Nestin、GFAP蛋白表达Fig.7 Detection of post-treatment expressions of BrdU,Nestin and GFAP proteins in spinal cord injury tissue of each group by Western blot
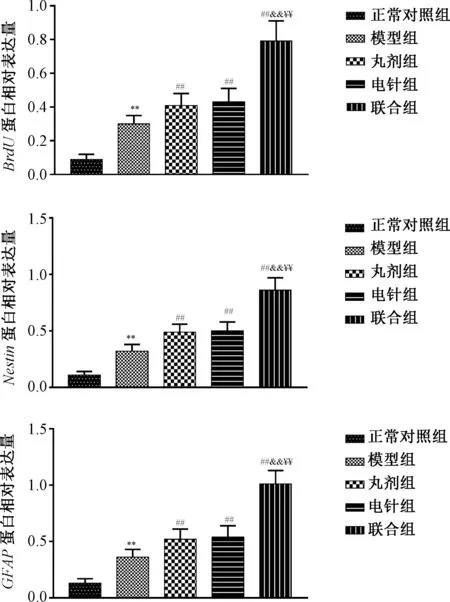
图8 各组治疗后损伤脊髓组织BrdU、Nestin、GFAP蛋白表达Fig.8 Post-treatment expressions of BrdU,Nestin and GFAP proteins in spinal cord injury tissue of each group
神经行为学功能障碍是急性脊髓损伤的共同特性,已成为临床医师关注的重点问题。本研究中模型组BBB评分显著下降,远不如正常对照组,而丸剂组、电针组和联合组治疗后BBB评分均升高且均高于模型组,联合组BBB评分明显高于丸剂组和电针组,提示蒙药珍宝丸、电针治疗急性脊髓损伤均可改善急性脊髓损伤大鼠的神经行为学功能,且蒙药珍宝丸联合电针的效果更佳。根据蒙医理论,急性脊髓损伤属于白脉病,可出现水肿、血液循环障碍和神经损伤等表现,从而损伤白脉,需针对病因实施治疗。蒙药珍宝丸具有清热除湿、舒筋活络、安神宁心等功效,对白脉病疗效理想。现代药理研究发现,蒙药珍宝丸不仅有助于增强受损的脊髓神经细胞的自我修复功能,改善局部微循环,还可清除氧自由基、控制炎症反应,最终达到加快急性脊髓损伤恢复的目的[14-15]。电针刺激大椎穴和命门穴可舒筋活络、疏通血脉,濡养经脉气血,在外力损伤督脉所致的气血逆乱、瘀阻经络病症中疗效确切。陈温慈等[16]研究表明,电针刺激急性脊髓损伤大鼠的大椎穴和命门穴可温煦气血,濡养肢体筋脉,疏利关节,益气活血。因此将蒙药珍宝丸与电针刺激大椎穴和命门穴联用治疗急性脊髓损伤可获得理想的效果。本研究中病理学观察、分级和脊髓细胞凋亡率对比结果也显示丸剂组、电针组和联合组均较模型组显著改善,提示蒙药珍宝丸联合电针治疗急性脊髓损伤效果良好,可减轻病理学改变程度,减少脊髓细胞凋亡,提示该方案具有较高的临床应用价值。
急性脊髓损伤后新血管生成是快速恢复的有利条件,而其中与相关信号通路的调控关系紧密,可增加vWF表达,促进新血管生成。BrdU属于一种胸腺脱氧核苷类似物,在细胞增殖周期S期可整合进入细胞核的脱氧核糖核苷酸中,可反映细胞增殖状态,其表达越高意味着细胞增殖越快,从而为新血管的生成提供条件[17]。Nestin属于一种中间丝类型蛋白,主要在神经上皮干细胞特异性表达,可促进神经元分化,增强损伤的脊髓神经细胞的自我修复作用,在急性脊髓损伤患者治疗中可将其作为靶点,上调其表达以改善脊髓功能。GFAP可与肌动蛋白、细胞膜相结合,增强脊髓神经细胞的迁移和黏附能力,并且还与蛋白激酶有密切关系,可共同参与脊髓损伤细胞的修复和功能改善[18]。有研究[19-21]显示,急性脊髓损伤大鼠中损伤的脊髓组织中UrdU、Nestin和GFAP均较正常大鼠高表达,而予以对症治疗可上调其表达,提示在急性脊髓损伤治疗中应上调UrdU、Nestin和GFAP表达,以改善脊髓功能。本研究中,模型组vWF阳性血管数目、损伤脊髓组织BrdU、 Nestin、 GFAPmRNA及蛋白表达均显著高于正常对照组,提示机体的自我修复机制可能启动,进而保证急性脊髓损伤的恢复,但其作用不甚理想,远不如丸剂组、电针组和联合组,且联合组的作用最佳,表明蒙药珍宝丸、电针夹脊穴和命门穴均可刺激急性脊髓损伤大鼠新血管生成,上调损伤的脊髓组织中BrdU、 Nestin、GFAPmRNA及蛋白表达,从而发挥加快恢复的作用。
综上所述,蒙药珍宝丸、电针治疗急性脊髓损伤大鼠均可改善其行为学、减轻病理损伤,并且均可促进新血管生成,二者联用的效果明显优于单独应用,且很可能是通过上调损伤脊髓组织的BrdU、Nestin、GFAP表达实现此作用的。本研究为蒙药珍宝丸联合电针在急性脊髓损伤患者临床治疗中的应用奠定了基础,提供了一种高效可行的治疗方案,但该方案对损伤脊髓组织的BrdU、Nestin、GFAP表达上调的具体机制尚不明确,仍需进一步研究探讨,以加深人们对其认识,更好地在临床中推广使用。
