miRNA-34a、SIRT6对老龄小鼠听觉皮层神经元细胞凋亡的影响及机制
2020-12-11吉杨松龙依琳谢天宏王世飞
吉杨松,饶 澄,龙依琳,谢天宏,王世飞
(遵义医科大学附属医院 耳鼻咽喉科,贵州 遵义 563099)
耳聋是常见疾病,发病机制多与听觉皮层神经有关[1],听觉皮层神经不仅可以接收听觉刺激,也可以处理早期的多感觉会聚,猕猴听觉皮层神经元对皮肤刺激也可产生反应,提示听觉皮层神经元受损引起的耳聋机制可能更为复杂。细胞凋亡尤其是神经元细胞的凋亡往往是不可逆的,听觉皮层神经元细胞凋亡一旦发生,引起持续性的听力下降,最终导致耳聋。给患者及其家属带来极大痛苦,也给社会带来较大的经济负担。增龄性聋(Age-related hearing loss,AHL)是指随着年龄的增长而出现的双耳对称、缓慢进行性的感音神经性听力减退[2]。随着我国人口老龄化的加剧,AHL的发病率呈逐年急剧增涨趋势,需予以高度重视,AHL的致病因素复杂,国内外近年来研究提示氧化应激、线粒体突变、细胞凋亡、炎症等多种途径都参与了AHL的发生发展,并且各种途径相互影响。因此,进一步明确AHL机制对老年性耳聋的进行预防、早期诊断、个性化治疗及听力言语康复具有重要意义。
本研究观察敲除了miRNA-34a或SIRT6基因的老龄小鼠听觉皮层神经元细胞凋亡的差别以及对其听觉皮层神经元中B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关的x蛋白(B-cell lymphoma-2 associated X protein,Bax)、半胱氨酸天冬氨酸蛋白酶8(Cysteine aspartic protease8,Caspase8)、半胱氨酸天冬氨酸蛋白酶3(Cysteine aspartic protease3,Caspase3)表达的影响,以期探讨miRNA-34a、SIRT6对老龄小鼠听觉皮层神经元细胞凋亡的作用机制及相互关系。
1 材料与方法
1.1 动物 miRNA-34a基因敲除小鼠10只,SIRT6基因敲除小鼠10只,野生型小鼠10只,上述小鼠来源于实验动物均由南京大学模式动物研究所提供,按要求饲养于本单位实验动物中心,喂养至16月龄并成活。获遵义医科大学伦理委员会批准。
1.2 药品及试剂 Bcl-2单克隆抗体、Bax单克隆抗体、Caspase8单克隆抗体、Caspase3单克隆抗体均购于武汉博士德生物有限公司。转移缓冲液、细胞裂解液、Bradford蛋白浓度测定试剂盒均购自美国R&D systems公司。
1.3 器材 -80 ℃冰箱(中科美菱,DW-HL388);电子天平(民桥,FA-N);超净工作台(北京亚泰隆,YT-CJ-2NB);台式冷冻离心机(湘仪,TGL-16);荧光倒置显微镜(OLYMPUS,IX51);恒温水浴箱(J-MAX,HH-2);摇床(其林贝尔,TS-92);显微镜(奥林巴斯,CX41-72C02)。
1.4 方法
1.4.1 动物分组 miRNA-34a基因敲除小鼠为miRNA-34a敲除组,SIRT6基因敲除小鼠为SIRT6敲除组,野生型小鼠为对照组,每组均为10只动物。
1.4.2 取材 喂养达16月龄后,腹腔注射0.1%戊巴比妥充分麻醉,断头后,从枕骨大孔处进入,用止血钳将颅骨一片一片剥离,剥开头顶上的颅骨后,就可用玻璃分针将整个脑组织轻轻掏出。取出后在冰上分离皮层,按小鼠大脑功能定位分区选择A1区(听觉皮层)。立即取出小鼠双侧听觉皮层放入4%多聚甲醛中固定,石蜡包埋、切片,留待作TUNEL检测及免疫组化检测。
1.4.3 TUNEL法检测各组小鼠听觉皮层神经元细胞凋亡 TUNEL染色后,在显微镜下观察各组小鼠听觉皮层神经元细胞凋亡情况,计算凋亡指数。
1.4.4 免疫组化检测各组小鼠听觉皮层神经元细胞凋亡相关基因表达情况 将石蜡切片脱蜡后,在磷酸盐缓冲液中冲洗3次,每次5分钟,室温孵育10 min后以蒸馏水冲洗3次,滴加Bcl-2、Bax、Caspase8、Caspase3单克隆抗体,室温孵育2 h,以磷酸盐缓冲液冲洗3次,每次2 min,滴加一抗后室温孵育1 h,再以磷酸盐缓冲液冲洗3次,每次2分钟,滴加二抗后室温孵育30 min,显色剂显色,自来水充分冲洗,复染,封片。在高倍显微镜下随机选择5个视野用于图像分析,以平均积分光密度表示其表达量。
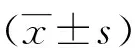
2 结果
2.1 各组小鼠听觉皮层神经元细胞凋亡指数结果 miRNA-34a敲除组小鼠听觉皮层神经元细胞凋亡指数与SIRT6敲除组相比,差异有统计学意义(P<0.05),miRNA-34a敲除组与对照组相比,差异无统计学意义(P>0.05),SIRT6敲除组与对照组相比,差异有统计学意义(P<0.05,见图1)。
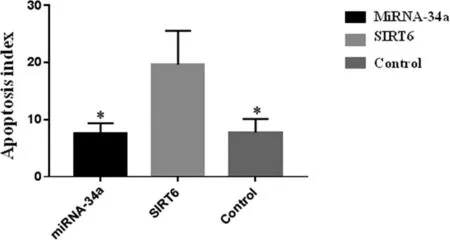
*:与SIRT6敲除组相比,P<0.05。图1 各组小鼠听觉皮层神经元细胞凋亡指数
2.2 各组小鼠听觉皮层神经元细胞凋亡相关基因表达结果 miRNA-34a敲除组小鼠听觉皮层神经元抑凋亡基因Bcl-2表达量与SIRT6敲除组相比,差异有统计学意义(P<0.05),miRNA-34a敲除组与对照组相比,差异无统计学意义(P>0.05),SIRT6敲除组与对照组相比,差异有统计学意义(P<0.05);miRNA-34a敲除组小鼠听觉皮层神经元促凋亡基因Bax、Caspase8、Caspase3表达量与SIRT6组相比,差异有统计学意义(P<0.05),miRNA-34a敲除组与对照组相比,差异无统计学意义(P>0.05),SIRT6敲除组与对照组相比,差异有统计学意义(P<0.05,见图2)。
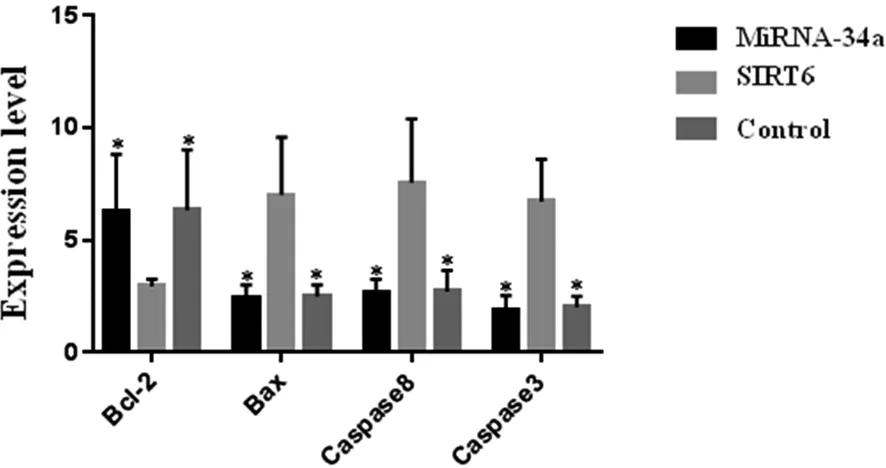
*:与SIRT6敲除组相比,P<0.05。图2 各组小鼠听觉皮层神经元细胞凋亡因子表达比较
2.3 miRNA-34a与SIRT6相关性结果 对miRNA-34a敲除组与SIRT6敲除组老龄小鼠听觉皮层神经元细胞凋亡指数行相关性分析,两组呈负相关(r=0.629,P<0.05)。
3 讨论
听觉皮层神经还可会聚动物的选择和预期的报酬大小,对声音的奖励期望和选择相关活动的影响主要在听觉皮层的纹状体后尾中[3],将特定选择的信息与整个听觉皮质层神经元途径的奖励信号相结合,可能有助于声音驱动行为的适应[4]。电生理研究表明,听觉皮层神经元还可编码声音刺激的时间结构,选择性的关注一种声音而忽略其他声音刺激[5],本研究未能对miRNA-34a与SIRT6基因敲除老龄小鼠进行各种声音刺激,因此无法确定小鼠听觉皮层神经元细胞不同凋亡情况与不同声音刺激的相关性,今后的研究的中如能进行相关研究,则有助于了解听觉皮层神经元细胞凋亡与神经元对声音刺激的定量改变,有利于听觉皮层神经元的保护研究。
增龄性聋(Age-related hearing loss,AHL)是指随着年龄的增长而出现的双耳对称、缓慢进行性的感音神经性听力减退。随着我国人口老龄化的加剧,AHL的发病率呈逐年急剧增涨趋势,需予以高度重视,AHL的致病因素复杂,国内外近年来研究提示氧化应激、线粒体突变、细胞凋亡等多种途径都参与了AHL的发生发展,并且各种途径相互影响。中枢神经系统发育在不同的发育时期神经炎症相关因子子存在差异[6],因此炎症也在参与了AHL的进程。
MicroRNA(miRNA)是一组内源性非编码RNA(长度为22nt),可通过与特定mRNA的3'-非翻译区(3'-UTR)完全或部分互补来诱导靶基因沉默,以序列特异性方式参与转录后基因表达调控,是重要的基因调节剂,参与到多种细胞过程[7]。miRNA-34a是一种较为保守的miRNA,通常作为癌症的生物标记物,其介导癌症细胞多与细胞增殖、细胞凋亡等相关。miRNA-34a在脑组织中主要通过介导细胞凋亡因子干预细胞生物过程,对miRNA的生理学和与疾病相关的机制的更多了解可能有助于开发诊断和治疗各种疾病的新策略。miRNA有望成为神经退行性疾病早期诊治及病情评估的新思路和新方法[8]。
SIRT6是Sirtuin NAD+依赖性酶家族的成员,既往对长寿基因SIRT1研究较深入,SIRT1基因维持细胞染色质沉默,保护细胞应对氧化损伤[8],其活性形式可与抑癌基因 P53 结合,参与 P53 介导的信号传导[9],影响多种恶性肿瘤发生发展及机体衰老进程的。目前另一长寿基因SIRT6逐渐被人们重视,因其在染色质信号传导和基因组维持中发挥重要作用。且SIRT6可以防止与衰老相关的疾病发生,甚至包括代谢疾病和癌症。近年来的研究表明,SIRT6是一种复杂的酶,具有多种底物和催化活性,可介导多种细胞凋亡途径,发挥抑制细胞凋亡作用[10]。SIRT6是一种营养传感器和组蛋白脱乙酰基酶,SIRT6的缺失会导致其下游凋亡基因过度乙酰化,驱动凋亡因子表达[11]。SIRT6的下调可以模拟miRNA-34a,发挥促进细胞凋亡作用。
SIRT6能够对 PARP1、NF-κB 以及Hif-1α这三个转录因子在组蛋白上进行去乙酰化而起到调控作用,使它们在参与其各自炎症反应、下游 DNA的损伤修复以及调控与糖类、脂类等能量代谢相关酶的表达或功能方面表现出有利于机体自身的效应。生物体之所以能在演变过程 中维持基因组结构与功能的相对稳定,也许正是通过减少炎症因子对机体的不良作用,减少DNA 的损伤,以及提高与能量代谢有关酶的正常生理活动,以达到改善能量代谢功能低下与紊乱状态,从而显现出延缓衰老的效应。近年国内有学者研究显示,miR-34a在“老年”的年龄相关性聋模型C57BL/6小鼠听皮层组织中高表达[12],SIRT6是一个理想的“长寿因子”,如何调控SIRT6,可能成为未来研究人类抗衰老及老年性疾病的关键点。
Bcl-2基因家族成员因含有不同Bcl-2同源结构域而分别发挥抗凋亡与促凋亡活性,Bcl-2含有完整的4个同源结构域,可发挥抗凋亡活性,听觉皮层神经元细胞中,Bcl-2是miRNA-34a的直接靶标,可通过抑制Bcl-2表达,促进细胞凋亡[13]。本研究发现,敲除miRNA-34a基因小鼠的听觉皮层神经元细胞中Bcl-2表达增高,敲除SIRT6基因小鼠的听觉皮层神经元细胞中Bcl-2表达降低,两组相比,差异有统计学意义(P<0.05),说明miRNA-34a与SIRT6均可调控Bcl-2表达,进而调控听觉皮层神经元细胞的凋亡。
Bax是线粒体凋亡途径的主要效应基因,线粒体蛋白可与Bax复合,在缺氧时,Bax表达增高,引起细胞变性,进而发生凋亡。本研究对各组小鼠听觉皮层神经元细胞中Bax进行了检测,发现miRNA-34a敲除组小鼠听觉皮层神经元细胞中Bax表达降低,SIRT6敲除组小鼠听觉皮层神经元细胞中Bax表达增高,两组相比,差异有统计学意义(P<0.05),说明敲除SIRT6敲除可引起小鼠听觉皮层神经元细胞凋亡,而这种凋亡的发生可能与缺氧相关,敲除miRNA-34a可抑制小鼠听觉皮层神经元细胞凋亡,表明miRNA-34a可促进听觉皮层神经元凋亡、而SIRT6可抑制听觉皮层神经元凋亡,但二者对内耳听毛细胞的凋亡中的作用以及介导细胞生物过程的机制复杂,仍需深入研究。
外源性细胞凋亡途径是细胞凋亡的主要途径,以Caspase8为起始基因,Caspase8表达增高也可引起炎症反应,促进细胞炎症因子表达,诱导细胞变性,从而发生凋亡,凋亡又可引起Caspase8过表达,形成恶性循环。因此,Caspase8过表达通常被认为是细胞凋亡的开始。此外,Caspase8也可可抑制RIPK3和MLKL介导的坏死性坏死,即使是失活的Caspase8也能引起小鼠胚胎致死。本研究发现,miRNA-34a敲除组小鼠听觉皮层神经元细胞中Caspase8表达降低,SIRT6敲除组小鼠听觉皮层神经元细胞中Caspase8表达增高,两组相比,差异有统计学意义(P<0.05),说明miRNA-34a与SIRT6均参与调控外源性细胞凋亡途径的发生。Caspase3是多种细胞凋亡途径的最下游基因,Caspase3表达增高则可说明凋亡被执行。本研究发现,miRNA-34a敲除组与SIRT6敲除组小鼠听觉皮层神经元细胞中Caspase3表达相比,差异有统计学意义(P<0.05),说明敲除miRNA-34a与SIRT6基因后,小鼠听觉皮层神经元细胞发生凋亡的情况有所不同,miRNA-34a可促进听觉皮层神经元凋亡、而SIRT6可抑制听觉皮层神经元凋亡。
近年来miRNA-34a与SIRT6在其他组织器官中的相关性研究较多,多数学者发现miRNA-34a与SIRT6在细胞凋亡中的作用负相关[14],但在听觉皮层神经元细胞凋亡中的作用罕见报道。本研究对miRNA-34a组与SIRT6在老龄小鼠听觉皮层神经元细胞凋亡指数的相关性研究表明,两者呈负相关,其中miRNA-34a促使小鼠听觉皮层神经元细胞凋亡,SIRT6抑制小鼠听觉皮层神经元细胞凋亡,二者在老龄小鼠听觉皮层神经元细胞凋亡中的作用负相关,可通过敲除miRNA-34a或增加SIRT6阻止小鼠听觉皮层神经元的凋亡。
综上所述,敲除miRNA-34a可以抑制老龄小鼠听觉皮层神经元细胞凋亡,敲除SIRT6可以促进老龄小鼠听觉皮层神经元细胞凋亡,两者在调控老
龄小鼠听觉皮层神经元凋亡中负相关,其作用途径可能与Bcl-2抗凋亡作用相关,也可能与线粒体凋亡途径、外源性细胞凋亡途径相关。miRNA-34a与SIRT6可能是治疗听觉皮层神经元损伤及老年性聋的新靶点。
