LNK基因表达改变对THP-1细胞增殖及凋亡的影响
2020-12-11沙梦琪田润梅龙圆圆陈婷婷
沙梦琪,田润梅,龙圆圆,陈婷婷,陈 艳
(遵义医科大学附属医院 小儿内二科,贵州 遵义 563099)
急性单核细胞白血病(Acute monocytic leukemia,M5)是急性髓细胞白血病中一种较为常见的类型,约占急性髓细胞白血病的20%~30%,其复发率高、预后差[1-3]。由于AML复发率高及部分患者耐药,促使目前的治疗方案在不断改进,而现如今越来越多的研究发现白血病的发生、发展与基因突变有关,故分子靶向治疗可能给白血病患者带来新的曙光。LNK基因是一个编码575个氨基酸的基因,位于人类12q24,其编码的蛋白为淋巴细胞特异连接蛋白(Lymphocyte adaptor protein),即LNK蛋白,是连接蛋白SH2B家族的成员之一[4]。在生理及病理条件下,LNK基因可参与各种细胞因子及信号通路的调节,是维持造血功能稳定的关键因素[5]。近年来有研究显示,在骨髓增殖性肿瘤、急性淋巴性白血病、唐氏综合症相关的髓系疾病等患者中存在LNK基因突变[6-9],LNK基因的突变或功能丧失可导致造血细胞增殖和分化失调[10-11],与血液系统恶性肿瘤的发生有关。同时,过表达LNK基因可以不同程度抑制Hel、K562、NB4等多种白血病细胞的增殖,认为LNK基因可能对白血病有一定的抑癌作用[12]。Ge等[13]发现SH2B3表达低的急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)患者复发率高、无病生存率低。本课题组前期研究结果显示急性髓细胞白血病(Acute myeloid leukemia,AML)及慢性粒细胞白血病(Chronic myelogenous leukemia,CML)的患者骨髓中LNK基因表达较正常人增高,尤其是M5患者表现明显[14],复发患者表达更高。由此可见,LNK基因与白血病有着较为紧密的关系,但具体原因目前尚不清楚。因此,我们以慢病毒为介导SiRNA构建稳定沉默LNK基因的THP-1细胞株,并进一步检测THP-1细胞增殖及凋亡情况,从而初步了解LNK基因表达的改变对THP-1细胞增殖及凋亡的影响,为白血病靶向治疗提供理论依据。
1 材料与方法
1.1 实验材料 人急性单核细胞白血病细胞株(本课题组前期已培养);LNK基因SiRNA慢病毒载体为课题组前期所用载体[15]。
1.2 主要试剂及仪器 胎牛血清、RPMI-1640培养液购自美国Gibco公司;引物由上海生工公司合成;BCA蛋白定量试剂盒购自上海绿泽生物技术有限公司;A-5082 酶标仪购自TECAN公司;SDS- PAGE凝胶配制试剂盒购自碧云天公司;PVDF膜购自美国Millipore公司;双色预染蛋白Marker、ECL显影液均购自上海雅酶生物科技有限公司;Anti-LNK兔单克隆抗体、山羊抗兔二抗均购自美国Abeam公司;Thermo Scientific Forma CO2培养箱(型号3110)购自美国Forma Scientific公司;TDGC2-0.5超净工作台购自上海先锋电器厂;成像系统、CFX96TMReal-Time PCR仪购自美国BIO-RAD公司;高速离心机购自德国Eppendorf Centrifuge公司;FACSCalibur流式细胞仪购自美国BD公司。
1.3 THP-1细胞复苏及培养 在无菌操作的基础上,将含有THP-1细胞的冻存管放入37 ℃的水浴箱中,待完全解冻后,于超净台上进行用移液管吸出细胞悬液,并将细胞悬液加入到含有完全培养基的离心管、混匀,1 000 rpm离心5 min,弃去上层清液,加入培养基、重悬、计数,调整细胞密度,接种培养基,于培养箱中继续培养。2 h后更换新鲜培养液,后根据细胞生长的情况,酌情换液及传代。
1.4 慢病毒感染THP-1细胞 实验分为沉默LNK组、过表达LNK组、空转组及对照组。按照病毒操作说明,本课题组前期已摸索最佳病毒感染复数(Multiplicity of Infection,MOI),一般情况下按MOI为100进行转染。收集THP-1细胞,离心后加入新鲜的完全培养基重悬并计数。将细胞悬液加入无菌孔板中,分别向沉默LNK组、过表达LNK组、空转组及对照组加入相应的慢病毒,并按照感染步骤加入其余试剂后离心、感染。待感染72 h后,将其放置于荧光显微镜下观察各组绿色荧光蛋白的表达量了解慢病毒感染情况;加入含有嘌呤霉素的新鲜完全培养基来筛选出稳定感染的细胞株。
1.5 流式细胞术检测细胞感染效率 收集沉默LNK组、过表达LNK组、空转组及对照组这4组THP-1细胞,1 000 rpm离心5 min,细胞计数后取1×106个。用PBS缓冲液清洗2次,1 000 rpm离心5 min,弃上清液,避免接触细胞沉淀,然后通过加入适量结合缓冲液调整细胞浓度(2×105个/mL),并转移至5 mL流式管,最后用流式细胞仪检测细胞感染效率。
1.6 RT-PCR检测LNK基因mRNA水平 收集培养的各组细胞,移至离心管中,4 ℃ 10 000 rpm离心5 min,弃去上清液,用PBS缓冲液洗涤2次,移至去酶EP管,严格按照试剂盒的操作步骤来提取细胞RNA,加入DEPC水溶解RNA(根据析出的RNA多少决定DEPC水所需加入的体积),并上机检测RNA浓度。实验步骤按照逆转录试剂盒的说明书进行,根据设定的RNA浓度,计算加入RNA的总体积,然后按照逆转录体系将所需试剂加入去酶EP管中,从而将RNA逆转录为较为稳定的cDNA,并应用RT-PCR检测LNK基因mRNA水平的表达量。以GAPDH作为对照,根据PCR仪检测的CT值,采用2-△△CT(Livak)方法进行相对定量分析计算得出目的基因表达量。引物序列为:LNK上游5'-TGGAGAGCACAGAAGCAGAGATG-3' 和下游5'-ACCAGGGGTAGCAGGACAGGA-3' ;GAPDH上游 5'-TCAAGAAGGTGGTGAAGCAGG-3'和下游 5'-AGCGTCAAAGGTGGAGGAGTG-3'。RT-PCR扩增条件为:先95 ℃ 30 s,后95 ℃ 5 s,53 ℃ 30循环40次。
1.7 Western Blot 检测LNK基因蛋白水平 用EP管收集各组培养的THP-1细胞(约5~8×106个细胞),丢弃培养基,10 000 rpm离心5 min,保留细胞团块。用PBS缓冲液洗涤细胞2次,10 000 rpm离心5 min,弃上清、留细胞团块,加入细胞裂解液、混匀,冰上放置30 min。离心机先预冷至4 ℃,12 000 rpm离心30 min,将上清移入新的EP管中,避免吸入絮状物,即为细胞总蛋白。用BCA法测定蛋白浓度,加入上样缓冲液震荡混匀,关紧EP管盖子煮沸5~8 min后冷却至室温,放入-20 ℃备用。根据说明书的实验步骤,配制好10%分离胶与5%浓缩胶,每孔蛋白上样50 μg,设置适合的电压后开始电泳,电泳结束后剪膜、切胶,再设置适合的电压进行电转,在5%脱脂奶粉中加入已成功转膜的PVDF膜进行封闭2 h,洗膜后敷一抗(按1∶1 000稀释)4 ℃孵育过夜,再洗膜后敷二抗(按1∶3 000稀释),室温孵育1 h,采用ECL发光法,将A、B液按照1∶1进行混匀后加至PVDF膜上进行发光显影。以GAPDH为内参,运用Image Lab软件进行灰度值分析,各分组的灰度值与GAPDH的比值表示目的蛋白相对表达量。
1.8 CCK-8法检测细胞增殖 收集生长状态良好的对数生长期的各组THP-1细胞,10 000 rpm离心5 min,细胞计数,数量足够时(一般约5×104个细胞)即可进行CCK8检测;取3个无菌96孔,分别标记24、48、72 h三个时间段,并分别标注好分组,每组设置6个复孔;细胞培养24、48、72 h后取出相应的96孔板,向每孔中加入10 μl CCK-8试剂,在培养箱内孵育2 h,然后用酶标仪检测450 nm波长处的细胞吸光度(OD值),最后进行统计学分析。
1.9 流式细胞术检测细胞凋亡 收集培养的各组细胞,用PBS洗涤2次,1 000 rpm离心5 min,弃上清液,加入适量结合缓冲液调整细胞浓度(2×105个/mL),并转移至5 mL流式管,最后用流式细胞仪检测细胞凋亡情况。
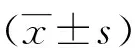
2 结果
2.1 慢病毒感染THP-1细胞72 h的绿色荧光表达量 结果显示:沉默LNK组、过表达LNK组及空转组的绿色荧光蛋白表达量均可达到85%以上(见图1)。
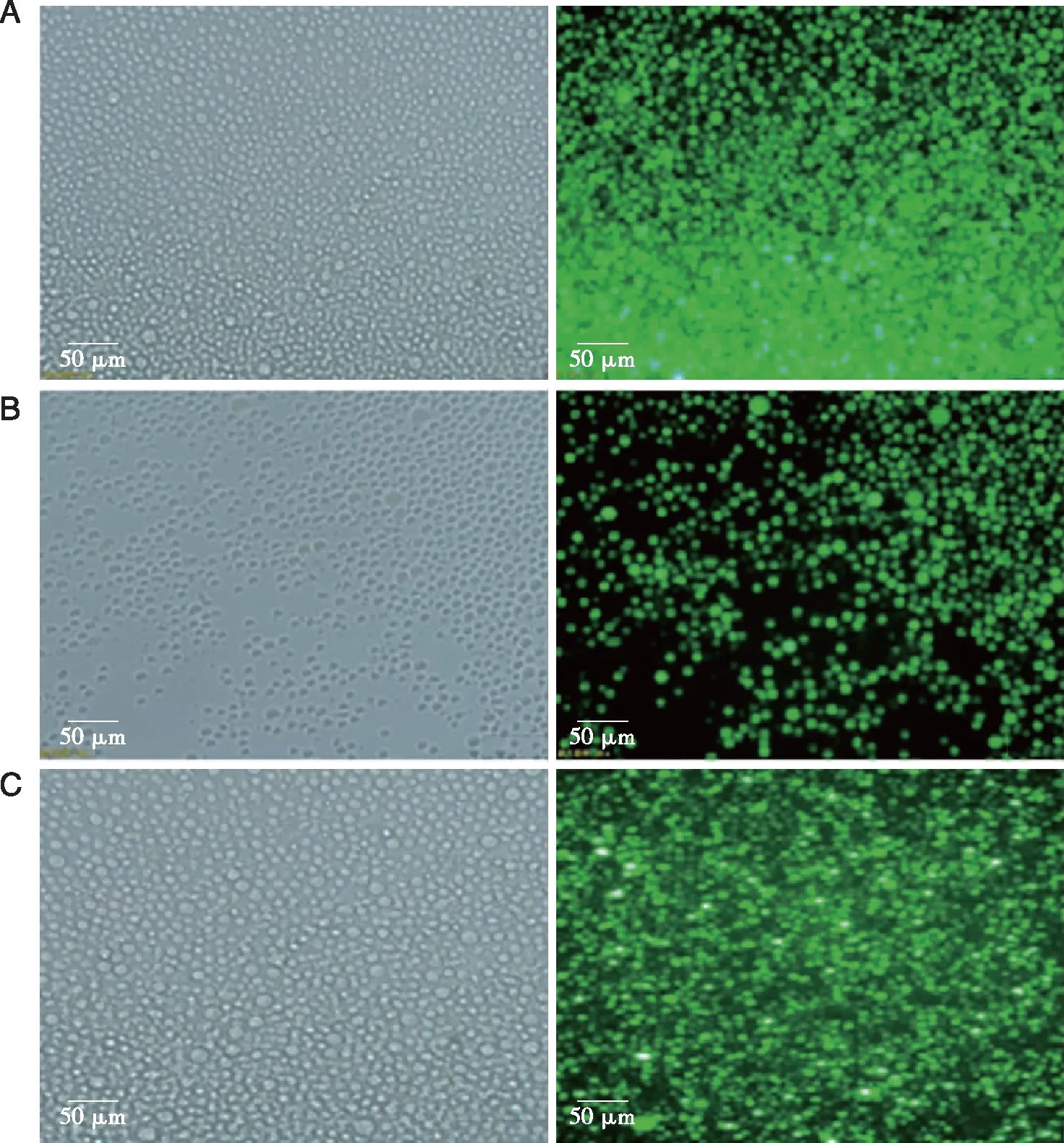
2.2 慢病毒感染THP-1细胞的感染效率 流式细胞仪检测结果显示:对照组、空转组、沉默LNK组及过表达LNK组THP-1细胞的感染效率分别为(0.81±0.16)%、(99.60±0.27)%、(99.67±0.24)%和(99.71±0.17)% (见图2),提示慢病毒转染成功,可继续后续实验。
A:Empty virus group(×100);B:Si-LNK(×100);C:VP-LNK(×100)。图1 慢病毒转染72 h后THP-1细胞绿色荧光蛋白的表达量情况
图2 流式检测各组慢病毒感染效率
2.3 各组THP-1细胞株LNK基因mRNA表达水平 空转组 LNK mRNA表达水平与对照组相比无明显差异(P>0.05),说明慢病毒感染对THP-1细胞中LNK基因的mRNA表达水平无明显影响。然而,与对照组(1.115±0.056)相比,沉默组的LNK mRNA表达水平(0.236±0.088)显著降低(P<0.05),而过表达组(1.682±0.055)则明显升高(P<0.05,见图3),提示可能成功沉默或过表达LNK基因。
2.4 Western blot各组THP-1细胞株LNK蛋白水平 LNK蛋白表达水平在对照组与空转组之间无明显差异(P>0.05),进一步说明慢病毒感染对LNK基因的表达没有明显影响。与对照组相比,沉默组的LNK蛋白表达水平显著降低(P<0.05),而过表达组明显增高(P<0.05,见图4),证实THP-1细胞中LNK基因沉默或过表达成功。

*:与对照组比较,P<0.05。 图3 各组THP-1细胞中LNK基因在mRNA水平的表达情况

*:与对照组比较,P<0.05。图4 各组THP-1细胞中LNK蛋白水平的表达情况
2.5 沉默及过表达LNK基因对THP-1细胞增殖的影响 通过CCK8法检测了4组THP-1细胞三个时间段(24、48、72 h)的增殖情况,结果发现LNK沉默组THP-1细胞OD值较对照组明显减低(P<0.05),提示THP-1细胞的增殖活性降低,而过表达LNK组及空转组THP-1细胞增殖较对照组无明显变化(P>0.05,见图5)。
2.6 沉默及过表达LNK基因对THP-1细胞凋亡的影响 流式细胞仪凋亡检测结果显示:与对照组相比,沉默LNK组THP-1细胞凋亡率明显增高,差异具有统计学意义(P<0.05),而过表达LNK组及空转组较对照组无统计学差异(P>0.05,见图6)。
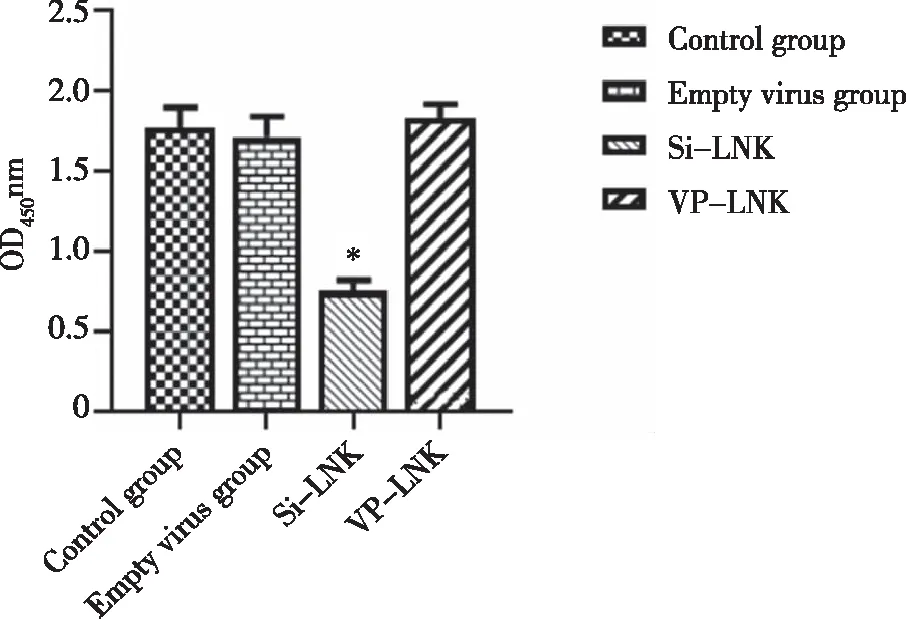
*:与对照组比较,P<0.05。图5 各组THP-1细胞的增殖情况
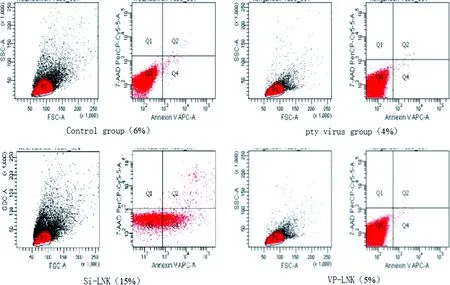
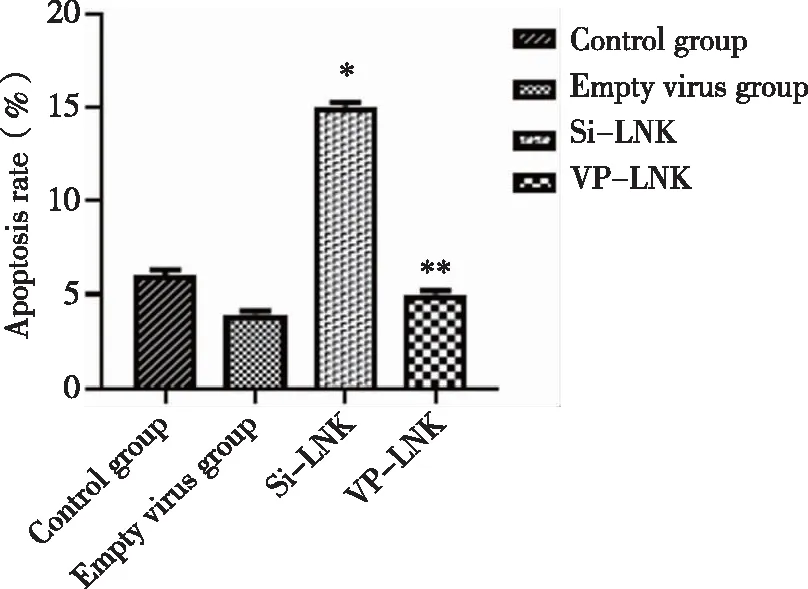
*:与对照组比较,P<0.05。图6 各组THP-1细胞的凋亡情况
3 讨论
LNK是一个在正常和恶性造血细胞中广泛表达的编码淋巴细胞连接蛋白的基因,参与调控造血祖细胞的增殖和分化。然而,LNK基因在不同类型细胞中的表达及作用尚存在争议,尤其是肿瘤细胞。Perez-Garcia等[7]发现LNK基因突变与ALL的遗传易感性相关,并认为其可能是延缓或抑制急性淋巴细胞白血病发生的一个重要基因。同时,还发现LNK基因的缺失会导致激酶信号转导和转录激活信号的增加,从而促进了淋巴样细胞的增殖,最终加速了白血病的发展,因此,LNK基因的缺失可能是白血病发生及发展的一个危险因素[16]。本课题组前期研究发现急性髓细胞细胞白血病和慢性粒细胞白血病患者LNK基因表达增高[14,17],为了进一步探索LNK基因在髓系白血病中的作用,我们在此基础上进行了体外研究,结果发现THP-1细胞中LNK基因沉默后,细胞增殖速度明显减慢,且凋亡显著增多,提示LNK基因的正常表达对维持THP-1细胞的正常生长有重要作用。然而,既往有研究报道,在多种血液系统恶性肿瘤[6-9,12]中沉默LNK基因可以促进癌细胞增殖,但对于U937、Kasumi-1等细胞系的增殖并无明显影响。Cheng等[18]研究发现LNK基因可以通过与磷酸化JAK3的直接相互作用减弱IL-7刺激的信号传导来抑制前B淋巴细胞增殖和白血病的发生。而Ding等[19]的研究结果与本实验结果相似,发现LNK基因可以在卵巢癌细胞中发挥肿瘤存活特性,通过延长AKT和MAPK信号,减缓细胞迁移,并促进肿瘤生长;而沉默LNK可以抑制肿瘤细胞的增殖,其考虑是体内某些代谢物耗尽或者其他应激反应减少了激活的AKT和MAPK信号,不能维持代谢需要,从而减慢了这些细胞的增殖。
既往研究认为LNK基因是一个负调控基因,但在本实验及部分研究中LNK基因在一定条件下存在正调控作用[19]。为什么LNK基因在不同白血病细胞及实体肿瘤细胞中的作用不同?随着近年来研究的深入,发现LNK基因不具有酶活性,其功能依赖于其分子结构。SH2(Src homology 2)结构域是LNK基因所编码的蛋白的结构之一,有研究认为,SH2结构域是LNK功能正常发挥所必不可少的结构之一,而LNK的抑制肿瘤作用也主要由SH2结构域介导[7],同时PH结构域也有一定的协同作用[20-21]。有研究显示,在骨髓增殖性疾病(Myeloproliferative neoplasm,MPN)的患者中,LNK基因的突变可累及SH2或者PH结构域,从而失去负性调节作用[22-23],同时,急变期的MPN患者与其它分期相比较,LNK基因突变率更高。我们课题组在前期研究中亦发现在慢性粒细胞白血病患者中存在LNK基因突变,其中大部分的SH2和PH结构域均有所受累[24-25]。此外,还有研究发现部分肿瘤中LNK基因的突变或异常表达,使其对应的结构域发生改变导致其抑制作用减弱或丧失,从而使造血细胞异常增殖[20,26]。由此可见,LNK可能在生理条件下发挥负性调控作用,而在病理条件下,其负性调控作用可能减弱甚至丧失,从而导致大量肿瘤细胞无限增殖。
本研究中沉默LNK基因后发现THP-1细胞增殖减慢并促进其凋亡,但我们通过将LNK基因过表达后却未相对应地起到促进增殖及抑制凋亡的作用,说明过表达LNK基因对THP-1细胞的增殖及凋亡无明显影响。既往有研究报道的情况与本实验的结果相似[27]。也有研究发现,MPN患者中LNK水平上调可抑制肿瘤细胞增殖[20],然而过表达LNK基因则可以促进卵巢癌细胞的增殖[19],提示在不同肿瘤细胞中,LNK基因表达改变其产生的作用不尽相同。本实验中LNK基因过表达后并未影响THP-1细胞的增殖和凋亡,可能是LNK基因结合的细胞因子或者触发了其他通路改变了其反向作用,但具体机制不清楚,有待于进一步研究。
总之,本研究发现沉默LNK基因对THP-1细胞有抑制增殖、促进凋亡的作用,而过表达LNK基因则无明显影响。我们推测可能是由于在白血病细胞中LNK表达的异常改变或基因变异,使相应的结构域发生改变,导致LNK不能完全与相应的激酶结合,从而使LNK负性调控的功能减弱或丧失。另外,LNK可能存在其他基因参与协同调控信号,导致LNK基因并非仅仅依靠信号通路调控细胞增殖及凋亡。然而,过表达LNK基因并未呈现相对应地反向作用,可能是存在某些分子参与结合LNK基因,或者其他应激作用触发信号通路改变使其呈现单向性作用,但以上论点还需进一步研究证实。
