DLL3表达与晚期小细胞肺癌含铂化疗疗效及预后的相关性
2020-12-07韩淑华黄见玲曹丹丹苑仁祥刘丹丹齐保龙
韩淑华,黄见玲,曹丹丹,苑仁祥,刘丹丹,齐保龙
0 引言
小细胞肺癌(small cell lung cancer,SCLC)起源于支气管神经内分泌细胞,是肺癌中较为特殊的一种类型,占全球每年新发肺癌病例的15%~20%[1-2]。SCLC生长迅速,增殖率高,易早期发生转移,恶性程度在所有类型肺癌中最高。目前SCLC常用的临床分期标准有AJCC/UICC的TNM分期及美国退伍军人医院的局限期(1imited disease,LD)/广泛期(extensive disease,ED)两种方法,LD对应TNM分期中的Ⅰ~Ⅲ期,ED对应Ⅳ期。对于晚期SCLC(Ⅲ期+Ⅳ期)患者,化疗是主要的治疗手段,标准的初始治疗为顺铂或卡铂联合依托泊苷[3-4],虽然早期能够取得一定疗效,但容易产生耐药及复发,整体预后较差,目前仍缺乏评估化疗疗效及预后的生物学标志物。
DLL3是Notch信号通路的配体之一,在正常肺组织和肺鳞癌中无表达,但在80%以上的SCLC细胞表面可检测到DLL3的表达,更重要的是DLL3在肿瘤起始细胞和耐药肿瘤细胞中表达[5-7],提示DLL3可能与SCLC复发及耐药相关,但目前关于DLL3在SCLC中的表达与化疗疗效及预后的关系尚不清楚,本研究回顾性分析DLL3在晚期SCLC组织中的表达与晚期或转移性SCLC一线含铂化疗疗效的关系及其预测预后的价值。
1 资料与方法
1.1 临床资料
收集2014年2月—2017年12月在东南大学附属中大医院首次诊断为Ⅲ/Ⅳ期SCLC并治疗的64例患者,所有患者诊断均经纤维支气管镜或肺穿刺活检获得病理确诊。末次随访时间是2018年6月30日。其中男55例,女9例;中位年龄为66岁(44~89)岁,ECOG评分0~1分;78.1%(50/64)患者为吸烟者;按2017国际抗癌联盟(Union for International Cancer Control,UICC)肺癌TNM分期分为:Ⅲ期23例,Ⅳ期41例。64例患者均完成2周期以上EP方案化疗(顺铂:25 mg/(m2·d)×3和依托泊苷:100 mg/(m2·d)×3,每21天为一周期);纳入标准:(1)年龄≥18岁;(2)肺部有可测量的病灶;(3)ECOG评分0~1;(4)预计生存时间≥2月;(5)具有足够石蜡包埋组织。排除标准:(1)严重的心脑血管疾病、肝肾功能障碍和血液系统疾病;(2)合并其他系统恶性肿瘤或肺转移性肿瘤。该研究获得医院伦理委员会审核批准(2018ZDSYLL089),组织标本收集及应用经得患者及其家属知情同意。
1.2 免疫组织化学检测DLL3在晚期SCLC组织中的表达
兔抗DLL3多克隆抗体购自美国Abcam公司,羊抗兔二抗、即用型SABC试剂盒购自武汉博士德生物技术公司,DAB显色液、柠檬酸钠抗原修复液、苏木精染液均购自上海碧云天生物技术有限公司。主要步骤:切取3 μm厚石蜡包埋组织,切片脱蜡水化,柠檬酸钠抗原修复液修复20 min,3%H2O2孵育10 min阻断内源性过氧化物酶活性,PBS缓冲液冲洗,DLL3多克隆抗体按1:100稀释后4℃过夜,生物素标记的二抗37℃孵育15 min,SABC 37℃孵育15 min,DAB染色,苏木精对比染色,酒精脱水,中性树胶封片。采用免疫组织化学染色结果半定量分析计数系统,根据阳性细胞百分率(percentage of positive cells,PPC)和染色强度(staining intensity,SI)综合计分进行结果判定。其中染色强度:无染色为0分、弱染色为1分、中等染色为2分、强染色为3分,阳性细胞的百分率:无阳性细胞为0分、<10%阳性细胞为1分、10%~50%阳性细胞为2分、≥50%~80%阳性细胞为3分、≥80%阳性细胞为4分,以两者乘积免疫组织化学总分(immuno-reactive sum score,IRS)进行分组,即IRS=SI×PPC,IRS≥6分为高表达组(DLL3-high),<6分为低表达组(DLL3-low)。
1.3 疗效评估
按照实体肿瘤的疗效评价标准1.1(RECIST 1.1),每2周期化疗后进行疗效评估。包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD),CR或PR的患者4周后再确认疗效。有效率(response rate,RR)=(CR+PR)/总病例数×100%。疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总病例数×100%。预后分析指标:无进展生存期(progression-free survival,PFS)定义为从首次诊断至疾病进展或最后一次随访的时间。总生存期(overall survival,OS)定义为从首次诊断到死亡或最后一次随访的时间。
1.4 统计学方法
应用SPSS24.0软件进行数据分析。DLL3表达与临床特征、化疗疗效的相关性采用χ2检验,应用Kaplan-Meier方法进行单因素生存分析,Log rank检验差异性,Cox比例风险回归模型进行预后多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 DLL3表达与临床特征的关系
全组64 例晚期SCLC患者中,有54 例(84.1%)患者DLL3表达阳性,其中DLL3低表达(0<IRS<6)34例(54.7%);DLL3高表达(IRS≥6)20例(29.7%),10例无阳性表达(IRS=0)。阳性表达为细胞膜出现棕黄色颗粒,见图1。根据1.2分组标准,最终10例无表达患者与34例IRS<6分的低表达患者被分至DLL3-low组(n=44),20例IRS≥6分的患者被分至DLL3-high组(n=20)。DLL3表达与患者性别、年龄、分期、肿瘤大小无相关性(P>0.05),见表1。
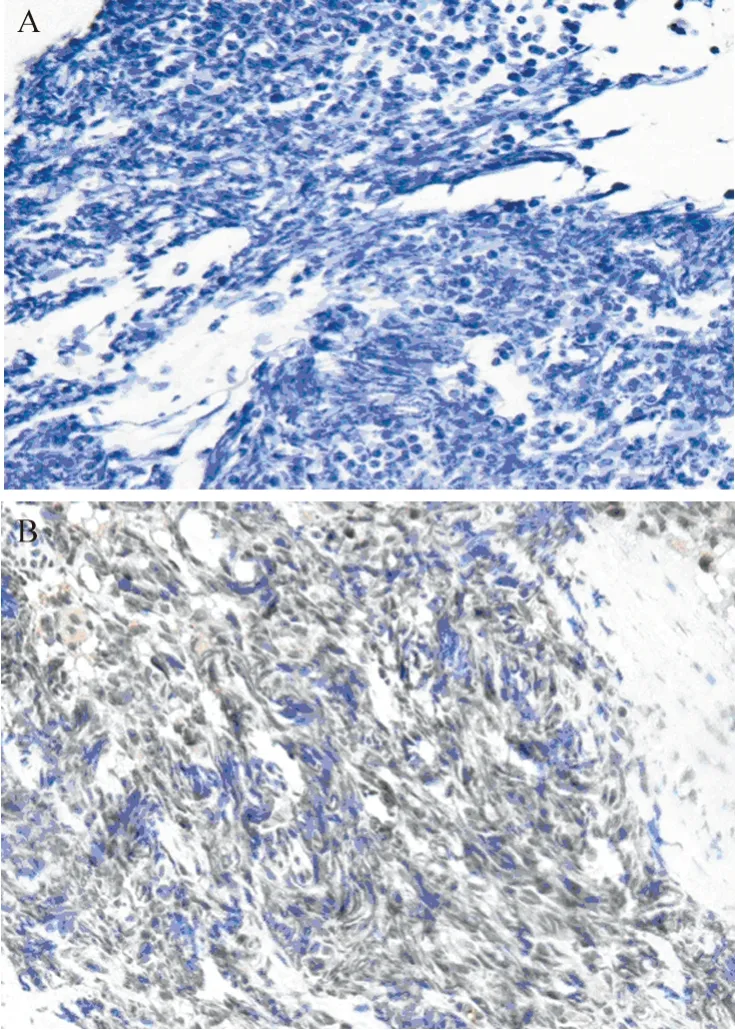
图1 DLL3在晚期SCLC组织中的表达 (×200)Figure 1 DLL3 expression in advanced SCLC tissues (×200)
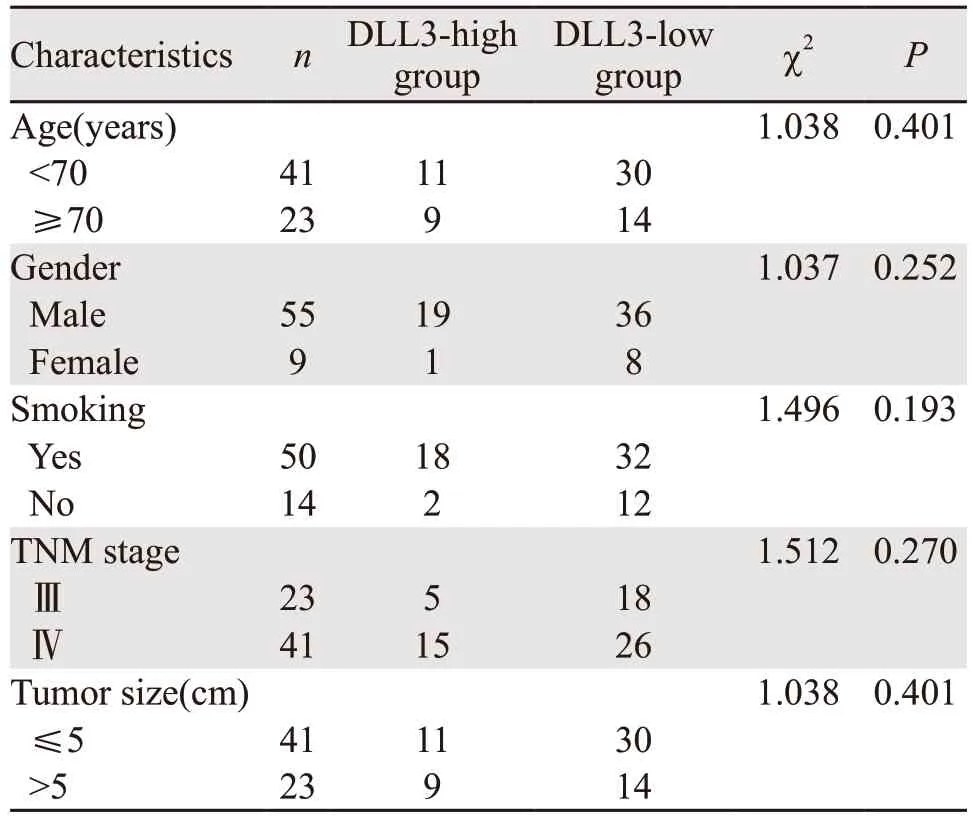
表1 DLL3在晚期SCLC中的表达与临床特征的关系 (n)Table 1 Relation between DLL3 expression and clinical parameters of advanced SCLC patients (n)
2.2 DLL3表达与化疗反应率及预后的关系
对患者化疗疗效分析显示,DLL3高表达组CR 0例,PR 6例(30.0%),SD 4例(20.0%)和PD 10例(50.0%),RR为30.0%,DCR为50.0%。DLL3低表达组中,CR 1例(2.3%),PR 29例(65.9%),SD 7例(15.9%)和PD 7例(15.9%),RR为68.2%,DCR为84.1%。DLL3低表达组化疗有效率及疾病控制率均高于高表达组,差异有统计学意义(χ2=8.145,P=0.006;χ2=8.192,P=0.007)。DLL3高表达组患者的PFS为4.9月,DLL3低表达组为7.0月,差异有统计学意义(P=0.025),见图2A;DLL3高表达患者中位OS为13.0月,DLL3低表达患者中位OS为16.6月,差异无统计学意义(P=0.071),见图2B。单因素生存分析结果显示,DLL3表达、肿瘤分期及肿瘤直径是影响PFS的重要因素,肿瘤分期是影响OS的重要因素,见表2、3。Cox多因素分析结果显示,DLL3低表达、肿瘤分期早、肿瘤直径<5 cm是晚期SCLC患者PFS的独立预后因素,肿瘤分期是OS的独立预后因素。
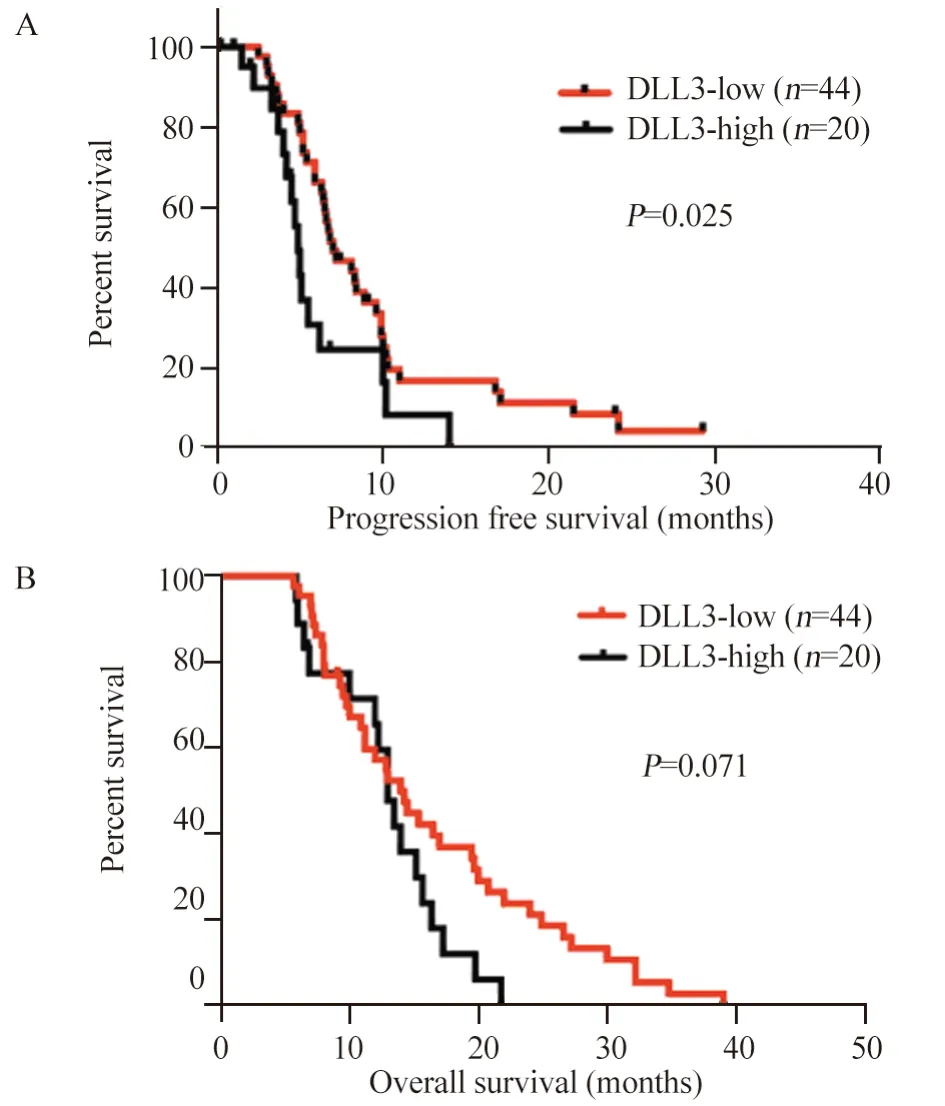
图2 DLL3的表达与晚期SCLC患者无进展生存期(A)及总生存期(B)的关系Figure 2 Relation between DLL3 expression and PFS(A),OS(B) of advanced SCLC patients

表2 单因素分析晚期SCLC患者临床特征与无进展生存期及总生存期的关系Table 2 Univariate analysis of relation between clinical characteristics and PFS,OS of patients with advanced SCLC
3 讨论
肺癌是全球癌症相关死亡的主要原因,全球发病率居恶性肿瘤的首位,每年肺癌相关死亡人数超过100万,严重威胁人类的生命健康[2]。其中小细胞肺癌恶性程度在所有类型肺癌中最高[1],多数患者在初诊时即有远处转移,一般不适合手术治疗,SCLC对化疗及放疗敏感,但很快会出现耐药而导致病情进展。SCLC一线治疗主要依赖于含铂化疗,例如卡铂/顺铂联合依托泊苷或伊立替康[1]。虽然SCLC对一线治疗的反应率很高(50%~70%),但仍有部分患者化疗疗效差,鉴于化疗存在骨髓抑制、肝肾功能损伤等可影响患者生活质量的不良反应,因此寻找可能预测化疗疗效的相关标志物有助于帮助临床医生评估化疗的必要性,为患者制定个体化治疗方案。
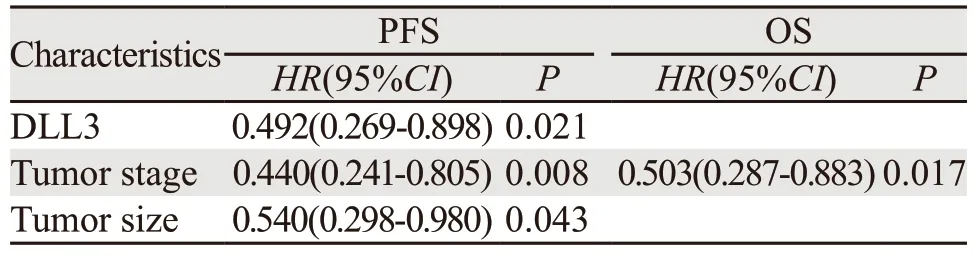
表3 Cox回归多因素分析晚期SCLC患者临床特征与无进展生存期及总生存期的关系Table 3 Multivariate Cox prognosis analysis of relation between clinical characteristics and PFS,OS of patients with advanced SCLC
DLL3作为Notch信号通路的抑制性配体,已在部分肿瘤中证实具有促进肿瘤增殖的作用。过表达DLL3能够促进人胃癌及肺腺癌细胞增殖,抑制其凋亡[7-8]。下调DLL3表达后肿瘤细胞生长受到显著抑制[9]。SCLC中DLL3可能在神经内分泌细胞形成中发挥重要作用[10-11]。多项研究证实DLL3在SCLC肿瘤组织中高表达,而在正常肺组织中不表达[6-7,12]。在本试验中,我们采用免疫组织化学的方式检测了DLL3在晚期SCLC组织中的表达情况,结果发现在84.1%的晚期SCLC肿瘤组织中可检测到DLL3的表达,定位于细胞膜,且表达水平与患者的性别、年龄、吸烟史、肿瘤分期、肿瘤大小均无相关性,与以往文献结果一致[6]。结果表明DLL3表达情况可能影响SCLC对EP方案化疗的敏感度。另外DLL3在晚期SCLC肿瘤组织中的表达水平与患者的PFS相关,DLL3高表达组患者的PFS较低表达组缩短。这也间接证实DLL3能够影响SCLC患者对化疗的敏感度,可能的机制是DLL3参与化疗耐药的形成。首先DLL3在SCLC肿瘤起始细胞(tumor initiating cells,TICs)中表达,而TICs与肿瘤耐药能力具有密切关系[13]。Saunders等[5]进行全转录组测序以鉴定活检或手术切除SCLC和LCNEC肿瘤细胞中差异表达的基因,结果发现在所有患者TICs中可检测到DLL3基因的表达,而抗DLL3靶向抗体-药物偶联物Rovalpituzumab teserine(Rova-T; SC16LD6.5)能够根除SCLC和大细胞神经内分泌瘤中的TICs[5],提示DLL3可能在维持TICs生物学功能中发挥重要作用。其次,DLL3调控上皮细胞向间质细胞的转化(epithelial to mesenchymal transition,EMT)进程[14],EMT与肿瘤化疗耐药关系密切,发生EMT的肿瘤细胞可获得凋亡抵抗,逃逸顺铂的细胞毒作用,产生对顺铂耐药[15-17]。再者,DLL3能够激活P13K/Akt信号转导通路[18],这是目前证实与肿瘤细胞化疗抵抗相关的一条通路[19]。但目前尚无关于DLL3与化疗耐药直接关系的报道,需要更多的研究来验证两者的关系。对于DLL3与肿瘤预后的关系,文献报道在NSCLC、小细胞膀胱癌及子宫内膜癌中,DLL3高表达患者相对于低表达者预后差,即DLL3高表达提示不良预后[20-21]。本试验发现DLL3影响晚期SCLC患者的PFS,但对OS无显著影响,可能的原因是:(1)我们检测DLL3表达时采用的是免疫组织化学的方法,此方法为半定量分析方法,且受实验者技术水平的影响,结果判断方面也具有一定的主观性。(2)SCLC患者的预后受多种因素的影响,且存在个体差异性,部分患者可能为非肿瘤性死亡,影响了最终结果的判断。(3)本研究为回顾性研究,随访过程中部分患者失访,部分患者截至随访日期时仍存活,总体失访率达到10.9%。因此,需要更多的前瞻性、多中心、大样本的临床试验进一步验证本试验结果。另外单一标志物用于疗效及预后预测具有一定的局限性,而在某些研究中提到甲状腺转录因子1(TTF-1)单一指标不能用来预测SCLC预后,但DLL3与TTF-1联合却是SCLC的独立预后指标(P=0.001),能很好预测SCLC的预后[22-23],后期可研究多个标志物联合的预测价值。有研究报道,血清胃泌素释放肽前体(ProGRP)在对于SCLC具有较高的疗效评价价值,而神经元特异性烯醇化酶(NSE)能够较好的判断预后[24-25],未来可将这些标志物联合DLL3应用于疗效评价及预后评估,做到优势互补,为临床医生制定个体化治疗方案及更好评估病情提供帮助。
综上,DLL3表达与晚期SCLC患者化疗反应率和PFS呈负相关,DLL3可能是预测SCLC化疗敏感度及预后的生物学标志物,进一步研究其与化疗耐药的相关性可能为SCLC的治疗提供新的思路。DLL3高表达与低表达患者OS差异无统计学意义,提示DLL3表达对于晚期SCLC患者的长远预后无预测价值。
