pVITRO2-VSVM-MBD2抑制肺癌细胞增殖并诱导其凋亡的实验
2020-12-07刘锐坚彩明孙兴王莹杜娟米志宽赵菊梅
刘锐,坚彩明,孙兴,王莹,杜娟,米志宽,赵菊梅
0 引言
2018年有209万新发肺癌病例和176万人死于肺癌[1]。在我国,全性别癌症死亡第一位的就是肺癌[2]。目前对于肺癌的治疗有多种方法,安全性和患者生存质量均有所提升,但总体生存率仍处于较低水平。有研究表明,3098例Ⅳ期NSCLC患者手术切除治疗后的5年生存率是21.1%[3]。免疫治疗可将晚期NSCLC患者5年生存率提升数倍[4],所以认为免疫治疗可为患者带来更多获益。提高患者机体抗肿瘤免疫水平,改善治疗效果,是目前较为关注的一种治疗方法。β防御素-2(beta defensin-2,MBD2)可诱导树突状细胞,使其从幼稚转化为成熟[5],增强机体的抗肿瘤免疫功能。水泡口炎病毒(vesicular stomatitis virus,VSV)基质蛋白(matrix protein,MP)在病毒引起的细胞凋亡中起着主导作用[6],研究表明,VSVM诱导细胞发生凋亡的机制是抑制宿主基因的表达[7],且其在线粒体凋亡途径中也发挥着作用[8]。本实验通过构建MBD2和VSVM的共表达质粒,转染至肺癌LL/2细胞中,探讨MBD2联合VSVM对肺癌细胞增殖的影响及其体外DC细胞趋化活性,为肺癌免疫治疗提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞株与质粒 肺癌LL/2细胞购自中国科学院上海细胞库,延安大学医学院医学肿瘤防治重点实验室保存。质粒pVITRO2-VSVM、pVITRO2-MBD2及pVITRO2-VSVM-MBD2由本实验室构建并保存。
1.1.2 主要试剂、试剂盒 Lipofectamine2000转染试剂盒购自美国Thermo Scientific公司;胰蛋白酶、DMEM培养基和胎牛血清(FBS)购自美国Gibco公司;Triton X-100、牛血清白蛋白和羊抗兔IgG购自美国Sigma公司;β防御素-2(兔来源)、GAPDH(兔来源)购自英国Abcam公司;青霉素和链霉素购自北京悦康凯悦制药有限公司;质粒小提试剂盒购自中国天根生化科技有限公司;四甲基偶氮唑蓝(MTT)、SDS-PAGE凝胶配制试剂盒、超敏ECL化学发光试剂盒和AnnexinV-PE/7-ADD双染细胞凋亡检测试剂盒购自中国碧云天生物科技有限公司。
1.1.3 主要仪器 CKX41倒置显微镜购自日本OLYMPUS公司;-80℃低温冰箱购自日本Panasonic公司;蛋白电泳设备、恒压、恒流电泳仪和冷冻离心机购自美国Bio-Rad公司;流式细胞仪购自美国BD公司。
1.2 实验方法
1.2.1 培养细胞 复苏肺癌LL/2细胞,用含10%胎牛血清的DMEM培养基、37℃、5%CO2及湿度饱和的二氧化碳培养箱中培养。定时倒置显微镜下观察细胞生长情况,待细胞生长状态良好,对数生长期时进行传代培养,进行后续实验。
1.2.2 质粒转染 收集生长状态良好的LL/2细胞,接种于96孔或6孔培养板,待对数生长期时采用脂质体(Lipofectamine2000)转染细胞。参照说明书制备质粒脂质体复合物,吹打混匀,孵育20 min。待LL/2细胞密度为70%~80%时,弃去完全培养基,PBS漂洗2次,加入上述转染复合物37℃培养箱中孵育4~6 h后换用新鲜完全培养基,分别转入pVSVM、pMBD2、pVSVM+pMBD2、pVSVM-MBD2,另设脂质体转染组和空白对照组。绿色荧光蛋白质粒(pVITRO2-GFP)作为参照,观察绿色荧光的表达情况以判断质粒转染效率,继续培养24~48 h进行后续实验。
1.2.3 RT-PCR检测目的基因MBD2及VSVM的表达 实验所用VSVM、MBD2cDNA 序列信息由NCBI网站(https://www.ncbi.nlm.nih.gov/nuccore/?term=)搜索获得,VSVM和MBD2的RT-PCR引物用Primer Premier 5.0软件设计,经UCSC Genome Browser模拟检测及RTPCR预检测正确后使用。引物序列为VSVM-F:5'-CGATTGAGCTCACAATGACC-3';VSVM-R:5'-ATCAGGCCAAACATTAAGGC-3';MBD2-F:5'-CACCAATGGAGGGTACTGTG-3';MBD2-R:5’-GGGTTCTTCTCTGGGAAACA-3’。RT-PCR按照TaKaRa公司的RT-PCR检测试剂说明书提取LL/2细胞总RNA。RT-PCR进行定量分析,据检测结果,以β-actin为内参基因(β-actin-F:5'-CCCAGGCATTGCTGACAGG-3';β-actin-R:5'-TGGAAGGTGGACAGTGAGGC-3'),采用2-ΔΔCt=[(Ct目的基因-Ct质控)sample A-(Ct目的基因-Ct质控)sample B)]分析各基因的相对表达量变化。
1.2.4 Western blot检测转染细胞中MBD2蛋白水平的表达 收集转染后培养48 h的LL/2细胞,PBS洗涤,RIPA裂解液裂解细胞,BCA分析测定蛋白质浓度。用12%SDS-聚丙烯酰胺凝胶电泳分离每个蛋白质样品20~40 µg,转移至PVDF膜,5%脱脂奶粉稀释一抗,将膜放入4℃冰箱孵育过夜,同样方法稀释二抗室温孵育2 h,在暗室中进行ECL检测,观察条带情况。
1.2.5 MTT法检测各质粒转染组对肺癌LL/2细胞生长的抑制作用 倒置显微镜观察LL/2细胞,将对数生长期细胞用PBS洗涤,加入1 ml的胰酶消化液至细胞变圆,加入2 ml的DMEM培养基至瓶底细胞全部脱落终止,制成单细胞悬液,计数后调整细胞浓度为1×105个/毫升,按每孔200 μl接种于96孔细胞培养板,放入培养箱待细胞生长至70%~90%时,按照上述脂质体转染法转染细胞,每组设置6个复孔,转染细胞后放置在37℃、5%CO2的培养箱中继续培养36、48、60和72 h时,取出培养板,每孔加入10 μl配置的5 mg/ml MTT溶液,放置在37℃、5%CO2的培养箱中继续培养,4 h后取出培养板,吸取上清液,加入DMSO 150 μl振荡混匀,使用酶标仪检测490 nm吸光度值,重复三次取平均值,计算不同质粒转染后,LL/2细胞的生长抑制率。
1.2.6 各质粒转染组对肺癌细胞LL/2凋亡的细胞形态学观察 当LL/2细胞生长状态良好、处于对数期时处理细胞,制成单细胞悬液,浓度为1×105个/毫升,每孔2 ml接种于六孔板,采用上述方法培养并转染细胞,分别于转染后36、48、72 h取出培养板,PBS洗涤,PI染液至覆盖盖玻片,荧光显微镜下观察各组细胞形态的变化,每个时间点分别重复三次。
1.2.7 各质粒转染组对细胞凋亡率的影响 细胞培养与转染方法同1.2.6,转染细胞培养48 h取出,严格按照说明书操作制成浓度为1×106个/毫升单细胞悬液,吸取100 μl的重悬液到流式管中,加入5 μl Annexin V-PE混匀后避光孵育5 min,加入10 µl 20 µg/ml的7-AAD(核酸染料),并加入400 µl PBS,立即行流式细胞术检测,实验重复3次。
1.2.8 MBD2趋化活性检测 各组质粒转染细胞后,继续培养48 h收集上清液,调整DC浓度为5×106个/毫升。加入DC细胞悬液于transwell小室上层,质粒转染细胞,收集上清液置于下层,孵育16 h。吸弃上层液体,多聚甲醛固定,结晶紫染色,显微镜计数,实验重复3次。
1.3 统计学方法
采用SPSS19.0软件分析数据。多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 质粒转染LL/2细胞效率
结果显示,转染后24 h开始表达绿色荧光蛋白,48 h达到较高表达,荧光显微镜下计数发现绿色荧光蛋白的表达量可达80%,提示我们转染方法及质粒载体具有较高的转染效率,细胞转染效率达 80%以上,见图1。
2.2 RT-PCR检测各质粒转染组目的基因表达

图1 pGFP转染LL/2细胞48h后GFP表达量Figure 1 GFP expression in LL/2 cells after pGFP transfection for 48h
与空白对照组相比,pVSVM、pVSVM+pMBD2质粒共转染及pVSVM-MBD2转染组中,均可检测到VSVM基因的表达;pMBD2、pVSVM+pMBD2及pVSVM-MBD2转染组,均可检测到MBD2基因的表达,表明各重组质粒在LL/2细胞中均能表达目的基因,见图2。

图2 LL/2细胞中目的基因mRNA相对表达量Figure 2 Relative expression of target gene mRNA in LL/2 cells
2.3 Western blot检测细胞重组质粒转染后LL/2细胞MBD2蛋白水平的表达
在空白对照组、pVITRO2-GFP转染细胞及pVSVM转染组均未检测到MBD2表达;而转染pMBD2及pVSVM-MBD2质粒组总蛋白中检测到MBD2的表达,表明重组质粒可在肺癌LL/2细胞中表达目的蛋白,见图3。
2.4 MTT实验分析重组质粒对LL/2细胞生长的抑制作用
pVSVM、pVSVM+pMBD2共转染和pVSVMMBD2双表达质粒转染的LL/2细胞,有明显生长抑制作用,且pVSVM-MBD2转染组细胞抑制更明显,与单纯脂质体转染组相比差异有统计学意义(F36=475.6,P36<0.001;F48=541.0,P48<0.001;F60=1191.0,P60<0.001;F72=613.4,P72<0.001),而pMBD2转染组细胞抑制作用不明显,见图4。
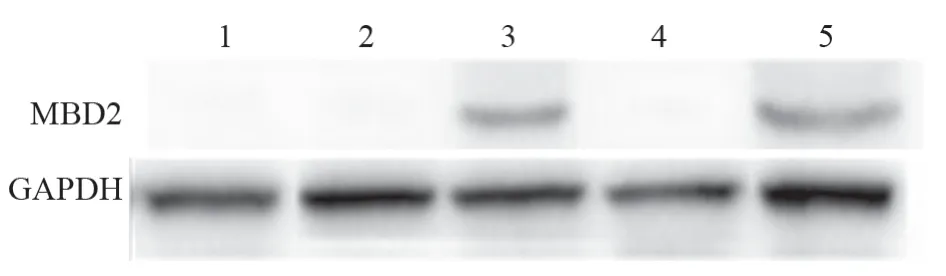
图3 Western blot检测MBD2在各处理组LL/2细胞中的表达Figure 3 MBD2 expression in LL/2 cells of each treatment group detected by Western blot
2.5 PI荧光染色法观察细胞形态变化
空白对照组、脂质体转染组的LL/2细胞生长良好、胞质丰富、细胞核明显、细胞密度较高,生长速度快于其他转染组;而pVSVM、pVSVM+pMBD2共转染及pVSVM-MBD2转染组细胞形态变化明显,细胞密度较小,出现体积变小、变圆、核固缩等凋亡的形态学表现,与之相比,空白对照组、脂质体转染组和pMBD2转染组的细胞形态变化不明显,见图5。
2.6 Annexin V-PE/7-AAD双染法检测细胞凋亡率
空白对照组凋亡率为(4.82±0.21)%,脂质体转染组凋亡率为(7.85±1.35)%,pMBD2转染组凋亡率为(21.6±2.03)%,pVSVM转染组凋亡率为(30.81±2.26)%;pMBD2+pVSVM转染组凋亡率为(31.80±3.02)%;pVSVM-MBD2转染组凋亡率为(56.30±4.31)%。各组间细胞凋亡率差异有统计学意义(F=164.3,P<0.001),进一步进行各转染组与空白对照组比较,细胞凋亡率差异有统计学意义(t脂质体=3.841,P脂质体=0.0184;tpMBD2=14.24,tpVSVM=19.83,tpMBD2+pVSVM=15.44,tpMBD2-pVSVM=20.66,均P<0.05),见图6。
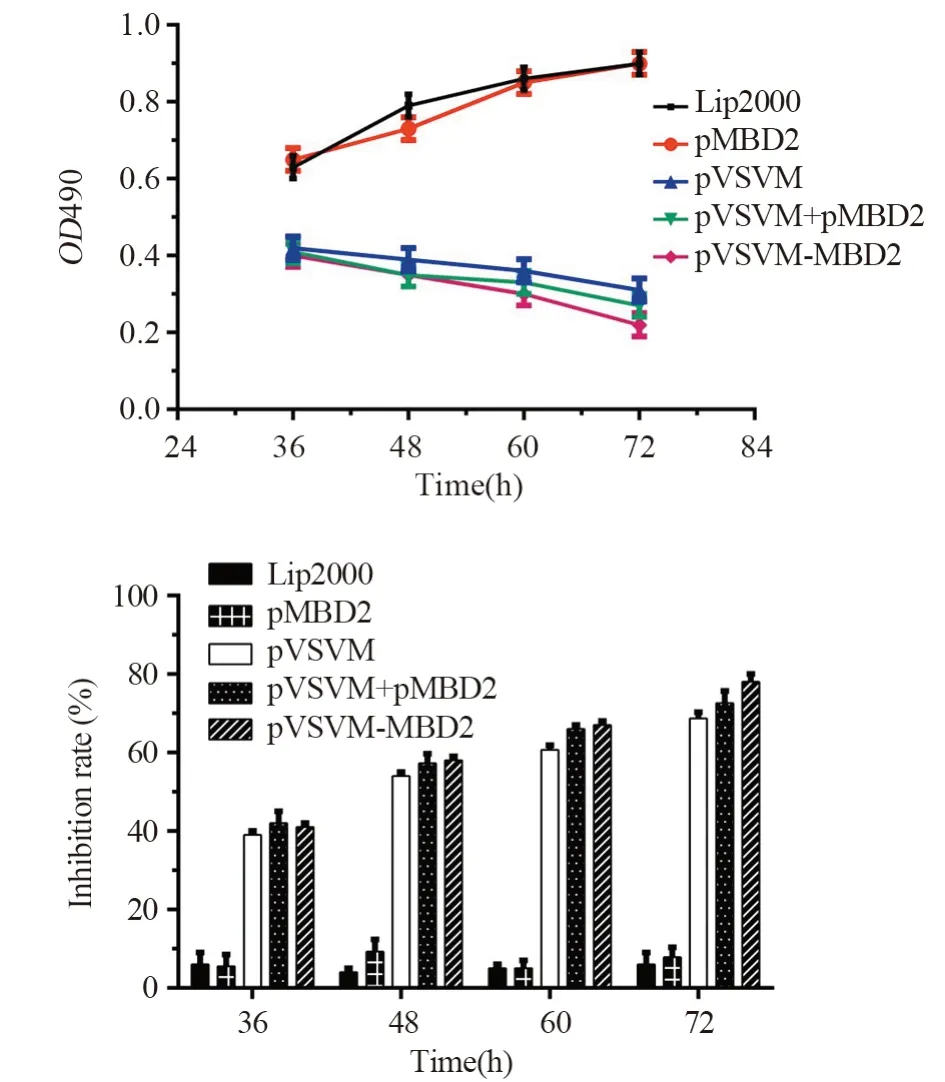
图4 重组质粒对LL/2细胞增殖的影响Figure 4 Effect of recombinant plasmids on proliferation of LL/2 cells
2.7 MBD2趋化活性检测
各组质粒转染细胞后趋化活性差异有统计学意义(F=212.7,P<0.001)。进一步比较Lip2000与pMBD2、pVSVM-MBD2质粒间的趋化能力,差异有统计学意义(tpMBD2=18.07,tpVSVM-MBD2=17.24,P<0.001);比较pVSVM与pMBD2、pVSVMMBD2质粒之间的趋化能力,差异有统计学意义(tpMBD2=17.97,t pVSVM-MBD2=17.13,P<0.001);比较pMBD2和pVSVM-MBD2质粒之间的趋化能力,差异有统计学意义(t=3.413,P=0.027,P<0.05),见图7。
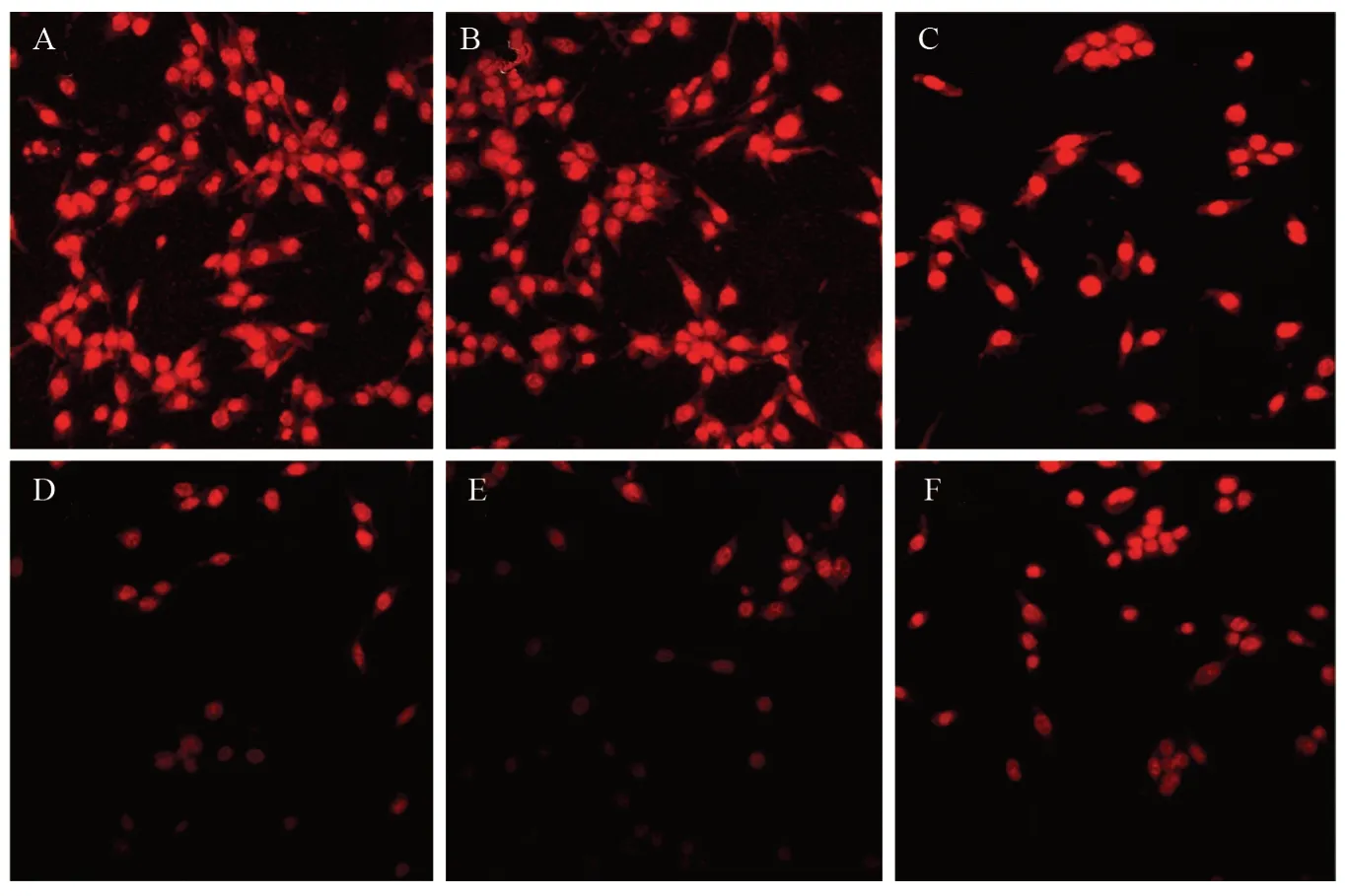
图5 LL/2细胞转染后PI染色检测细胞核形态Figure 5 Nuclear morphology of LL/2 cells after transfection detected by PI staining
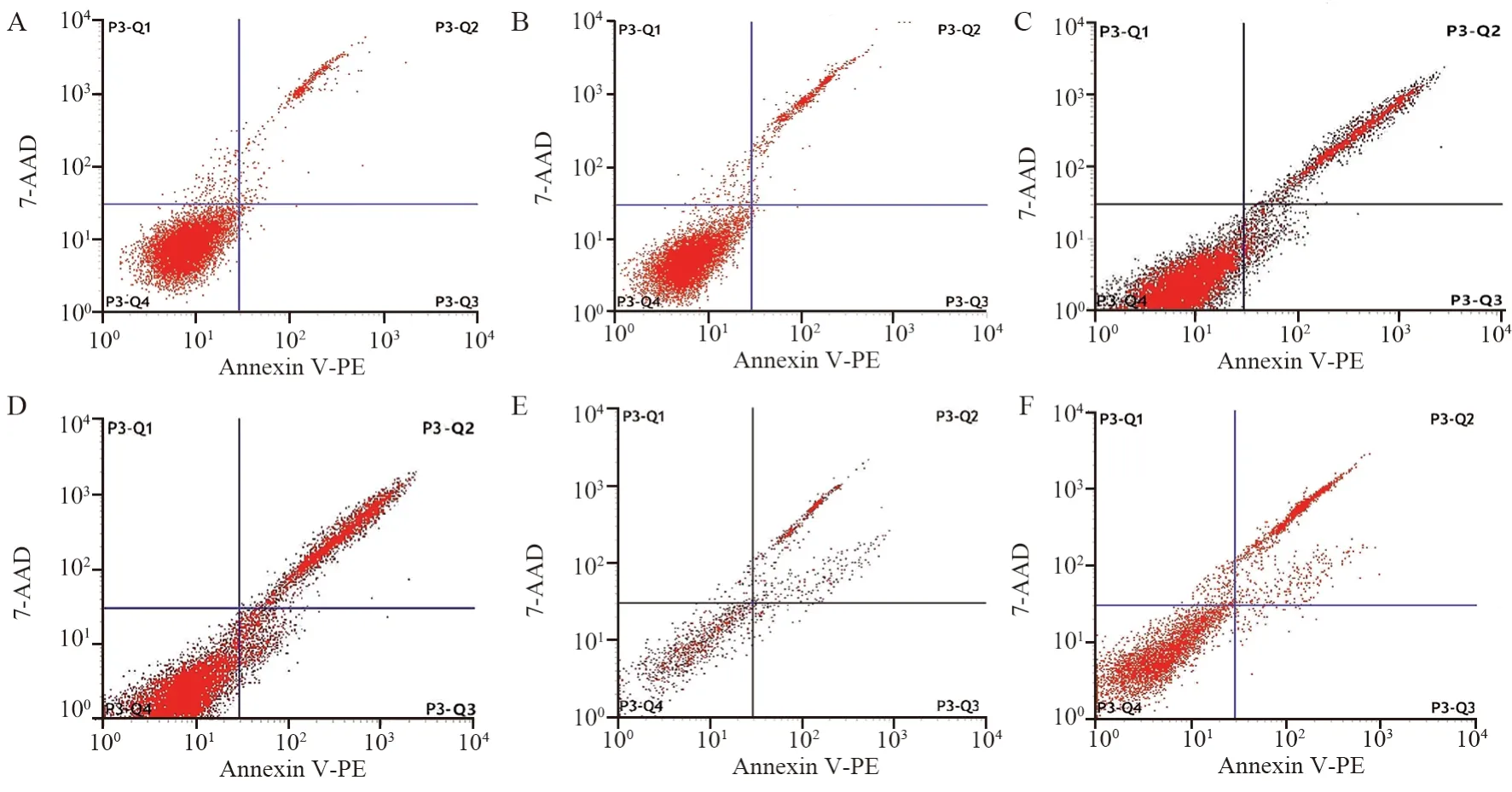
图6 流式细胞仪检测细胞凋亡Figure 6 Cell apoptosis detected by flow cytometry

图7 质粒转染LL/2细胞后对DC的趋化作用Figure 7 Chemotaxis of DC after plasmid transfection of LL/2 cells
3 讨论
目前肿瘤的免疫治疗备受关注,正在成为研究热点。在恶性肿瘤的治疗中,肿瘤免疫治疗已经取得了重大突破[9-11]。机制为通过激发机体免疫功能,提高机体的抗肿瘤作用,达到杀伤肿瘤细胞的目的。本研究中,MBD2是天然免疫分子,参与机体的天然免疫应答。先前已被证明小鼠MBD2诱导骨髓源性iDC成熟的机制是作为内源性配体与Toll样受体4直接作用,β-防御素能与MIP-3a(小鼠巨噬细胞炎性反应蛋白)竞争,抑制它与抗体CCR6转染细胞的结合,趋化诱导幼稚DC细胞和记忆T细胞,促使免疫应答的发生,提示MBD2可能在机体的免疫监视中发挥作用,可将其用于肿瘤免疫治疗。细胞凋亡是一种自主有序的死亡,这一过程的紊乱往往会诱发许多疾病。有研究表明,抑制肿瘤细胞的增殖活性,促进肿瘤细胞的凋亡是肿瘤治疗的关键[12],提示我们可以通过调控肿瘤细胞的增殖与凋亡来进行抗癌治疗。本研究中,VSV是一种溶瘤病毒(OV),其基质蛋白是主要的致毒因素,VSVM可通过多种途径诱导肿瘤细胞凋亡[13]。
本研究结果显示,pVSVM、pVSVM+pMBD2双质粒与pVSVM-MBD2融合质粒转染组细胞形态变化明显,镜下观察到细胞体积变小、变圆及核固缩等凋亡的形态学表现。与转染pVSVM+MBD2质粒和pVSVM相比,转染pVSVM-pMBD2双质粒对肺癌细胞的抑制作用明显增强。本研究结果表明,VSVM和MBD2的联合作用诱导了肿瘤细胞的凋亡,对肿瘤细胞的生长产生抑制作用,且双表达质粒转染组比单独转染组的效果更显著。可能的原因是,防御素与水泡口炎病毒基质蛋白可同时在细胞中表达,增强其诱导肿瘤细胞的凋亡的作用,研究表明防御素具有诱导细胞凋亡的作用[14],两者联合增强了其作用效果。也可能是溶瘤病毒激活免疫信号,促进免疫组分与肿瘤细胞之间相互作用,进而导致肿瘤细胞死亡[15],具体机制尚待进一步研究。另外,DC趋化实验结果显示,VSVM与MBD2共表达质粒仍保留了MBD2趋化活性,即pMBD2具有良好的DC趋化作用。已有研究表明,β-防御素具有强大的趋化活性[16]。即MBD2可以招募未成熟的DC细胞和记忆T细胞CCR6,机制是与TLR4相互作用。也就是说,MBD2可以将未成熟的DC细胞招募至肿瘤所在位置,从而发挥其抗原呈递功能,增强免疫反应。对VSVM而言,因为OV可以促进部分细胞毒性T淋巴细胞反应增强,且效果与抗原激动性肿瘤疫苗相似,使其成为了免疫检查点阻断的联合治疗的理想伴侣[17],所以在我们的研究中选择MBD2和VSVM的联合作用对肿瘤细胞的影响,可能是MBD2诱导了幼稚DC和T细胞成熟,提高机体获得性免疫能力,同时VSVM也可激活细胞毒性T淋巴细胞,两者联合加强了抗肿瘤的免疫反应。
综上所述,MBD2和VSVM联合作用,使细胞形态发生明显改变,可以抑制肺癌细胞LL/2的增殖,诱导其凋亡,并保留了防御素的趋化功能,有望成为肺癌治疗的新策略。本研究探讨MBD2和VSVM共表达质粒对肺癌细胞的作用效果,但具体机制尚未明确,还需以此细胞实验为基础进一步深入研究。
