基于TGF-β1/p38MAPK/FN信号通路的放射性食管炎发病机制的研究
2020-12-07张福鹏赵晓燕郝淑兰樊桂玲李晓丽王爱荣刘丽坤
张福鹏 ,赵晓燕,郝淑兰,樊桂玲,李晓丽,王爱荣,刘丽坤
0 引言
放射性食管炎(radiation esophagitis,RE)是恶性胸部肿瘤(如食管癌、中央型肺癌等)在放射治疗中常见的局部不良反应,多数为急性,发生率为10%~20%,且与照射剂量密切相关[1-2]。目前其发病机制尚不明确,主要从应激反应及炎性细胞因子等方面进行阐述[1],肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)和白细胞介素-8(interleukin-8,IL-8)等不良反应相关细胞因子是研究的热点[3-5]。
然而,放射性食管炎是自限性并发症,黏膜修复是其恢复的重要环节[6],而纤维粘连蛋白(fibronectin,FN)主要存在于细胞外基质(extracellular matrix,ECM)中,作为黏膜修复主要的蛋白因子参与黏膜修复,在促进细胞黏附、迁移、增殖和分化等方面发挥着重要的作用,具有促进细胞再生与修复的生物学功能[7]。转化生长因子-β1(TGF-β1)是启动和终止细胞修复的重要因子,与FN共同调节着黏膜组织修复[8],并且黏膜修复与纤维化在组织恢复过程中同时发生,TGF-β1/促分裂素原活化蛋白激酶(p38MAPK)信号通路是肾脏纤维化、心肌纤维化过程中重要的信号通路[9-10],p38MAPK信号通路的激活可以促进FN的产生,从而促进黏膜快速修复。
本研究通过建立Sprague-Dawley(SD)大鼠放射性食管炎模型,探讨TGF-β1/p38MAPK/FN信号通路是否介导RE的发生。
1 材料和方法
1.1 实验用动物及造模
本研究所选实验动物为20只成年雌性SD大鼠,体质量220~250 g,购自中国医学科学院医学院动物研究所(许可证号:SCXK(京)2014-0004),于山西省中医药研究院实验动物中心喂养,大鼠生长环境为(23±1)℃、湿度75%。本研究经山西省中医药研究院医学伦理委员会审查。
根据文献[11]及预实验给予造模,采用单次照射,剂量为40 Gy,皮源距100 cm,照射范围为食管上端,剑突上3 cm。应用山西省中医院肿瘤科放疗中心的美国Varian(瓦里安)直线加速器6MV-X,剂量率为340 Mu/min。
1.2 试剂与材料
TIANScript RT Kit,SuperReal PreMix Plus(SYBR Green)购自天根生物科技有限公司,蛋白酶抑制剂购自美国Roche公司(04693116001);一抗:TGF-β1、p38MAPK、FN;二抗:山羊抗兔IgG(H+L)HRP Jackson 111-035-003、山羊抗鼠IgG(H+L)HRP Jackson 115-035-003均购自中国Abcam公司。
轮转切片机(RM2235,美国Leica公司),ABI 7500型荧光定量PCR仪(美国Applied Biosystems公司),多功能高速冷冻离心机(美国Beckman公司),化学发光凝胶成像系统(FluorChemHD2,美国Alpha公司)。
1.3 检测方法
1.3.1 分组及生理活动观察 实验共分5组:对照组(未行照射)、一周组(放射性食管炎SD大鼠模型第一周杀减组)、二周组(放射性食管炎SD大鼠模型第二周杀减组)、三周组(放射性食管炎SD大鼠模型第三周杀减组)和四周组(放射性食管炎SD大鼠模型第四周杀减组)。每日记录各组体质量、水和食物摄入量。
1.3.2 病理检测 按照分组情况进行杀减,将食管样本纵向解剖,用10%甲醛溶液固定并储存于-80℃冰箱中。经过脱水、透明、浸蜡、石蜡包埋后,HE染色切片,显微镜下观察各组食管组织的病理变化。
1.3.3 Real-time PCR法检测放射性食管炎SD大鼠模型食管TGF-β1、FN mRNA表达 用超纯RNA提取试剂(TaKaRa Code D9108B)提取组织样本中总RNA。采用2-ΔΔCt法进行数据相对定量分析。目的基因引物及探针,见表1。
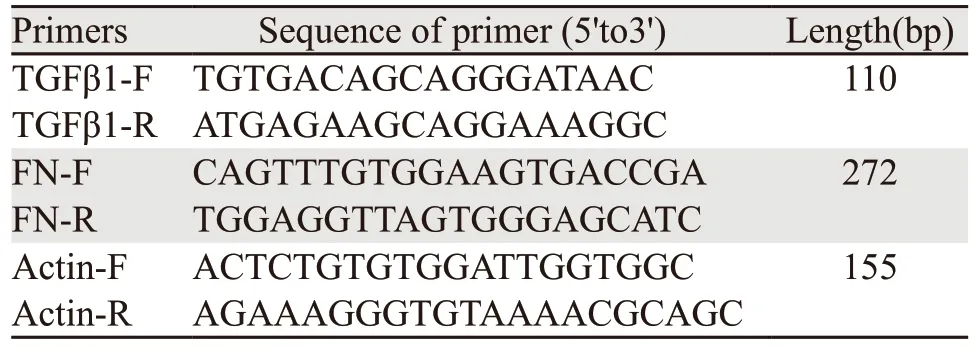
表1 目的基因引物及探针Table 1 Target gene primers and probes
1.3.4 蛋白免疫印迹(Western blot)法检测放射性食管炎SD模型TGF-β1、p38MAPK和FN蛋白表达 预冷RIPA蛋白抽提试剂,加入蛋白酶抑制剂提取蛋白。浓缩胶恒压90 V,约20 min;分离胶恒压120 V,通过预染蛋白Marker确定电泳停止时间。300 mA恒流;0.45 μm孔径PVDF膜,转膜时间90 min。转膜完成后丽春红染色试剂对膜进行染色,观察转膜效果。将膜完全浸没于5%BSATBST中,水平摇床孵育1 h(RT)封闭。
加入一抗,5%BSA-TBST稀释一抗(稀释比例1:1000),4℃水平摇床孵育过夜。加入二抗,5%BSA-TBST稀释二抗,山羊抗兔及山羊抗鼠IgG(H+L)HRP 1:10000,室温孵育40 min。膜蛋白面滴加ECL,反应3 min;胶片曝光10 s~5 min(曝光时间随光强度不同而调整),显影2 min,定影。
1.4 统计学方法
采用SPSS20.0软件包进行数据处理。单因素方差分析比较各组数据,当方差齐时使用Student-Newman-Keuls检验,当方差不齐时使用Kruskal-Wallis H检验。结果用平均值±标准差()表示。P<0.05为差异有统计学意义。
2 结果
2.1 放射性食管炎SD大鼠模型进食量、进水量及体质量的变化
放射治疗后一周造模组进水量、进食量及体质量较对照组明显下降(P=0.000),大鼠烦躁明显,颈部开始脱毛。从第三周起,大鼠进水量、进食量及体质量逐渐恢复,见图1。
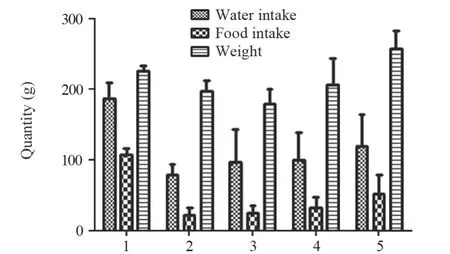
图1 SD大鼠进水、进食量及体质量的动态变化Figure 1 Dynamic changes of water intake,food intake and body weight of SD rats
2.2 放射性食管炎SD大鼠模型食管病理的动态变化
第一、二周组食管黏膜上皮中重度破坏,鳞状上皮层、棘细胞层、基底细胞层坏死脱落,第二周组肌层炎性细胞明显浸润,第三周组黏膜上皮开始恢复,第四周组黏膜上皮基本恢复到正常,见图2。
2.3 放射性食管炎SD大鼠模型食管组织FN、TGF-β1基因的表达
Real-time PCR法检测结果显示,与对照组比较,FN mRNA表达水平放射后迅速下降,第二、三、四周逐渐上升,至第四周基本恢复至正常水平,而TGF-β1 mRNA表达水平在放射损伤后上升,随着放射时间的推移,其表达逐渐下降至正常水平,见表2。
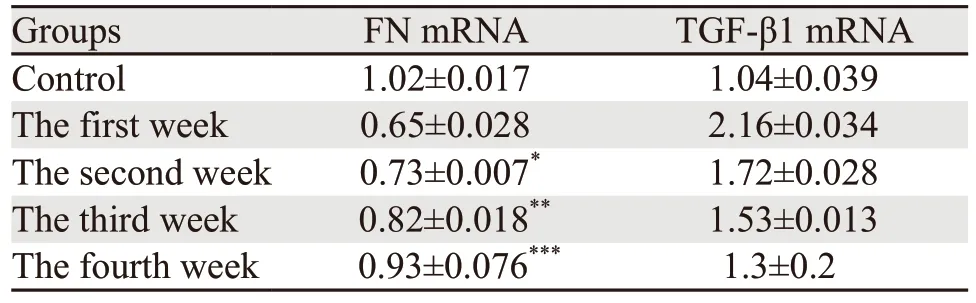
表2 放射性食管炎SD大鼠模型食管组织FN、TGF-β1 mRNA的表达Table 2 Expression of FN and TGF-β1 mRNA in esophagus tissue of SD rat model of radiation esophagitis
食管组织中FN、P38和TGF-β1蛋白的表达,见图3。第一周FN蛋白表达较对照组明显下降(P=0.000),而第三周期逐渐恢复,第四周已与对照组无显著差异(P=0.100);TGF-β1蛋白表达第一周较对照组升高(P=0.000002),从第二周开始降低,第四周与对照组无明显差异(P=0.136),而P38蛋白表达亦从第一周开始上升(P=0.000),随着时间的推移逐渐下降。
3 讨论
既往临床研究及动物实验揭示在诸多纤维化的疾病模型中都出现TGF-β1、p38MAPK高表达[12-13],尤其在γ线照射后TGF-β1升高,激活p38MAPK信号通路[14],p38MAPK的激活可以促进因子TGF-β1的产生和激活,同时由于TGF-β1的异常升高可以增加p38MAPK的磷酸化水平并进一步激活p38MAPK信号转导途径[15]。例如在肾纤维化过程中,p38MAPK通路的激活诱导细胞外基质ECM(extracellular matrix,ECM)大量合成,p38MAPK通路是细胞将信号从细胞膜传递到核的主要通路。在肾纤维化形成过程中,磷酸化的p38MAPK(p-p38MAPK)可结合FN启动子,促进FN转录,诱导胶原合成增加及肾小球基底膜增厚、ECM积聚[16],从而使FN产生增加[17],同时p38MAPK又可通过与TGF-β1相互调节以及基质金属蛋白酶活性及葡萄糖转运体的表达等多种途径影响FN的生成,提示TGF-β1、p38MAPK广泛参与生成ECM的生理和病理过程中。TGF-β1激活p38MAPK的一般过程:TGF-β1先以高亲和力与TGF-β1配体结合,再与TAB1结合形成异二聚体,TAK1将TGF-β1二聚体近膜区的丝氨酸和甘氨酸残基GS功能域磷酸化,从而激活信号转导。活化的受体激活MAPK,启动p38MAPK信号通路[18]。
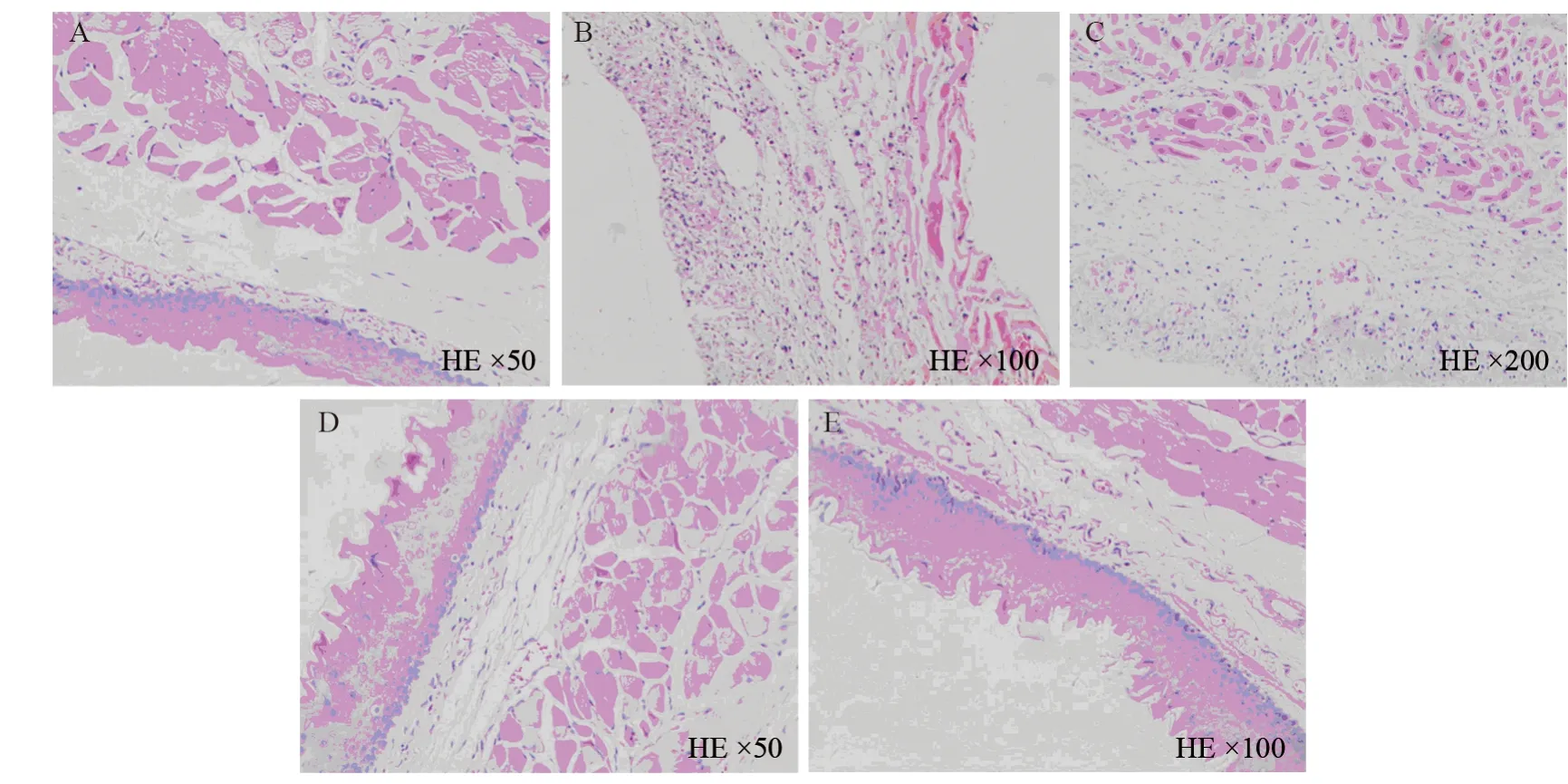
图2 放射性食管炎SD模型食管病理的动态变化Figure 2 Dynamic pathological changes of esophagus in SD model of radiation esophagitis
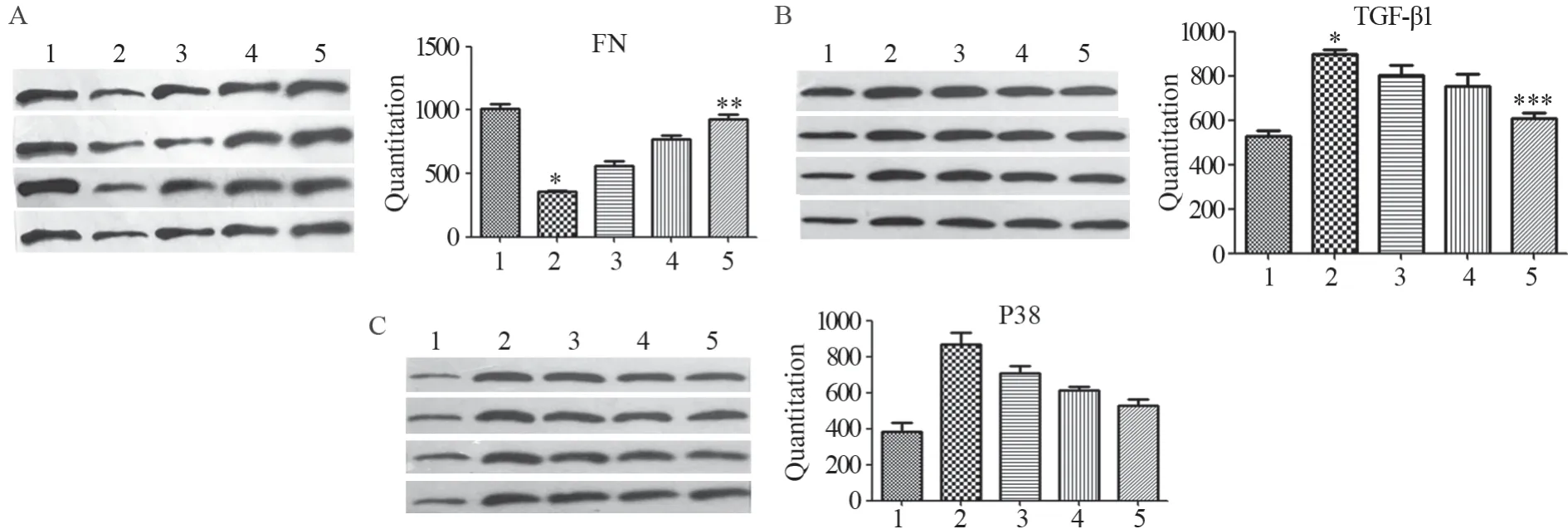
图3 放射性食管炎SD大鼠模型食管组织FN(A)、TGF-β1(B)和P38(C)蛋白表达Figure 3 Expression of FN(A),TGF-β1(B) and P38(C) protein in esophagus tissue of SD rat model of radiation esophagitis
食管壁分为四层:黏膜层、黏膜下层、肌层和外层(纤维层)。黏膜表层由鳞状上皮组成[19],本研究通过观察组织病理变化发现,放射性食管炎发生后,第一周黏膜上皮轻度坏死脱落,基底层轻微破坏,第二周、第三周黏膜上皮重度破坏,甚至全层脱落,炎性细胞浸润肌层,基底层脱落,第四周黏膜层逐渐新生、恢复。由此可见,放射性食管炎是自限性,但需要三至四周时间,且往往在过程中因合并出血、穿孔等症状中断治疗。
综上所述,放射性食管炎发生后,TGF-β1上升,激活p38MAPK通路,诱导食管ECM合成,FN产生增加,从而促进了食管黏膜的恢复。TGF-β1/p38MAPK/FN通路可能从黏膜修复角度解释了放射性食管炎的发病机制。
