人牙髓干细胞向成牙本质细胞分化中circRNAs差异表达的研究
2020-12-07肖婷婷林诗晗柯志红邱在玲曾建钗胡雪刚林雪梅邹璐宁吕红兵
肖婷婷 林诗晗 柯志红 邱在玲 曾建钗 胡雪刚 林雪梅 邹璐宁 吕红兵
人牙髓干细胞(dental pulp stem cells,DPSCs)的主要功能是分化为成牙本质细胞,并通过与上皮干细胞的相互作用参与牙釉质的形成[1-2],因此DPSCs在牙釉质、牙本质和牙髓组织再生中具有重要作用。
环状RNA(circRNA)是一种含有环状结构[3]的内源性非编码RNA。1976年,首次在病毒中发现circRNAs,与线性RNA相比,该环状结构更稳定,对RNase R的抵抗性更强[4]。有研究发现,在哺乳动物内发现了大量的circRNAs,因其为环状,不易被降解,故circRNAs可作为疾病诊断的生物标志物[5]。
研究表明,circRNAs参与成骨分化的过程。Qian等[6]研究发现,circ19142和circ5846在小鼠MC3T3-E1成骨细胞成骨分化中具有重要作用。此外,Zheng等[7]发现,差异性的circRNAs在牙周膜干细胞(periodontal ligament stem cells,PDLSCs)成骨分化和生物矿化过程中具有重要作用。而DPSCs作为牙髓再生重要的种子细胞,其成牙本质分化是否受到circRNAs的调控,目前尚未见报道。本研究旨在阐明circRNAs在DPSCs成牙本质分化中的作用,为进一步探索circRNAs在DPSCs成牙本质分化中的调控机制提供参考。
1 材料与方法
1.1 主要试剂和仪器
胎牛血清(FBS,Hyclone,USA);10 mmol/L β-甘油磷酸钠、50 μg/ml维生素C、10 mol/L地塞米松、Ⅰ型胶原酶、dispase Ⅱ酶(Sigma,USA);鼠抗人STRO-1单克隆抗体(R&D systems,USA);ALP检测试剂盒、茜素红(上海碧云天生物技术研究所);芯片(Arraystar,USA)。
1.2 牙髓细胞的培养
选取临床17~23 岁健康的第三磨牙或因正畸需要拔除的牙,在超净台里取出牙髓,CD酶(3 mg/ml I型胶原酶,4 mg/ml dispase Ⅱ酶)消化、终止、离心、重悬后过细胞筛,得到单细胞悬液。加入含10% FBS的α-MEM培养液,于37 ℃、5%CO2培养箱中培养,24 h后换液,10 d后更换半液,14 d后更换全液,标记为原代。细胞生长的密度至80%~85%时,用胰酶消化传代,标为第1代,取第2~3代细胞进行实验。
1.3 免疫磁珠分选DPSCs
取1×107对数生长期的牙髓细胞,用鼠抗人STRO-1单克隆抗体50 μg /107cells 标记;每107个细胞加入80 μl buffer、20 μl免疫磁珠,混匀后于4 ℃冰箱避光孵育15 min;阳性细胞留在磁柱里;取下LS柱,加入5 ml buffer快速推下,收集到的细胞即为DPSCs。采用CCK-8法检测细胞增殖情况,酶标仪检测A值(450 nm),取均值描绘生长曲线,实验重复3 次。
1.4 DPSCs的矿化能力鉴定
当第2代的DPSCs密度达80%~85%时,以每孔2×103个细胞接种于6 孔板。细胞汇合达70%后,实验随机分为2 组,对照组继续采用普通培养基培养,实验组改用成牙本质诱导液(含10 mmol/L β-甘油磷酸钠、50 μg/ml维生素C、10 mol/L地塞米松、10% FBS的α-MEM培养液),培养21 d。取第7天培养的2 组细胞,采用ALP检测试剂盒进行ALP活力测定;取第14天培养的两组细胞,进行ALP染色(1%多聚甲醛于室温下固定30 min,加入现配的ALP混合液黑暗处染色30 min,三蒸水快速冲洗,于显微镜下拍照);取第21天培养的2 组细胞,进行茜素红染色(1%多聚甲醛于室温下固定30 min,加入1%茜素红染色10 min,三蒸水快速冲洗,于显微镜下观察),通过观察矿化结节来鉴定其矿化能力。
1.5 Arraystar芯片检测circRNAs表达谱
取第3代DPSCs按以上分组进行实验,取14 d培养后的两组细胞,加入Trizol静置5 min后提取总RNA。使用Arraystar芯片,样品标记和阵列杂交按照厂家的标准流程进行操作。将原始数据扫描图导入Agilent提取软件中进行原始数据提取。
1.6 circRNAs靶基因预测及生物信息学分析
对于差异表达的circRNAs,结合miRanda和TargetScan软件搜索其靶基因。使用DAVID6.7功能注释工具对差异circRNAs的靶基因进行GO和KEGG功能富集分析。利用DAVID将GO注释分成细胞组成、分子功能和生物过程3 个类别。GO和KEGG使用的统计学方法是基于超几何分布的Fisher精确检验,P<0.05时,具有统计学意义。
2 结 果
2.1 DPSCs的分离及矿化能力鉴定
细胞悬液通过CD酶消化获得,原代细胞培养24 h后开始贴壁生长,细胞呈星形或梭形。约3~4 d后细胞密度可达80%~85%。免疫磁珠筛选出STRO-1+的DPSCs,DPSCs的形态为纤维样,胞浆突起呈长梭形(图 1)。绘制DPSCs生长曲线,可见DPSCs的生长曲线呈S型(图 2)。

图 1 原代培养的细胞和DPSCs(P3)的形态(倒置显微镜, ×100)

图 2 DPSCs的生长曲线
DPSCs常规培养7 d的ALP活力测定值别为1.38±0.09;成牙本质诱导7 d后的DPSCs,ALP测定值为8.74±0.85,差异具有统计学差异(P<0.05),表明经矿化诱导后的DPSCs具有成牙本质细胞的特性。此外,DPSCs诱导14 d后,用ALP试剂盒染色,细胞局部增厚,染色明显加深。诱导21 d后,用茜素红染色,可见散在橙红色矿化结节(图 3)。
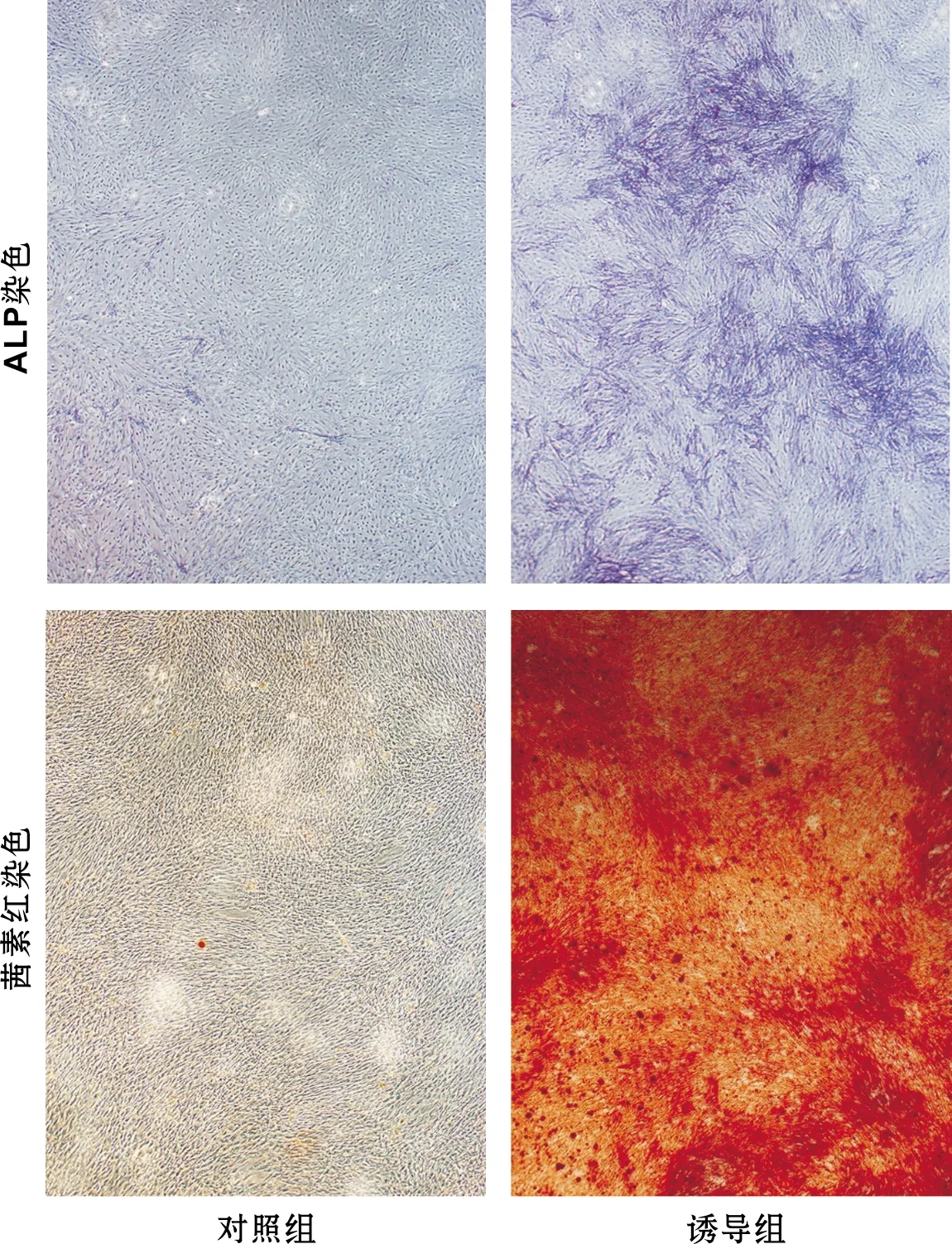
图 3 DPSCs诱导分化后ALP和茜素红染色结果(倒置显微镜, ×40)
2.2 DPSCs成牙本质诱导分化中circRNAs表达谱差异分析
运用R语言的limma对所有表达的circRNAs进行标准化,在每组数据中选取|差异倍数|>2的circRNAs。与对照组相比,DPSCs诱导后有42 个基因上调,有101 个下调。散点图显示:DPSCs在成牙本质诱导分化中circRNAs的表达情况,绿线表示差异2 倍的变化线,在轴线上方表示差异倍数>2的circRNAs,轴线下方表示差异倍数<-2的circRNAs(图 4)。

图 4 DPSCs成牙本质细胞诱导后circRNAs的差异表达
2.3 差异表达circRNAs靶基因的功能分析
对差异表达circRNAs的靶基因进行预测,并对其进行GO分类和KEGG pathway分析。对GO结果(P<0.05)分析可得出:靶基因主要存在于胞浆、核质等细胞内;可以定位大分子的位置,调节分子载体、核质载体等分子的活性;影响核质运输,核转运,胆固醇代谢等生物学过程。KEGG分析结果(P<0.05)表明:对差异表达的circRNAs预测的靶基因进行Pathway注释,其中主要涉及泛素介导的蛋白质水解、病毒、细菌感染途径、癌症途径、甾体生物合成等途径,也调控Wnt、PI3K-Akt和MAPK等多种信号通路。
3 讨 论
目前,对患有慢性根尖周病的年轻恒牙,一种理想的治疗方式是采用牙髓血运重建术,应用健康的牙髓组织代替坏死的牙髓组织,以促进牙根的继续发育,甚至牙髓再次出现活力[8]。DPSCs参与牙髓牙本质复合体的形成,使牙髓修复和再生成为可能[9]。前期课题组研究[10]发现,DPSCs具有较高的增殖率和矿化潜能,且DPSCs来源广,在成年后DPSCs仍较易获得。研究表明,DPSCs的生物学特性可以通过改变来促进牙髓血管再生,Khayat等[11]将含有脐静脉内皮细胞的凝胶加入DPSCs中,发现组织再生能力增强;Chen等[12]将富血小板纤维蛋白加入DPSCs中,发现其成骨能力增强。
circRNAs是一类独特的RNA,由特殊的环剪接形成的稳定结构[4],因此,circRNAs不易受RNase R的降解,由于其丰富、稳定和细胞型特异性表达[5],已成为基因调控和细胞内稳态的重要因素,不仅在细胞生长过程中起重要的作用,还在疾病的发病机制中作为有效的miRNAs海绵起着关键的作用[6,13]。有研究表明,circRNAs可作为许多疾病诊断的理想生物标志物,如动脉粥样硬化性血管性疾病、神经紊乱、朊蛋白疾病、癌症和阿尔茨海默氏病[13-14]。
目前已有大量的研究证实了circRNAs在牙源性干细胞向成骨分化中发挥了重要调控作用,且较为深入。Gu等[15]发现,PDLSCs向成骨分化时,有766个差异性circRNAs上调,690个circRNAs下调,这些差异表达的circRNAs的靶基因通过Wnt和MAPK信号通路促进PDLSCs成骨分化。Li等[16]发现,Circular RNA CDR1as通过miR-7/GDF5/SMAD和p38 MAPK信号通路调节PDLSCs的成骨分化,CDR1as或GDF 5的下调可抑制SMAD1/5/8和p38 MAPK的磷酸化,而上调miR-7则可降低SMAD 1/5/8和p38 MAPK的磷酸化。过表达的CircRNA CDR1as通过竞争性的结合miR-7,上调GDF5来促进PDLSCs的成骨分化。Du等[17]研究表明,在大鼠牙囊细胞(rat dental follicle cells rDFCs)成骨分化过程中,过表达的circFgfr2,通过竞争性结合miR-133,激活MAPK和TFG-β信号通路,靶向上调BMP6来促进rDFCs成骨。但circRNAs在DPSCs向成牙本质分化中的研究尚少,它是如何影响DPSCs干性状态的,目前尚未见报道。
本研究采用磁珠分选技术分选出hDPSCs,并通过Arraystar芯片检测DPSCs在成牙本质向诱导分化过程中特异性表达的circRNAs,并探讨其在DPSCs向成牙本质分化中的作用。与常规培养的DPSCs相比,circRNAs在成牙本质诱导分化中存在明显差异。|差异倍数|>2的circRNAs有143 个,其中,有42 个circRNAs在成牙本质诱导分化中高表达,提示差异性circRNAs可能在hDPSCs向成牙本质诱导分化中发挥重要作用。
本实验研究结果表明,差异性的circRNAs主要参与泛素介导的蛋白质水解、病毒、细菌感染途径、癌症途径、甾体生物合成等途径,也调控Wnt、PI3K-Akt和MAPK等多种信号通路。有研究表明,Wnt[10,15]和MAPK[15-17]通路在骨骼发育,甚至在PDLSCs的成骨分化中至关重要。研究发现,这些差异表达的circRNAs在其他领域中也有相关的研究,如Zhu等[18]研究发现,hsa_circ_0081001在骨肉瘤(osteosarcoma,OS)细胞系、组织和血清中显著上调,表明hsa_circ_0081001可以作为OS患者诊断的标志物和治疗靶点。Lv等[19]研究发现:在髓母细胞瘤(medulloblastoma,MB)中,上调的circ-SKA3(hsa_circ_0029696)和circ-DTL(hsa_circ_0000179)通过调节宿主基因SKA3和DTL的表达来促进髓母细胞体外增殖和侵袭,促进MB发生和发展,可认为是诊断MB潜在的生物标志物及治疗的新靶点。这与本研究中circRNAs调控癌症途径相符。在DPSCs向成牙本质分化过程中,差异表达的circRNAs有可能激活Wnt、PI3K-Akt和MAPK通路或其他信号通路,调控细胞分化,使DPSCs获得更强的分化能力,但这种推论有待进一步证实。
