钙卫蛋白调控口腔鳞癌细胞侵袭迁移作用机制
2020-12-07孙俊泽马洪胡赟鲍玲娜
孙俊泽 马洪 胡赟 鲍玲娜
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是最常见的颌面部恶性肿瘤,有高度的恶性、强侵袭、快转移等特性[1]。每年约有11 000例死亡,病死率仍逐年上升,存活率低主要与肿瘤侵袭和远处转移关联密切。因此,早期诊断和靶向抑制其发生进展及转移是防止和治疗的关键。S100A8/A9蛋白是以Ca2+依赖形式的一种钙结合蛋白,研究表明,S100A8和S100A9在胃癌、结直肠癌及鼻咽癌等肿瘤性疾病侵袭转移中建立预转移性龛,加快肿瘤转移[2]。有研究报道,抗S100A8/A9蛋白单克隆抗体可以有效抑制小鼠模型中S100A8/A9蛋白调控的黑色素瘤的转移[3]。但S100A8/A9蛋白在肿瘤侵袭迁移中的作用和机理尚未报道。本实验探究S100A8/A9蛋白对OSCC细胞侵袭迁移和p38MAPK信号通路的影响及机制,为OSCC靶向药物研发及进一步实验提供依据。
1 材料与方法
1.1 材料和试剂
舌鳞癌细胞SCC-25和CAL-27(ATCC,USA);S100A8蛋白和S100A9蛋白(Abcam,USA);胎牛血清(BI,IRS);DMEM-F12培养基和高糖DMEM培养基(Gibco,USA);兔抗p-p38MAPK、p38MAPK单克隆抗体、抗gapdh抗体及二抗(CST,USA);通路抑制剂SB203580(MCE,USA);显影液(Millipore,USA);CCK-8试剂盒(Biosharp);Transwell小室、培养板和培养皿(Corning,USA);基质金属蛋白酶-2(matrix metalloprotease 2,MMP-2)和基质金属蛋白酶-9(matrix metalloprotease 2,MMP-9)序列设计(广州博锐生物);RNA提取试剂盒(Roche,德国);逆转录试剂盒(TAKARA,日本)。
1.2 方法
1.2.1 细胞培养 在含有DMEM-F12/DMEM培养基的25 cm2培养瓶内培养SCC-25和CAL-27,培养的条件为37 ℃、5%CO2,细胞增殖汇合达80%时传代。
1.2.2 CCK-8检测细胞增殖活性 收集对数周期的细胞,先后冲洗、消化、调整细胞密度,在96孔板培养使每孔约含103个细胞,将S100A8和S100A9重组蛋白混合并在4 ℃下孵育1 h以形成S100A8/A9蛋白复合物[4],细胞基本贴壁后,调整S100A8/A9蛋白浓度为0、1、5、15、25、35 μg/ml的无血清培养基,24 h的时候在每孔按说明书加适量的药剂,等1.5 h后用酶标仪测吸光度数的值。
1.2.3 划痕实验 收集对数周期的细胞密度大约为1×105个/ml,细胞贴壁,枪头垂直孔板划线,清洗划下来的多余细胞,加入不含血清的培养基,设置S100A8/A9组及Control组,S100A8/A9组中加入1 μg/ml S100A8/A9蛋白,37 ℃、5%CO2条件下培养,于0、24、48、72 h进行拍照。
1.2.4 细胞的迁移实验和侵袭实验 细胞迁移实验收集对数周期的细胞,先后清洗、消化,调整细胞密度。在Transwell小室的下室中加600 μl的培养基且每毫升含有1 μg S100A8/A9蛋白,上室1×105个/200 μl细胞,24 h后小室取出清洗,先固定后染色,清洗干燥后镜下随机选5 个视野统计小室聚碳酸酯膜下表面细胞数。细胞侵袭实验检测操作步骤按照细胞迁移实验调整细胞密度,在小室上表面涂抹适量厚度基质胶,然后再加入1×105个/200 μl细胞,后续操作步骤同上。最后显微镜下观察小室聚碳酸酯膜下表面附着的侵袭细胞数,随机选取选5 个视野统计细胞数。
1.2.5 Western blot 蛋白质印迹法按照细胞的裂解方法提细胞总蛋白,每条泳道含有60 μg总蛋白,电泳完成后将10%SDS-PAGE胶上目的蛋白转到膜上,室温条件下封闭约2 h,一抗(1∶2 000)在4 ℃条件下过夜孵育,TBST洗3遍,在室温条件下二抗(1∶8 000)孵育大约2 h;TBST洗3 遍,成像系统下进行成像。图形分析软件Image J对图片进行处理,用每一个组的p-p38MAPK、p38MAPK和gapdh蛋白灰度的比分析样品蛋白的相对表达情况。
1.2.6 细胞免疫荧光染色 收集对数周期的细胞,先后清洗、消化,调整细胞密度。根据蛋白质印迹法结果设为0 h组、1 h组、12 h组,固定细胞,封闭,加入一抗p-p38MAPK(1∶50)4 ℃条件下过夜孵育, PBS冲洗3次,荧光二抗室温避光孵育1 h,PBS冲洗3 次,封片后荧光显微镜进行观察和拍照。
1.2.7 RT-qPCR 将细胞接种在24 孔板中培养,实验分为3 个组,分别为:Control组(DMSO)、S100A8/A9组和抑制剂组(S100A8/A9+SB203580)。RNA的检测方法参照说明书,引物序列:GAPDH:F:5'-GTATCGTGGAAGGACTCATGAC-3',R:5'-ACCACCTTCTTGATGTCATCAT-3';MMP-2:F:5'-CTGATGTCCAGCGAGTGGAT-3',R:5'-CTTCACCTCATTGTATCTCCAGAA-3';MMP-9:F:5'-CAGTACCGAGAGAAAGCCTATT-3',R:5'-CAGGATGTCATAGGTCACGTAG-3';以Control组作为对照组,计算Ct数值后,根据2-ΔΔCt算出各个组的mRNA相对表达情况。
1.3 统计学方法
2 结 果
2.1 S100A8/A9蛋白对OSCC细胞增殖活力的影响
不同浓度的S100A8/A9蛋白处理OSCC细胞24 h后,检测S100A8/A9蛋白对细胞增殖活力的变化见图 1,细胞增殖活力有浓度依赖性(P<0.05)。与Ang[5]等研究结果近似,在后续的实验中,用1 μg/ml S100A8/A9蛋白处理细胞。

图 1 S100A8/A9蛋白对SCC-25及CAL-27细胞增殖的影响
2.2 S100A8/A9蛋白对OSCC细胞侵袭迁移的影响
2.2.1 细胞划痕实验 结果如图 2,与对照组相比,随着时间变化细胞生长向划痕的地方迁移,S100A8/A9组的划痕区域小于同一时间点的对照组(P<0.05)。
2.2.2 Transwell实验 结果发现S100A8/A9组(83±7.32,89±5.31)比对照组(59±5.91,57±4.88)细胞迁移数显著要多,差异有统计学意义(P<0.001)。侵袭实验的结果发现S100A8/A9组(80±3.91,81±3.31)比对照组(53±3.22,52±3.57)细胞侵袭数显著要多,差异有统计学意义(P<0.001)(图 3)。
2.3 S100A8/A9蛋白对口腔鳞癌细胞p38MAPK通路活化的影响
添加1 μg/ml S100A8/A9蛋白处理口腔鳞癌细胞后,磷酸化p38MAPK水平在0.5~6 h内明显升高(图 4),12 h磷酸化水平降低,而总p38MAPK蛋白表达水平无明显影响。在存在或不存在10 μmol/L SB203580的情况下,用S100A8/A9蛋白处理细胞0.5 h,结果发现磷酸化p38MAPK水平在p38MAPK信号通路抑制后显著下降。细胞免疫荧光染色结果中的磷酸化p38MAPK水平(图 5)与免疫印迹检测的结果一致,S100A8/A9蛋白对p38MAPK通路存在激活作用。

图 2 S100A8/A9蛋白对SCC-25和CAL-27细胞迁移能力的影响(Transwell实验,×100)
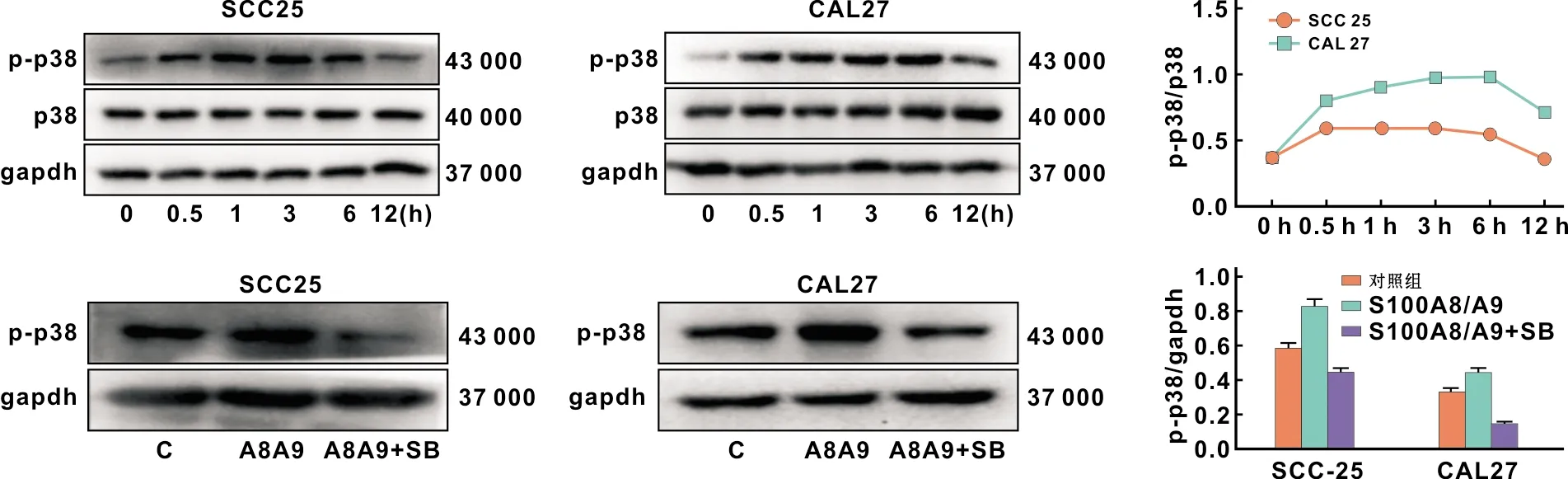
图 4 S100A8/A9蛋白对SCC-25及CAL-27细胞p38MAPK通路的影响(Western blot)

图 5 p-p38在OSCC细胞中的定位表达(荧光显微镜, ×400)
2.4 阻断p38MAPK信号通路后S100A8/A9蛋白对口腔鳞癌细胞的侵袭和迁移的影响
迁移Transwell实验结果发现抑制剂组(42±5.06,38±2.99)比空白组(56±2.18,57±2.14)和S100A8/A9蛋白组(87+4.10,90+3.56)细胞迁移数显著减少了(P<0.001)。侵袭Transwell实验结果发现抑制剂组(40±3.25,37±2.92)比空白组(52±3.16,55±2.44)和S100A8/A9蛋白组(80±4.58,81±3.81)细胞侵袭数显著减少了(P<0.001)(图 6)。
2.5 MMP-2和MMP-9参与S100A8/A9蛋白诱导的口腔鳞癌细胞侵袭和迁移
通过RT-qPCR检测对照组、S100A8/A9蛋白组和SB203580组口腔鳞癌细胞中目的基因MMP-2及MMP-9和GAPDH的表达、MMP-2和MMP-9基因表达量的比值,SB203580组(0.29±0.23,0.14±0.04)的MMP-2 mRNA表达情况分别与对照组(0.89±0.50,0.49±0.21)和S100A8/A9组(2.77±0.62,1.40±0.45)相比呈低表达(P<0.001)。SB203580组(0.15±0.09,0.20±0.09)的MMP-9 mRNA表达情况分别与对照组(0.55±0.27,0.72±0.25)和S100A8/A9组(1.30±0.44,1.27±0.32)相比呈低表达(P<0.001)。
3 讨 论
S100蛋白家族是一个由小分子量蛋白(10000~20000) 组成的钙结合蛋白家族,特异性表达于脊椎动物中,共有25名成员。S100A8/A9蛋白是S100蛋白家族重要的蛋白,位于1号染色体长臂2区1带,该区域稳定性差,可能与恶性肿瘤发生具有密切关系[6]。S100A8和S100A9常以同源二聚的结构存在,通过结合成稳定复合物而发挥作用,但由于二聚体通常不可检测,这也给S100A8/A9蛋白的研究带来了困难和挑战[7]。S100A8和S100A9在肿瘤细胞中主要通过免疫的细胞表达,通过与多种靶蛋白(包括酶,细胞骨架亚基,受体,转录因子)的相互作用发挥细胞因子和趋化因子作用,激活级联信号和触发细胞反应,从而促进

图 6 p38MAPK通路在 S100A8/A9 蛋白质促进SCC-25及CAL-27细胞迁移和侵袭能力中的作用(×400)
肿瘤生长和转移[8]。本课题组前期研究发现S100A8和S100A9在OSCC细胞间基质中的浸润细胞中表达,其在组织中表达量的高低与OSCC转移和侵袭相关,可作为预测预后的标志[9-10]。近来有研究报道,骨髓移植后小鼠的肿瘤模型,研究发现肿瘤微环境中的骨髓衍生细胞表达的S100A8/A9对于促进肿瘤发生是必需的[11]。因此,S100A8/A9蛋白可能作为药物靶点,在将来探索新的治疗肿瘤的方法将具有重要的临床价值。本实验观察到:S100A8/A9蛋白在OSCC细胞增殖活性中表现为浓度依赖性,高浓度(>35 μg/ml)抑制OSCC细胞的生长,低浓度(<35 μg/ml)促进OSCC细胞的生长,与国外研究结果一致,随后实验中探究低浓度S100A8/A9蛋白下对OSCC细胞的迁移和侵袭的影响,结果表明低浓度S100A8/A9蛋白能够增加OSCC细胞的迁移和侵袭能力,对其机制做了进一步探讨。
肿瘤侵袭转移过程是一多基因、多因素作用及多步骤过程,研究表明,S100A8/A9 通过与交互模式识别受体如Toll 样受体或晚期糖基化终末产物受体,激活 MAPK 和 NF-kB 信号通路来调节自分泌和旁分泌,促进肿瘤转移前微环境形成,从而加快肿瘤的发展。p38MAPK是MAPK信号通路关键的信号转导路径之一,p38MAPK激活后磷酸化下游转录因子和蛋白激酶,激活特定的细胞内信号级联如MMPs,调控着细胞的迁移和侵袭[12]; MMPs可以诱导肿瘤细胞和细胞外基质的降解,MMPs表达量的变少直接导致ECM重构,因此也被认为是肿瘤侵袭和转移的标志[13],MMPs中其MMP-2和MMP-9是肿瘤的侵袭和转移的良好标志,在小鼠肝癌模型中,敲低S100A8和S100A9基因,肝转移灶的MMP-2和MMP-9的表达量降低[2]。因此,p38MAPK信号通路被认作是肿瘤细胞的侵袭和迁移中关键的通路,抑制其信号通路,细胞的迁移和侵袭也受到影响[14];小鼠肿瘤模型的初步实验表明,特异性靶向阻断p38MAPK信号通路可抑制体内肺癌的形成[15]。国内外虽然对OSCC的迁移和侵袭有一些研究,但其分子机制尚未明确报道。本实验观察到:S100A8/A9蛋白能够增加p-p38MAPK的蛋白表达量, MMP-2 mRNA和MMP-9 mRNA的表达量也出现上调,为了进一步研究抑制p38MAPK通路后,p-p38MAPK的蛋白表达量降低,MMP-2 mRNA和MMP-9 mRNA的表达量明显降低,表明其对p38MAPK通路有激活作用,同时在细胞免疫荧光染色中细胞质和细胞核内观察到p-p38MAPK 表达量增高,随后在迁移和侵袭实验中,同样抑制了p38MAPK通路,OSCC细胞迁移和侵袭能力也随之减弱,进一步验证低浓度S100A8/A9蛋白增加OSCC细胞迁移和侵袭过程中参与了p38MAPK通路, 提示低浓度S100A8/A9蛋白可能通过激活p38MAPK通路促进OSCC细胞迁移和侵袭。
综上所述, 低浓度 S100A8/A9蛋白可以促进OSCC细胞迁移和侵袭,其机理可能是活化了p38MAPK通路。目前S100A8/A9蛋白作为OSCC治疗的药物具有巨大的开发前景,本研究由于S100A8/A9蛋白复合物的基因敲除技术难度高并缺乏体内实验,造成了一定的局限性,本课题组后期将解决这些问题来进一步验证。其本次研究的结果及进一步的深入研究将为开发新的OSCC治疗药物提供新的靶点和理论基础。
