补骨脂二氢黄酮甲醚调控Gamma delta T细胞消减胃癌SGC-7901研究
2020-11-26丁钦吴克俭郑璐
丁钦 吴克俭 郑璐


摘要 目的:探討补骨脂二氢黄酮甲醚调控γδT细胞消减胃癌SGC-7901程度。方法:获取人外周血中单个核细胞,体外扩增γδT细胞,不同浓度BVC诱导γδT细胞、SGC-7901细胞24 h、48 h和72 h,CCK-8检测BVC对γδT细胞增殖率、SGC-7901抑制率影响;流式细胞术测γδT细胞GZMB、PF、CD107a产生量;LDH法测γδT细胞消减SGC-7901程度。结果:体外扩增8 d,γδT细胞比例由3.54%增至85.34%。与对照组比较,BVC诱导24 h,浓度10~80 nmol/L促进γδT细胞增殖(P<0.05)。BVC诱导48 h、72 h,浓度5~80 nmol/L促进γδT细胞增殖(P<0.05)。同样浓度,72 h γδT细胞增殖率最大。BVC作用肿瘤细胞24 h、48 h、72 h,浓度160~640 nmol/L SGC-7901生长抑制率高于对照组(P<0.05),浓度10~40 nmol/L,GZMB、PF、CD107a表达高于对照组(P<0.05)。BVC诱导γδT细胞72 h,一定浓度该T细胞消减SGC-7901程度随浓度增高而增高,浓度40 nmol/L消减程度最大,后呈下降趋势。结论:BVC适宜浓度促进γδT细胞增殖,抑制SGC-7901生长,加强γδT细胞消减SGC-7901程度,机制考虑:PF、GZMB、CD107a表达提高增强γδT细胞消减能力。
关键词 补骨脂二氢黄酮甲醚;γδT细胞;胃癌;SGC-7901;杀伤活性;颗粒酶B;穿孔素;CD107a
Abstract Objective:To investigate the regulation of psoralen dihydroflavonoid methyl ether to reduce the degree of gastric cancer SGC-7901 by γδT cells.Methods:Human peripheral blood mononuclear cells was obtained,γδ T cells in vitro was expanded,γδ T cells and SGC-7901 cells with different concentrations of BVC for 24 h,48 h and 72 h were induced.CCK-8 detected the effect of BVC on the proliferation rate of γδ T cells and SGC inhibition rate; flow cytometry was used to measure the production of GZMB,PF,CD107a in γδ T cells; LDH method was used to measure the degree of γδ T cell depletion SGC-7901.Results:After 8 days of in vitro expansion,the proportion of γδT cells increased from 3.54% to 85.34%.Compared with the control group,BVC was induced for 24 h at a concentration of 10 to 80 nmol/L to promote the proliferation of γδT cells(P<0.05).BVC was induced 48 h,72 h,with the concentration of 5 to 80 nmol/L promoting the proliferation of γδT cells(P<0.05).At the same concentration,72 h γδT cell proliferation rate was the highest.BVC acted on tumor cells for 24 h,48 h,72 h,with a concentration of 160-640 nmol/L.The growth inhibition rate of SGC-7901 was higher than that of the control group(P<0.05),with a concentration of 10-40 nmol/L.GZMB,PF and CD107 expression was higher than the control group(P<0.05).As for BVC induced γδ T cells for 72 h,the degree of depletion of SGC-7901 at a certain concentration of T cells increased with the increase of the concentration.The degree of depletion of SGC-7901 at a concentration of 40 nmol/L was the largest and then showed a downward trend.Conclusion:The appropriate concentration of BVC promotes the proliferation of γδ T cells,inhibits the growth of SGC-7901,and strengthens the degree of depletion of SGC-7901 by γδ T cells.The mechanism is considered:the expression of PF,GZMB,and CD107a increase and enhance the depletion ability of γδ T cells.
Keywords Psoralen dihydroflavonoid methyl ether; γδT cells; Gastric cancer; SGC-7901; Killing activity; Granzyme B; Perforin; CD107a
中圖分类号:R735.2 文献标识码:A doi:10.3969/j.issn.1673-7202.2020.20.007
目前中国正面临着人口老龄化的挑战和快速城市化的影响,癌症的发病率也随之增加[1]。胃癌在亚洲东部、欧洲东部以及美国热带南部等地区具有特别高的发病率[2]。胃癌患病率高,但疗效不佳,欠缺有效的治疗措施。目前,肿瘤免疫治疗得到了长足的进步,为该类患者远期疗效带来了根本性变化[3]。γδT细胞是一种能够表达抗原受体的免疫细胞,γδT细胞参与的抗肿瘤免疫治疗主要是通过分泌促凋亡分子和炎性反应细胞因子或者通过TCR依赖性途径,对多种癌细胞产生强烈的细胞毒性,从而在免疫监视和针对肿瘤的免疫防御中的起到重要作用[4]。甲基补骨脂黄酮是由补骨脂提取的某种化合物,具有消减肿瘤、调整免疫等多种疗效[5],补骨脂二氢黄酮甲醚(BVC)对HepaRG、HCT-116、PC-3等多种细胞具有抗增殖作用[6-7]。2014年,Chen X等[8]发现BVC能促使Th2向Th1飘移,进而发挥调节免疫作用。为此,我们假设其可能同样能够调控γδT细胞的免疫能力以及抗癌的效果,同时初探其可能的机制。
1 材料与方法
1.1 材料
1.1.1 细胞 将已复苏的胃癌SGC-7901细胞株用GT-T551H3培养基予以悬浮,每瓶15 mL加入75 cm2细胞培养瓶中,于37°C、5% CO2条件下培养,每2~3天更换肿瘤细胞培养液,待细胞铺满80%左右的瓶底时,釆用0.25%的胰蛋白酶予以脱壁,待细胞悬浮完成后收取细胞,予以计数后用于后续相关实验。
1.1.2 药物 补骨脂二氢黄酮甲醚(Bavachinin,大连美仑生物技术公司,货号:MB6545)。
1.1.3 试剂与仪器 二甲基亚砜(湖南九典制药股份有限公司,批号:F25170302);淋巴细胞分离液(天津市灏阳生物制品科技有限责任公司,货号:LTS1077);补骨脂二氢黄酮甲醚(大连美仑生物技术公司,货号:MB6545);异戊烯焦磷酸(Sigma-Aldrich,美国,批号:SLCB2751);胎牛血清(Gibco公司,美国,货号:10091-148);GT-T551 H3培养基(TaKaRa公司,日本,批号:AK2P027);Anti-CD3(PeproTech公司,美国,批号:25G261905121);IL-2(双鹭药业,批号:S19991007);CCK-8(日本同仁,日本,货号:VC5001);CD107a(Biolegend公司,美国,批号:B181677);穿孔素(苏州康达医疗用品贸易有限公司,批号:7297548);颗粒酶B(Becton,Dickinson and Company,美国,批号:3200644);破膜剂(Nordic Mubio,荷兰,批号:16389);胰蛋白酶(Beyotime,批号:011020200528);乳酸脱氢酶试剂盒(宁波普瑞柏生物技术有限公司,批号:LD0359);贝克曼AU680生化仪(贝克曼,美国,型号:AU680);实验显微镜(NiKON,日本,型号:NiKON ECLIPSE TE2000-S);酶标仪(上海科华生物工程股份有限公司,型号:KHB ST-360);流式细胞技术仪(BD公司,美国,型号:BD-FACSCalibur)。
1.2 方法
1.2.1 分组与模型制备
1.2.1.1 CCK8法检测BVC对γδT细胞生长影响 对照组:γδT细胞(未加入补骨脂二氢黄酮甲醚);实验组:γδT细胞+不同浓度的补骨脂二氢黄酮甲醚(2.5、5.0、10、20、40、80、160、320、640 nmol/L)。
1.2.1.2 CCK8法检测BVC对胃癌SGC-7901生长改变 对照组:胃癌SGC-7901细胞株(未加入补骨脂二氢黄酮甲醚);实验组:胃癌SGC-7901细胞株+不同浓度的补骨脂二氢黄酮甲醚(2.5、5.0、10、20、40、80、160、320、640 nmol/L)。
1.2.1.3 流式细胞术检测不同浓度BVC诱导前后γδT免疫细胞中藻红蛋白标记的PF、GZMB及藻蓝蛋白标记的CD107a表达 对照组:γδT细胞(未加入补骨脂二氢黄酮甲醚)。实验组:γδT细胞+不同终浓度的补骨脂二氢黄酮甲醚(根据CCK8最终结果筛选出实验浓度,补骨脂二氢黄酮甲醚终浓度设置为2.5、10、40、160 nmol/L)。
1.2.1.4 LDH法测定不同浓度BVC诱导前后的γδT细胞消减SGC-7901细胞程度 对照组:γδT细胞+胃癌SGC-7901细胞(未加入补骨脂二氢黄酮甲醚);实验组:不同浓度补骨脂二氢黄酮甲醚作用72 h后的γδT细胞+胃癌SGC-7901细胞株(补骨脂二氢黄酮甲醚终浓度分别为2.5、10、40、160 nmol/L)。
1.2.2 给药方法
1.2.2.1 CCK8法检测BVC对γδT细胞生长影响 对照组:未加入补骨脂二氢黄酮甲醚;实验组:补骨脂二氢黄酮甲醚药物终浓度分别为2.5、5.0、10、20、40、80、160、320、640 nmol/L。
1.2.2.2 CCK8法检测BVC对人胃癌SGC-7901生长改变 对照组:未加入补骨脂二氢黄酮甲醚;实验组:补骨脂二氢黄酮甲醚药物终浓度分别为2.5、5.0、10、20、40、80、160、320、640 nmol/L。
1.2.2.3 流式细胞术检测不同浓度BVC诱导前后γδT免疫细胞中藻红蛋白标记的PF、GZMB及藻蓝蛋白标记的CD107a表达 对照组:γδT细胞(未加入补骨脂二氢黄酮甲醚)。实验组:补骨脂二氢黄酮甲醚终浓度设置为2.5、10、40、160 nmol/L。
1.2.2.4 LDH法测定不同浓度BVC诱导前后的γδT细胞消减SGC-7901细胞程度 对照组:γδT细胞+胃癌SGC-7901细胞(未加入补骨脂二氢黄酮甲醚)。实验组:补骨脂二氢黄酮甲醚终浓度分别为2.5、10、40、160 nmol/L。
1.2.3 检测指标与方法
1.2.3.1 γδT细胞培养前后纯度鉴定的检测 γδT细胞百分比、FCM。具体如下:取康壮志愿者抗凝血20 mL,用淋巴细胞分离液获取具有单个核的细胞(1 800 r/min,离心12 min,离心半径为12 cm,下同),等渗盐水洗涤2次(1 800 r/min离心,9 min/次),用GT-T551 H3培养基调整细胞密度为1.0×105/mL,置于75 cm2细胞培养瓶中,再放入37°C、5%CO2培养箱中培养,8 d后收集细胞,进行免疫细胞表型检测和有关实验。
1.2.3.2 BVC对γδT细胞生长影响的检测 增殖率、CCK8法。具体如下:取培育8 d的γδT细胞,测试γδT细胞纯度达到使用要求,将γδT细胞调整为细胞悬液,接种于96孔板,200 μL/孔,依据BVC的不同浓度分为10组,并将药物终浓度0 nmol/L定为对照组。加药时间为γδT细胞贴壁后,同一种浓度同一时间段设3个复孔。继续培养不同的时间段。各个孔滴入CCK8 20 μL,需避免气泡,以免影响后续OD值的读数,继续培育4 h,弃上清液,上酶标仪(450NM)测定各孔吸光值并记录结果。每组重复操作实验3遍,取结果平均值,计算增殖率。
1.2.3.3 BVC对人胃癌SGC-7901生长改变的检测 肿瘤细胞生长抑制率(%)、CCK8法。具体如下:获得处于对数期的SGC-7901,每孔3×104个细胞接种到96孔板,根据BVC不同终浓度分为10组,同时将药物终浓度0 nmol/L定为对照组,培育不同的时间段后,每孔加入CCK8 10 μL,再培育4 h,于酶标仪450 nm处检测各孔吸光度(OD)值,计算肿瘤细胞抑制率。各组3个复孔,实验操作重复3次,取其结果的平均值。肿瘤細胞生长抑制率(%)=(对照组OD值-实验组OD值)/(对照组OD值)×100%。
1.2.3.4 不同浓度的BVC诱导前后γδT免疫细胞中藻红蛋白标记的PF、GZMB及藻蓝蛋白标记的CD107a表达的检测 PF表达率、GZMB表达率、CD107a表达率、流式细胞术。具体如下:取BVC诱导72 h后的γδT细胞,重复清洗3遍,细胞数目为1×107/L,100 μL细胞悬液加入流式细胞技术分析管,每个试管滴anti-γδTCR-FITC20 μL,遮光培育30 min。100 μL固定液室内温度遮光培育15 min,PBS洗涤,1 500 r/min,离心5 min,弃上清。检测藻红蛋白标记的GZMB、PF的管中加入破膜剂B 100 μL,各试管滴加anti-GraB-PE、anti-PFP-PE各5 μL;期间均设置同型对照抗体管。室内温度遮光培育15 min,清洗,2 000 r/min,离心5 min,弃上清,PBS 1 mL重悬细胞,流式分析仪分析各管中藻红蛋白标记的GZMB、PF的表达及藻蓝蛋白标记的CD107a的表达。反复3次,取结果的平均。
1.2.3.5 测定不同浓度BVC诱导前后的γδT细胞消减SGC-7901细胞程度的检测 消减活性(%)、LDH法。具体如下:各自滴入预设好浓度的BVC(终浓度为2.5、10、40、160 nmol/L),未加BVC的为对比组,各个组复孔3个,孵育72 h,作为效应细胞。效靶细胞每个均取0.5 mL,培育6 h,轻柔混好,转速1 800 r/min,离心时间为10 min,收集上清液。选定波长下测取吸光度值(A值),计算消减活性,实验操作重复3遍,取结果的平均值加以计算。消减活性(%)按照已定公式加以计算。
1.3 统计学方法 利用SPSS 16.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间处置予以单因素的方差分析,假设检验的标尺以α=0.05加以比对,以P≤0.05为差异有统计学意义。
2 结果
2.1 γδT细胞培养前后纯度鉴定 FCM结果显示,人γδT细胞体外培养8 d后,所占比例由培养前的3.54%增加到85.34%。见图1。
2.2 BVC对γδT细胞增殖率的影响 不同浓度BVC作用γδT细胞不同的时间段,BVC诱导24 h后,与对照组比较,其浓度位于10~80 nmol/L时能够促使γδT细胞增殖(P<0.05)。BVC诱导48 h、72 h后,与对照组比较,浓度位于5~80 nmol/L时能够促进γδT细胞增殖(P<0.05)。当药物浓度超过320 nmol/L时,3个时间段的γδT细胞均处于抑制状态(P<0.05)。同样药物浓度时,72 h的γδT细胞增殖率最大。见表1,图2。
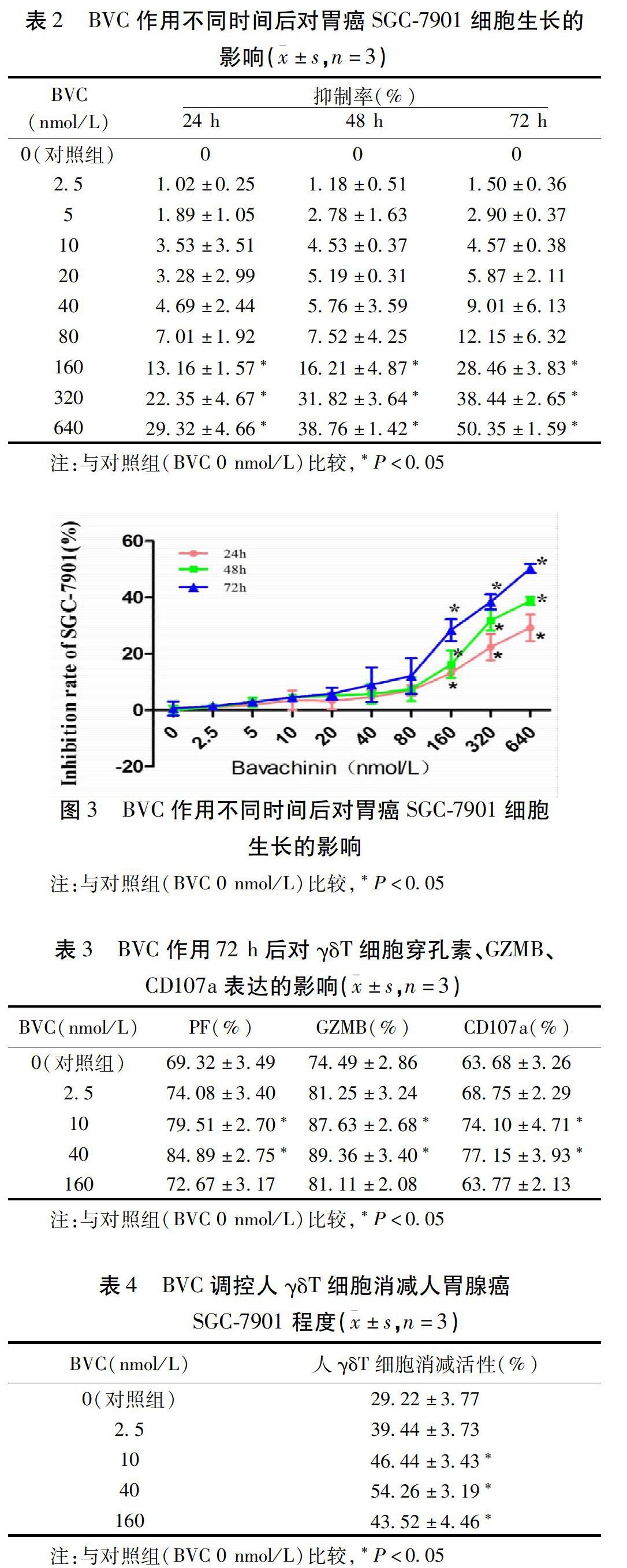
2.3 BVC作用不同时间对胃癌SGC-7901细胞生长的影响 在BVC作用肿瘤细胞24 h、48 h、72 h后,与对照组比较,CCK-8检测结果显示,药物浓度在160~640 nmol/L区间时胃癌SGC-7901细胞的生长抑制率要高于对照组(P<0.05),其他药物浓度组SGC-7901细胞的生长抑制率与对照组比较差异无统计学意义(P>0.05),结果表明BVC在高浓度时对SGC-7901细胞的生长具有抑制作用。见表2,图3。
2.4 不同浓度BVC对γδT细胞穿孔素、GZMB、CD107a影响 流式细胞术测验结果表明,BVC诱导γδT细胞72 h后,当其药物浓度在10~40 nmol/L区间时,藻红蛋白标记GZMB、藻红蛋白标记PF以及藻蓝蛋白标记的CD107a的状况均高于对照组(P<0.05),并且当BVC的药物浓度超过40 nmol/L时,藻红蛋白标记的穿孔素、藻红蛋白标记GZMB以及藻蓝蛋白标记的CD107a的状况呈现下降趋势。见表3,图4~6。
2.5 BVC调控γδT细胞消减人胃腺癌SGC-7901细胞程度 BVC诱导γδT细胞72 h以后,在一定的浓度范围内,γδT细胞对于人胃腺癌SGC-7901的消减随着浓度的增高而增高,浓度为40 nmol/L时消减活性最大,并且当BVC的药物浓度超过40 nmol/L时,γδT细胞对于胃癌SGC-7901细胞的消减活性呈现下降趋势。见表4,图7。
3 讨论
胃癌(Gastric Cancer,GC)是世界上常见肿瘤之一,是全球癌症相关死亡的第二大原因。不可切除或转移性胃癌患者的预后较差[9]。我国是胃癌高发国家,发病和死亡例数均约占世界的50%,疾病负担严重,是癌症防治的重点[10]。
BVC是一种异戊烯基黄酮类化合物,用途广泛,如消减癌症细胞、抗过敏、抗炎、调节免疫等[11-12]。通过实验发现,在BVC作用肿瘤细胞24 h、48 h以及72 h后,CCK-8检测结果显示,药物浓度在160~640 nmol/L区间时胃癌SGC-7901细胞的生长抑制率高于对照组(P<0.05),其他药物浓度组SGC-7901细胞的生长抑制率与对照组比较差异无统计学意义(P>0.05),实验结果表明BVC在高浓度时对胃癌SGC-7901细胞的生长具有抑制作用。結合BVC有调节免疫作用,我们考虑是否可以通过辅助采用免疫治疗的手段,来增强抗肿瘤的效果。
免疫细胞消减癌症细胞是借助免疫效应细胞来控制恶性肿瘤目标的一种疗法,其已成为一种新的治疗肿瘤的方式。有别于αβT细胞,γδT细胞能够以不依赖MHC的方式来识别抗原。如淋巴细胞功能相关分子(LFA)、NKG2D分子、CD16以及其他在γδT细胞识别和杀伤癌细胞中发挥关键作用的分子[13]。总而言之,γδT细胞在癌症免疫治疗方面有较为广泛的应用前景。在此次实验中,BVC诱导γδT细胞24 h后,在10~80 nmol/L的浓度范围内,与对照组比较,γδT细胞有一定程度的增殖。BVC诱导γδT细胞48 h、72 h后,在5~80 nmol/L的浓度范围内,与对照组比较,γδT细胞较之有一定程度的增殖。这为今后的胃癌临床免疫治疗中应用BVC提供了些许理论参考。
CTL是针对癌症的较为理想的免疫细胞,其在接触靶细胞后分泌的效应物主要是颗粒酶和穿孔素,二者所诱导的凋亡是细胞毒性淋巴细胞介导的抗肿瘤免疫的主要途径。PF主要是细胞毒性淋巴细胞、自然杀伤细胞生成,他使得目标细胞渗透的压力改变进而使其死亡,抑或于PF共同作用而导致目标的凋亡。GZMB则为CTL生成的物质,其通过半胱天冬酶的活化来诱导诱导肿瘤细胞和病毒感染细胞的凋亡。但是,在诱导靶细胞凋亡的过程中,GZMB扮演更为重要的角色。既往的研究表明,CD107a存在于细胞毒性颗粒的膜中,其能够以特异性抗原的形式来介导杀伤,CD107a主要与细胞毒性活性相关,是细胞毒性活性的敏感标记[14-17]。本次实验发现,一定浓度范围的BVC诱导γδT细胞72 h后,PFP、GraB、CD107a的表达较对照组有一定程度的升高,并且在BVC的药物浓度为40 nmol/L时,3种标记的表达较为明显。另外,我们通过乳酸脱氢酶法检测发现,在BVC的药物浓度为40 nmol/L时,经过BVC诱导后的免疫细胞消减人胃腺癌SGC-7901程度同样到达最高峰。为此,我们推测BVC有可能通过升高γδT细胞PF、GZMB以及CD107a的表达进而增强γδT细胞对肿瘤细胞的杀伤活性。
总而言之,在一定的浓度范围,BVC使得γδT细胞增殖,增强γδT细胞对人胃腺癌SGC-7901消减,其机制考虑:PF、GZMB、CD107a的表达提高增强了γδT细胞的消减能力。另外,BVC之于人胃腺癌SGC-7901生长具有抑制效果,这为今后BVC应用于γδT免疫细胞治疗胃癌提供了一定程度的参考意义和理论支撑。
参考文献
[1]Yu S,Yang C S,Li J,et al.Cancer Prevention Research in China[J].Cancer Prev Res,2015,8(8):662-674.
[2]Torre L A,Bray F,Siegel R L,et al.Global cancer statistics,2012[J].Cancer J Clin,2015,65(2):87-108.
[3]丁乃清,魏嘉,陈仿军,等.胃癌免疫治疗临床研究进展[J].肿瘤综合治疗(连续型电子期刊),2018,4(2):1-5.
[4]Zou C,Zhao P,Xiao Z,et al.γδT cells in cancer immunotherapy[J].Oncotarget,2017,8(5):8900-8909.
[5]Zhang X,Zhao W,Wang Y,et al.The Chemical Constituents and Bioactivities of Psoralea corylifolia Linn:A Review[J].Am J Chin Med,2016,44(1):35-60.
[6]Wang S,Wang M,Tian Y,et al.Bavachinin induces oxidative damage in HepaRG cells through p38/JNK MAPK pathways[J].Toxins,2018,10(4):154.
[7]Gupta N,Qayum A,Raina A,et al.Synthesis and biological evaluation of novel bavachinin analogs as anticancer agents[J].European journal of medicinal chemistry,2018,145(10):511-523.
[8]Chen X,Shen Y,Liang Q,et al.Effect of Bavachinin and its derivatives on T cell differentiation[J].Int Immunopharmacol,2014,19(2):399-404.
[9]Ju Y,Sun S.Prolonged overall survival in metastatic gastric cancer treated with ipilimumab and lapatinib[J].Journal of cancer research and therapeutics,2018,14(7):1589-1593.
[10]左婷婷,郑荣寿,曾红梅,等.中国胃癌流行病学现状[J].中国肿瘤临床,2017,44(1):52-58.
[11]Qian J,Xie F,Shi Y,et al.Pharmacokinetic and metabolism studies of bavachinin through ultra-high-performance liquid chromatography coupled with electrospray ionization tandem mass spectrometry[J].Biomedical Chromatography,2018:e4293.
[12]Luo J,Liang Q,Shen Y,et al.Biotransformation of bavachinin by three fungal cell cultures[J].J Biosci Bioeng,2014,117(2):191-196.
[13]Alnaggar M,Xu Y,Li J,et al.Allogenic Vγ9Vδ2 T cell as new potential immunotherapy drug for solid tumor:a case study for cholangiocarcinoma[J].Journal for immunotherapy of cancer,2019,7(1):36.
[14]Farhood B,Najafi M,Mortezaee K.CD8+ cytotoxic T lymphocytes in cancer immunotherapy:A review[J].Journal of cellular physiology,2019,234(6):8509-8521.
[15]Legut M,Cole DK.The promise of γδT cells and the γδT cell receptor for cancer immunotherapy[J].Cell Mol Immunol,2015,12(6):656-668.
[16]Dong H,Xu X,Yu X.Perforin and granzyme--the perfect material of biologic missile[J].J Biological Eng,2005,22(5):1075-1077.
[17]Aktas E,Kucuksezer U C,Bilgic S,et al.Relationship between CD107a expression and cytotoxic activity[J].Cell Immunol,2009,254(2):149-154.
(2019-03-12收稿 責任编辑:芮莉莉)
