基于钙的植物免疫研究进展
2020-11-26张佳默史江伟
张佳默,史江伟
(1.福建农林大学农学院;2.海峡联合研究院植物免疫中心,福建 福州 350002)
在动植物中,细胞内的钙主要以结合态形式存在,且细胞外Ca2+浓度远高于细胞内.细胞外Ca2+的内流和细胞内钙库(如液泡、叶绿体)的释放可提高细胞内Ca2+浓度从而调控各种生理过程.Ca2+作为真核生物细胞信号传导的第二信使,常通过钙结合蛋白和钙离子通道参与植物生长发育(如开花、受精)以及植物对环境的反应,包括非生物胁迫(如干旱、低温等)和生物胁迫(如病原菌侵染和昆虫侵袭).植物细胞钙信号系统的主要成分有Ca2+通道、Ca2+-ATPases、Ca2+结合蛋白和Ca2+依赖蛋白,还包括受体、放大Ca2+信号的级联反应和转录因子[1].植物体内的钙通常与蛋白质结合形成钙信号感受器实现高水平的调节,Ca2+浓度的瞬变和钙信号的传导通过Ca2+蛋白结合工具包进行解码和运输,然后通过Ca2+响应启动子元件调节转录和蛋白磷酸化[2].面临多变的生存环境和病原菌的干扰,植物在长期进化过程中形成双重免疫系统以进行自身防卫,钙离子通道在植物免疫调控方面发挥着重要作用.本文主要从植物的两层防御系统方面阐述Ca2+通道的免疫机制.
1 基于钙的植物免疫
1.1 Ca2+通道介导的植物免疫
2001年Dangl et al[3]提出植物与病原菌互作主要有两层防卫系统,第一层是通过模式识别受体(pattern recognition receptors,PRRs)来识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)的病原体/微生物相关分子模式触发免疫(PAMP-triggered immunity,PTI),识别出PAMPs和DAMPs(danger signal-associated molecular patterns)后,引发胞内Ca2+浓度快速上升和活性氧(ROS)积累(如图1所示).Couto et al[4]提出这些反应进一步导致Ca2+依赖性蛋白激酶(Ca2+-dependent protein kinase,CDPKs)的激活和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的启动,然后将信号转导传递到细胞核,进而调控PTI的转录.此外,Blume et al[5]通过使用Ca2+通道抑制剂和阻滞剂抑制钙信号,发现PTI的激活受到明显抑制,并提出一些Ca2+通道参与了这些过程.在植物与病原菌协同进化过程中,病原菌利用一些效应因子抑制或躲避PTI,同样植物也进化出应对病原菌侵袭的效应因子触发的免疫性(effectors-triggered immunity,ETI)机制以增强自身抗干扰能力.近年来逐渐发现植物免疫的PTI与ETI两层防御系统存在复杂的关联性,但Ca2+在两层防御系统中是否存在交互作用尚未明确.
图1 钙信号在植物免疫中的传导作用[6]Fig.1 Transduction of calcium signal in plant immunity[6]
1.1.1 Ca2+通道——环核苷酸门控离子通道 植物环核苷酸门控离子通道(cyclic nucleotide gated channels,CNGCs)是直接由环状核苷酸和钙调蛋白调节的质膜上的四聚体通道[7].已知HLM1基因编码1个环核苷酸门控通道CNGC4,其表达是受病原菌感染引起的免疫信号调控,可能构成导致植物超敏反应(HR)相关的细胞编程性死亡信号通路的共同下游成分[6].Ma et al[8]以拟南芥为材料,将PEPR1(植物诱导肽Pep肽的受体)促进的免疫信号与cGMP(cyclic guanosine monophosphate)激活的Ca2+通道和环核苷酸门控阳离子通道2(CNGC2)的功能联系起来.表明PEPR1连接特定受体蛋白,并与其配体协同作用产生Ca2+信号,然后在Ca2+触发的病原体反应中发挥相互依赖的作用,如基础防御免疫(PTI)和效应因子触发的免疫(ETI).此外,还揭示了Pep/PEPR1免疫信号和细菌鞭毛蛋白flg22及其受体FLS2启动的Ca2+依赖性免疫信号之间的差异,前者通过cGMP促使Ca2+升高且需要细胞外Ca2+参与,后者则对胞内Ca2+的储存要求较高.CNGC作为动植物细胞中通用的离子通道基因家族,与植物PTI、ETI反应存在直接联系,但目前对CNGC信号通道的研究尚处于较浅的阶段.
1.1.2 Ca2+通道——谷氨酸类受体通道(GLRs) 谷氨酸类受体通道(glutamine-like receptor channels,GLRs)在生物应激反应中有3个重要功能,即PAMP/DAMP识别、全身创伤信号转导和激活茉莉酸(JA)信号转导.近年来普遍认为,Ca2+内流被elf18、flg22等植物PAMPs识别激活,通过抑制性谷氨酸类受体(inhibitory glutamate receptor,IGluRs)通道发挥信号传导功能.2006年Kang et al[9]研究表明,植物GLRs参与了JA相关Ca2+信号防御反应.谷氨酸类受体通道(GLRs)不仅在长距离信号传导中发挥作用,而且参与短距离信号传导.2017年Vincent et al[10]利用荧光钙生物传感器(GCaMP3)结合绿色桃蚜研究拟南芥的钙动态,证明了植物钙在桃蚜的取食点附近小区域内快速升高,并发现植物防御共受体油菜素类固醇非敏感相关激酶1(brassinosteroid insensitive associated kinase receptor 1,BAK1)、质膜离子通道谷氨酸受体-3.3和3.6(GLR3.3和GLR3.6)以及空泡离子通道双孔通道1(two pore channel1,TPC1)之间的相互作用介导了钙离子的升高.
1.1.3 其他Ca2+通道——TPCs以及降低高渗诱导Ca2+浓度增加通道(OSCAs) 两孔Ca2+通道(TPCs)是许多植物防御反应中相关基因表达的关键调控因子,可能在Ca2+稳态方面发挥作用.Peiter et al[11]研究表明,虽然ABA能够通过不依赖TPC1途径使保卫细胞发生反应,但胞外Ca2+浓度升高则需要TPC1. Edel et al[12]在2015年提出,OSCAs通道是新发现的一类Ca2+传导通道,可能在动物和植物中发挥作用,并且其复杂性随着植物进化显著增加.植物和动物在Ca2+通道上存在显著差异,但各自都有复杂的运作机制,且随着环境变化,动植物的Ca2+通道仍会进化出更高级机制以调节自身的免疫功能,而有的Ca2+通道会随动植物进化而消失.近年来关于植物Ca2+通道的研究不断展现新的成果,本文主要列举植物体内较重要的且已被报道的4类Ca2+通道,以期更多学者能对Ca2+通道调控的免疫反应有更深刻的认识.
1.2 Ca2+感受器介导的植物免疫
钙依赖性蛋白激酶 (calcium-dependent protein kinases,CDPKs)、钙调素蛋白(calmodulin,CaM)/类钙调素蛋白(caM-like protein,CML)系统、钙调磷酸酶B类蛋白(calcineurin B-like protein,CBL)/CBL结合蛋白激酶(CBL interacting protein kinase,CIPK)信号通路是最重要的3类Ca2+感受器[2].这些Ca2+传感器都具有与Ca2+结合的特定结构(EF—手性结构),从而提高信息处理的灵活性和特异性,在植物中形成复杂的信号网络.
CDPKs在植物生长发育、钙信号传导以及气孔运动等生理过程中起重要调控作用.CDPKs的C末端类钙调素结构域,即与钙离子结合的EF—手性结构的调控域[13].在植物免疫研究较多的就是其与14-3-3蛋白(真核生物中一类高度保守的调控蛋白)互作从而发挥调控功能.拟南芥CPK3是钙依赖性Ser/Thr蛋白激酶(CDPKs或CPKs)植物家族中的一员,在鞘脂类分子的前体长链基团(long chain bases,LCBs)介导的细胞死亡中起关键作用[14].Lachaud et al[14]研究证明,植物鞘氨酰亚胺(phytosphingosine,PHS,LCBs中的一类)诱导钙依赖性激酶CPK3的活化,使与之结合的14-3-3蛋白磷酸化,直接导致复合物的破坏和CPK3的降解,调控细胞死亡.CaM具有4个Ca2+结合区,Ca2+结合至CaM诱导构象从封闭状态变为开放状态,促进疏水和静电作用以及目标肽的两通道螺旋相互作用,从而激活或抑制目标蛋白的活力发挥免疫调控作用[17-19].钙信号被Ca2+传感器蛋白钙调蛋白(CaM)解码,并被转导到Ca2+/CaM复合物结合转录因子,直接调控植物适应反应所需的基因表达[20].CML与CaM具有很高的同源性,但在结构上又存在差异.同理,CML也是与蛋白结合从而调控植物生理过程和免疫反应.CBL含有结合Ca2+的4个变异程度不等的EF手臂 (EF-hand),但是在植物体内EF-hand如何与Ca2+结合目前还未十分明确.Albrecht et al[21]研究表明,拟南芥钙调磷酸酶B类钙感受蛋白(AtCBLs)与丝氨酸-苏氨酸蛋白激酶(AtCIPKs)以钙依赖的方式相互作用,但不同AtCBLs与AtCIPKs相互作用存在差异.不同的相互作用亲和力是在植物细胞内产生钙信号的特异性机制之一.不同的CBL-CIPK蛋白组合形成复杂的信号传导网络,将各种细胞外信号传入细胞进而引发特定的细胞反应.
综上所述,Ca2+感受器通常与Ca2+结合,与目标蛋白质互作激活多种酶并调节酶的活力,将信号传导至下游从而激活下游免疫应答,进而达到调节植物生长发育和预防外界干扰等目的.Ca2+感受器的相关研究近年来越来越受到人们重视,其在植物免疫领域有较大的研究潜力.
2 植物钙信号参与的非生物胁迫响应
2.1 钙参与低温胁迫响应
选育抗旱抗冻品种是农业生产的重要方向,低温胁迫对粮食作物产量和品质有直接影响,因此探究钙参与的低温胁迫响应具有重大意义.早在1985年,Minorsky[22]便提出关于植物冷害的启发式假说,推测寒气诱导的细胞内游离Ca2+浓度的提高是植物冷害的主要信号.随后,Monroy et al[23]于1993年利用CaM抑制剂W7和Ca2+通道抑制剂La3+研究证明在冷驯化过程中,Ca2+和蛋白磷酸化分别参与低温胁迫响应或二者相结合形成钙结合蛋白,在获得低温耐受性过程中起重要作用.2014年Nawaz et al[24]对水稻中的CNGC家族(16个CNGC基因)进行了全基因组鉴定,结果表明,在低温胁迫下有10种OsCNGCs表达上调.Liu et al[25]研究表明,冷活化的质膜蛋白冷响应蛋白激酶1(cold-responsive protein kinase 1,CRPK1)可以使14-3-3蛋白磷酸化,磷酸化的14-3-3蛋白从胞浆穿梭到细胞核,调节CBF(C-repeat binding factor,一类植物抗寒转录因子)的稳定性,确保植物对冷胁迫的响应.在此过程中,钙调素结合转录激活因子3(CAMTA3)对CBF的表达具有正向调控作用.此外,在拟南芥中已经发现了2个钙渗透机制敏感通道,MCA1和MCA2介导Ca2+吸收.2018年Mori et al[26]研究证明了MCA1和MCA2参与冷诱导的中胞浆Ca2+浓度升高.尽管Ca2+参与的抗寒胁迫机制复杂且尚未明确,但可以肯定钙信号对植物抵抗寒害冻害具有极其重要的作用,其中包括调控CNGCs通道信号传导以及钙渗透机制敏感通道MCA1和MCA2的活性.
2.2 钙参与盐胁迫响应
盐胁迫与低温胁迫都能使Ca2+内流穿过质膜和胞内钙库释放,从而增加胞浆中游离的Ca2+.为探究NaCl诱导的Ca2+通道与低温诱导的通道是否存在区别或交叉作用,Wang et al[27]证实了盐和低温能够提高Ca2+通道的渗透性从而使Ca2+浓度升高,并且在同时施加盐和低温联合刺激时,观察到相加效应.此外,还证明了由NaCl和低温诱导的Ca2+浓度的升高是独立发生的,每种处理可能激活不同的Ca2+通道,但NaCl或冷应激反应与两种应激刺激的钙信号通路存在反馈抑制(图2),并且这些信号通路之间存在相互作用.盐胁迫和低温胁迫是否能够激活相同的Ca2+通透目前尚未有定论.Yuan et al[28]研究表明,当植物受到高盐胁迫,诱导脱落酸(ABA)积累增加,cGMP(环磷酸鸟苷)快速积累,激活CNGC通道和OSCA1通道,高渗性特异诱导的OSCA1受损可能导致胞浆Ca2+浓度的升高,OSCA1的表达促进Ca2+内流响应浆膜Ca2+高渗透响应.另外,拟南芥MID1互补活性1和2蛋白(MCA1和MCA2)与酵母激活的Ca2+通道MID1具有同源性,介导低渗透压诱导的Ca2+浓度升高和机械反应[27].2019年,Jiang et al[29]在Nature上发文阐明植物细胞表面的糖基肌醇磷酸神经酰胺(glycosylated inositol phosphorylceramides,GIPC)感知盐胁迫后与Na+结合,触发内流的盐敏机制.试验分离得到由Ca2+诱导的细胞内Ca2+浓度升高的缺陷型突变体(moca1),并证明MOCA1(浆膜中GIPC鞘磷脂的葡萄糖醛酸基转移酶)是盐诱导细胞表面电位去极化、影响Ca2+浓度瞬变、Na+/H+逆向转运激活以及植物生长发育调节所必需的物质.植物在大田生育期内往往受到各种逆境胁迫,且胁迫往往不是单独发生,联合刺激使得植物必须进化出一套更高级的防御机制以适应多变的生存环境.
2.3 钙参与干旱胁迫响应
气孔是植物表皮所特有的结构,是植物体与外界环境直接相联的通道,也是植物体内水分蒸发的主要途径.气孔由一对特化的植物表皮保卫细胞形成,脱落酸(ABA)是调节气孔运动的重要因子.近年来,有学者对植物保卫细胞在细胞内钙信号特异性传导方面的作用提出了一种猜想,即CO2和ABA增强了下游钙信号传导过程中的钙敏感性[30].当ABA激活保卫细胞后,引发胞内Ca2+可渗透性和敏感性增加,致使Ca2+内流,从而调节气孔运动.活性氧(ROS)也能够激活保卫细胞胞浆膜内Ca2+通道[31,32].Garcia-Mata et al[33]还发现ROS同时促进NO和PIP3信号通路调节胞内Ca2+浓度以响应ABA.研究表明,ABA无法实现在所有细胞中诱导胞内Ca2+浓度升高,早在1994年Allan et al[34]就提出ABA信号网络中存在独立的Ca2+调控机制.随后,Harper et al[35]证明钙依赖性蛋白激酶(CDPKs或CPKs)通过结合同一多肽中的Ca2+和激酶活性作为传感器应答,也被确定为Ca2+依赖的ABA信号的正调控因子[36,37].Cheong et al[38]于2007年提出钙调磷酸酶B类蛋白(CBLs)是Ca2+依赖的ABA信号的负调控因子,其通过与Ca2+结合,和CBL相互作用的蛋白激酶(CIPKs)调节其活性.此外,Cheong et al[38]通过萎蔫试验验证,拟南芥cbl1cbl9双突变体具有更强耐旱性,并证明双突变体的气孔关闭反应对ABA敏感.已有研究表明[39],植物钙信号除了调节气孔运动以外,可能还在提高水分利用率等途径中参与植物抗旱能力的调控.
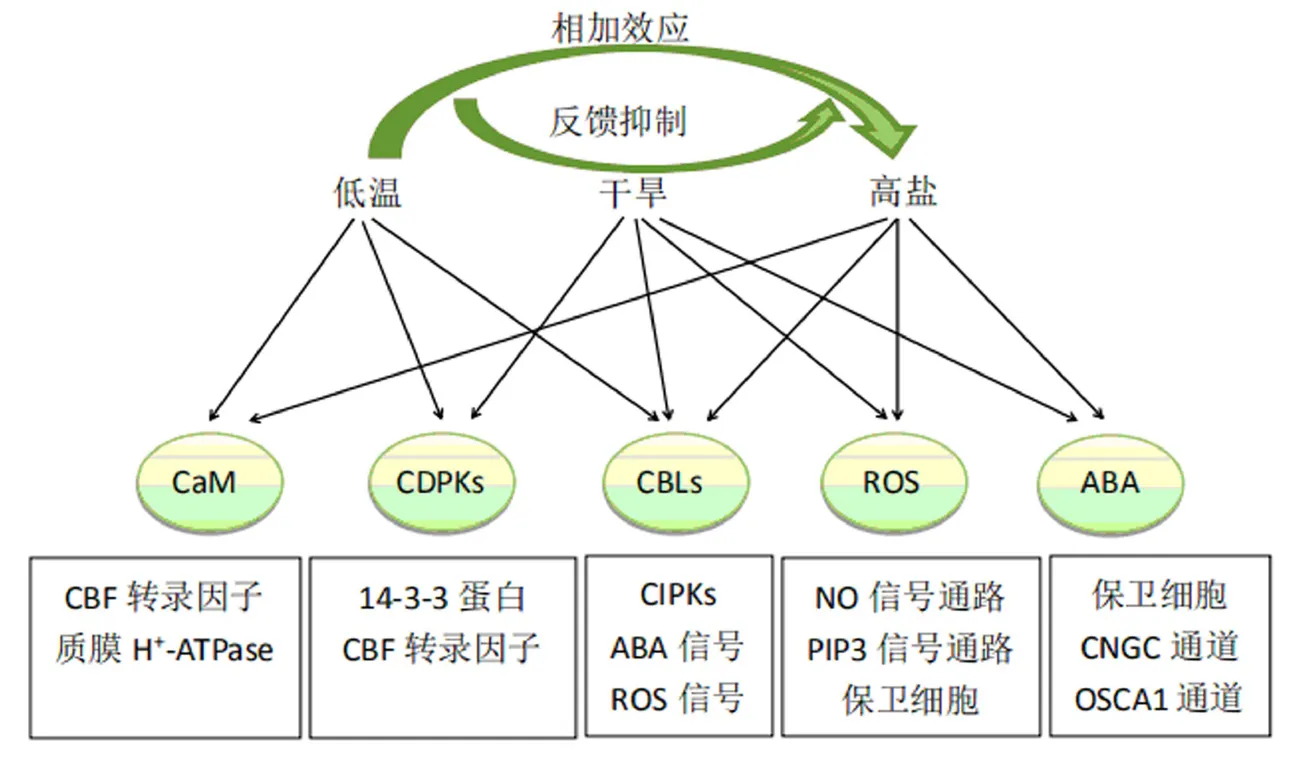
图2 植物在逆境胁迫中的钙信号传导途径Fig.2 Calcium signaling pathway in plants under stresses
3 Ca2+对植物细胞程序性死亡(PCD)的调控
细胞程序性死亡(programmed cell death,PCD)有利于维持生物体内环境的稳定,是植物免疫的重要组成部分.超敏反应(hypersensitive response,HR)与ETI相关,是指植物细胞直接接触或接近病原体时迅速死亡,是植物细胞程序性死亡的一种形式,也是植物最直接且有效的防御方式之一[6].目前对动物细胞的研究中已知有3条调控细胞凋亡的主要信号通路,即线粒体通路、内质网通路和死亡受体通路.一系列研究表明,Ca2+参与这3条信号通路.目前,线粒体在Ca2+调节的细胞死亡的中心功能已被确定.Ca2+介导的线粒体膜透性转变,被认为是细胞色素C释放和细胞凋亡中caspases激活的重要机制[40].此外,Kadenbach et al[41]在2003年提出:细胞质Ca2+的积累会导致线粒体中的蛋白磷酸酶被钙激活,从而促使膜间隙中细胞色素氧化酶发生可逆的脱磷酸化,膜电势降低,激活半胱氨酰天冬氨酸蛋白酶(cysteine aspartic acic specific protease,caspases),诱导细胞凋亡等.目前研究认为内质网是维持细胞钙稳态的主要部位,反之,游离的Ca2+对内质网的多种功能产生影响.
近年来,越来越多的研究发现植物细胞凋亡与动物细胞凋亡有许多相似之处,如一些用来控制后生动物细胞死亡的细胞死亡调节因子也可以在植物中发挥作用[42,43],如动植物细胞中都存在的Bax蛋白,是一种促凋亡的B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)家族成员,其通过在线粒体外膜上定位导致细胞色素C的释放,从而激活caspases,最终导致细胞生存所必需的蛋白质的分裂.此外,有研究表明[43],来自烟草的NbCA1(一类Ca2+-ATPase)是病原体和诱导剂诱导的PCD的重要调节因子,细胞Ca2+通量也参与其中.Ishikawa et al[43]提出在钙信号传导抑制细胞死亡的早期阶段,植物BI-1(Bax抑制剂-1BCL2-Associated X-1)是常见的细胞死亡抑制剂,内质网上的跨膜蛋白可能直接参与Ca2+通过内质网膜的转运.Boursiac et al[44]提出空泡Ca2+泵本身的丢失不会造成离子稳态的缺陷,反而增强了SA(水杨酸)依赖的程序性细胞死亡途径的激活,这是液泡Ca2+泵的控制依赖于SA植物细胞程序性死亡途径.
4 未来农业生产中的Ca2+研究潜力
近年来生态问题逐渐引起人们重视,生物多样性锐减,植物的生存受到威胁,农业生产面临巨大挑战.植物免疫生物学机理研究对于解决这些问题具有重要的指导作用,因此研究植物免疫具有重要意义.作为动植物通用的第二信使,胞浆Ca2+的浓度变化响应广泛.植物在低温、干旱和盐等逆境胁迫下通过Ca2+感受器、Ca2+通路激活蛋白、激素和特异功能的细胞进行下游免疫信号的传导,其作用范围广泛,调节机制复杂.未来可通过突变体或CRISPR/Cas9基因编辑技术等途径鉴定出更多相关的信号成分,定位这些信号成分在Ca2+信号网络中的位置,解析其在生物和非生物逆境胁迫响应中的作用机制,达到快速高效改良植物抗逆性和提高植物免疫能力的目的.
