一株芘降解菌的分离鉴定
2020-11-23吕亚辉黄友良陈泽雄李嘉琳黄泽民黄赛花吉喜燕
吕亚辉,黄友良 ,陈泽雄,李嘉琳,黄泽民,黄赛花*,吉喜燕
1.广东省科学院生态环境与土壤研究所/华南土壤污染控制与修复国家地方联合工程研究中心/广东省农业环境综合治理重点实验室,广东 广州 510650;2.广东益地农业科技有限公司,广东 广州 510000;3.佛冈沃土农业科技有限公司,广东 清远 511699;4.上海应用技术大学生态技术与工程学院,上海 201418
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是煤、石油、木材、烟草、有机高分子化合物等有机物不完全燃烧产生的挥发性碳氢化合物,是环境中重要的持久性有机污染物(Gbeddy et al.,2020;Yin et al.,2018),含有两个或以上的闭合苯环,具有强疏水性、高脂溶性、难降解性等特点,容易在土壤中大量累积,造成严重污染(Wang et al.,2020;Vagge et al.,2018),PAHs污染土壤的修复已经成为亟待解决的重要环境科学问题。
微生物修复以高效、价廉、环境友好、无二次污染等特点,受到一致肯定(Yang et al.,2020;Li et al.,2019)。目前能降解双环或三环的PAHs降解菌主要有:气单胞菌(Aeromonas)、芽孢杆菌(Bacillus)、拜叶林克氏菌属(Beijerinckia)等多种细菌和白腐真菌(whiterotfungi)。一般地,降解四环及以上的高环 PAHs的细菌主要集中在Mycobacterium(分支杆菌属)、Rhodococcus(红球菌属)、Pseudomonas(假单胞菌属)这3个属,而降解高环 PAHs的真菌,报道较多的是白腐真菌(Canet et al.,2001)。白腐真菌因为其强大的木素降解酶系具有强大的氧化能力和底物无特异性等特点而受到一致关注(班巧英等,2020)。有研究发现菲、蒽和荧蒽在初始质量浓度为 5 mg·L-1和 10 mg·L-1时白腐真菌乳白耙齿菌F17(Irpexlacteus)降解率分别达93%、85%和73%以上(刘俊,2019)。并且真菌特有的菌丝结构可穿透土壤颗粒,与土壤紧密裹抱在一起,从而增大与PAHs接触的面积,改变PAHs的生物可及性而提高其降解效率。所以充分利用土壤降解真菌的修复功能,是一类低耗高效和环境安全的生物修复技术(伍凤姬等,2014;张灿灿等,2020),而筛选、分离高效降解PAHs的真菌菌株则是该项技术的关键环节,不但能扩充PAHs降解霉种库,还能为PAHs污染的生物修复提供资源。
芘(Pyrene)是含有4个苯环、高度对称的稠环芳烯,常被作为PAHs污染的指示物和降解的研究对象(Ren et al.,2016;Liu et al.,2020)。本论文以芘为污染研究对象,采集施用蚯蚓粪的土壤,利用芘从低浓度到高浓度连续驯化20 d后,从中筛选分离并鉴定芘降解霉菌,并以黄胞原毛平革菌(Panerochaetechrysosporium)为参照对比其降解率,以其为PAHs污染的生物修复提供菌种资源。
1 材料与方法
1.1 主要仪器
显微镜,分光光度计北京普析UV-2000,恒温培养摇床HZC-250,生化培养箱LRH-250-A,色谱—质谱联用仪(岛津GCMAS QP2010 Plus)等。
1.2 培养基配方
PDA培养基:土豆浸出物 200.00 g·L-1,葡萄糖 20.00 g·L-1,琼脂 15.00 g·L-1。
液体培养液:在Tien et al.(1988)的配方的基础上稍加改良:其中用质量浓度为 0.02 mol·L-1的乙酸缓冲液(pH=4.4)代替丁二酸二甲酯缓冲液。其中葡萄糖10.00 g·L-1,KH2PO42.00 g·L-1,MgSO4·7H2O 0.25 g·L-1,CaCl20.10 g·L-1,酒石酸铵0.50 g·L-1(C4H12N2O6),微量元素 10.00 mL·L-1,微量元素的组成(L-1):
MnSO40.50 g,NaCl 1.00 g,FeSO4·7H2O 0.10 g,COCl20.10 g,ZnSO4·7H2O 0.10 g,CuSO40.10 g,AlK(SO4)212H2O 0.01 g,Na2MoO4·2H2O 0.01 g。
接种前无菌过滤加入维生素B1(VB1)溶液,使得最终VB1的质量浓度为5.00 mg·L-1。
无机盐固体培养基:在上述液体培养液中添加15.00 g·L-1的琼脂即可。
察氏培养基配方:蔗糖30.00 g·L-1,NaNO33.00 g·L-1,K2HPO41.00 g·L-1,MgSO4·7H2O 0.50 g·L-1,KCl 0.50 g·L-1,FeSO4·7H2O 0.01 g·L-1,15.00 g·L-1琼脂。
麦芽汁培养基配方:20.00 g·L-1麦芽浸膏,1.00 g·L-1蛋白胨,20.00 g·L-1葡萄糖,15.00 g·L-1琼脂。
察氏酵母培养基配方:K2HPO41.00 g·L-1,查氏浓缩液 10.00 ml·L-1,酵母抽提物 5.00 g·L-1,蔗糖 30.00 g·L-1,15.00 g·L-1琼脂。
1.3 试剂和对照菌株
所有药品均为常用无机及有机生化试剂,购自广州化学试剂厂,全部为分析纯;P.chrysosporiumBKM-F-1767(GIM3.383),购自广东省微生物研究所菌种保存中心的冻干粉。
1.4 芘降解菌的驯化
选取以猪粪为原料生产的蚯蚓粪(由佛冈沃土农业科技有限公司提供),施入土壤2 d后取样约500 g,含水量约50%,将其平摊于托盘中,均匀喷施芘的丙酮溶液20 mL,搅拌均匀后,在通风厨放置2—3 h以便丙酮挥发干净后,生化培养箱28 ℃避光培养,连续驯化20 d。芘的质量分数和喷施时间:第 1天 25 mg·kg-1,第 4天 50 mg·kg-1,第 8天100 mg·kg-1,第 15 天 200 mg·kg-1。
1.5 分离
称取已驯化好的蚯蚓粪土壤10.00 g,放入90.0 mL无菌水中,摇床振荡15 min后,放置30 s后,取0.10 mL涂布到无机盐固体培养基上,然后用升华法在培养基上形成芘膜,28 ℃遮光培养,选取芘膜平板上周围有透明圈、生长良好的真菌用PDA培养基平板画线,多次纯化后的菌种斜面保存,并做进一步的鉴定和芘降解能力的测定。
芘膜成膜方法:把接种后的平板倒扣到底部平铺有固体芘的烧杯上,并用封口膜将接口处封严,将烧杯底部放到电炉上稍加热,在平板上方放置冰块,使芘升华后遇平板冷却而附着在固体培养基上(图1)。
1.6 鉴定
1.6.1 平板观察
制作察氏、察氏酵母、麦芽汁培养基平板,利用灭菌接种针蘸取少量的孢子,点植于平板的中央点位置,25 ℃培养5 d,观察菌落的生长特征。
1.6.2 显微观察
于载玻片上点滴生理盐水1滴,用解剖针挑取少许孢子均匀分散涂抹于生理盐水中,于显微镜下观察其形态特征。
1.6.3 分子鉴定
提取菌丝 DNA,利用 ITS1通用引物(5′-TCCGTAGGTGAACCTGCCG-3′) 和 ITS4 ( 5′-TCCTCCGCTTATTGATATGC-3′)扩增ITS序列,并进行PCR产物的纯化和克隆,送由上海生物工程公司完成测序,测序结果经DNAMAN软件去除载体后,把所得的ITS rDNA序列提交到GenBank数据库,利用Blast工具进行序列比对,比对同源率。
1.7 芘降解能力测定
1.7.1 一级种子的制取
选取在PDA培养基上28 ℃培养7—10 d的真菌孢子,用无菌勺轻轻刮下平板表面的孢子,置于含有 100 mL无菌无机盐培养液的三角瓶中,160 r·min-1,28 ℃培养3—5 d,待孢子球长至直径约2 mm左右,即将进入快速生长期,备用。此为一级种子。

图1 芘膜成膜前后的对比Fig.1 Photos showing before and after the formation of a pyrene film on the plate
1.7.2 实验设计
选取50 mL三角瓶,除空白外每瓶接入5 mL一级种子(5 mL一级种子的菌丝干质量0.0112 g),液体培养基20 mL,加入芘的甲醇溶液(甲醇的加入量很少,对菌丝的影响可忽略不计),约5 mg·L-1左右,以 GCMAS上机检测结果为准(回收率为87.7%—91.2%),置摇床上28 ℃、160 r·min-1培养,并在接种的第0、8、14、23、30天取样,每次取3个平行,以相同体积芘的甲醇溶液的液体培养基作为空白对照。取样后用滤纸和烧杯过滤菌丝球,并用丙酮5 mL分两次洗涤滤纸和菌丝球,滤纸及其菌丝球一并转入已称至恒质量的烧杯中;80 ℃烘至恒质量,测量菌丝干质量;滤液用于测定芘的浓度。
1.7.3 芘的测定
滤液转入分液漏斗中,用6 mL环己烷洗涤烧杯,洗涤液一并加入分液漏斗中,振摇萃取2 min,静置分层;用25 mL的容量瓶收集上层环己烷并加入10 g烘干的无水硫酸钠去除多余的水分,下层水相依照以上方法用环己烷反复萃取3次,收集的环己烷定容至25 mL,摇匀。移取1 mL至2 mL的密封棕色瓶中,加内标10 μL六甲基苯和10 μL氘代芘,利用GCMAS对有机相中的芘含量进行测定,平均回收率为89.4%。
色谱条件:进样口无分流模式,进样口温度为270 ℃;色谱柱型号为DB-5弹性石英毛细管色谱柱(30 m×0.25 mm×0.25 μm);柱流量 1.65 mL·min-1;炉温55 ℃保持1 min,以25 ℃·min-1升至200 ℃,再以10 ℃·min-1升至240 ℃保持0.5 min,最后以30 ℃·min-1升至280 ℃,并保持2 min。
芘去除率=(芘初始质量浓度-芘剩余质量浓度)/芘初始质量浓度×100%。
统计分析软件SPSS 20。
2 结果与讨论
2.1 培养特征和孢子特征
霉菌在察氏培养基上生长迅速,菌丝蔓延呈稀薄絮状,菌落白色,毛状,反面无色(图2a);在察氏酵母培养基上呈毛絮状,菌落生长比在察氏培养基上生长旺盛,菌丝呈白色偏淡黄色,5 d生长高度离培养皿盖很近,分生孢子囊后期呈白色(图2b);在麦芽汁培养基上呈毛状,淡黄色,比在察氏酵母培养基上生长更旺盛,菌丝也更浓密,反面淡黄色,5 d菌丝生长高度能触碰到皿盖,与平板结构紧密,用接种针或玻棒很难挑起菌丝,触碰即匍匐倒下,与平板连接紧密(图2c);分生孢子囊后期呈黄色,孢子囊梗直接由菌丝体生出,单轴式总状分枝,孢子囊着生在囊梗上,孢子球形、圆形、椭圆形(图2d)。
2.2 测序结果
该菌的 ITS序列共 612 bp,与卷枝毛霉菌(Mucorcircinelloides)的同源性达99.3%,其培养特征及显微特征与卷枝毛霉菌(M.circinelloides)最相似,命名为M.circinelloidesH3。菌种已经交由中国微生物菌种保藏管理委员会普通微生物中心(CGMCC)保藏并已向国家知识产权局申请了专利,保藏号是11578,专利号是ZL201511033977.4。
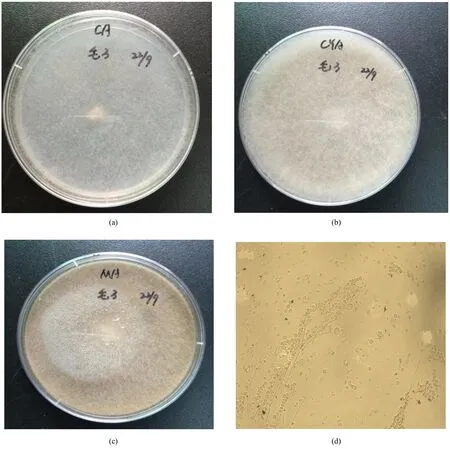
图2 真菌的培养特征和孢子的形状Fig.2 Colony and spore morphologies of H3.
2.3 系统发育树
采用 MEGA及 ClustalX1.38等分析软件对序列进行同源性分析,以邻接法构建系统发育树,图3是M.circinelloidesH3的系统发育树。
2.4 M.circinelloides H3对芘的去除率
以未接种菌种的芘液体培养液为空白对照,比较了M.circinelloidesH3和P.chrysosporium在30 d之内的芘降解能力(图4a、b),从图4a可以看出,H3在 8 d时芘的去除率为 74.5%,比P.chrysosporium的64.9%高了9.6%;14 d去除率为93.6%,比P.chrysosporium高了38.0%;23 d去除率为94.1%,比P.chrysosporium高了26.3%;30 d去除率为96.0%,比P.chrysosporium高了22.6%。P.chrysosporium因能分泌特殊的木质素降解酶而具有强大的降解 PAHs的能力(Li et al.,2018;Voberkova et al.,2018;Huang et al.,2020),但在本实验中同一实验条件下分离菌M.circinelloidesH3比P.chrysosporium具有更高的去除率。这可能是,(1)卷枝毛霉将芘转化为脂肪酸。卷枝毛霉是常见的产油微生物,大部分的微生物都不能在其细胞内积累超过自身干质量20%的油脂,而产油微生物却能积累20%—80%的油脂,其产油机制是在具有充足的芘作为碳源,而其他营养元素(氮、磷、硫等)缺乏时,微生物不再进行细胞繁殖,而是将过量的碳源转化为脂肪酸储存于细胞体内(Wu et al.,2010,2011)。(2)卷枝毛霉产生油脂增溶芘,提高降解效率。由于油脂和芘具有相似的结构,二者“相似相溶”,油脂产生了类似于表面活性剂的作用,促进了芘的溶解,提高了酶促转化效率(许学峰等,2018)。至于酶的具体降解机理,有待进一步的研究。
图3 系统发育树Fig.3 Phylogenetic tree of M.circinelloides H3
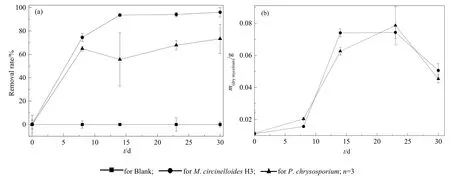
图4 M.circinelloides H3对芘的去除率和菌丝干质量变化曲线Fig.4 Pyrene removal by M.circinelloides H3
统计分析显示H3的芘浓度和菌丝生长量显著相关(P=0.008,P<0.05),从图4b可以看出,M.circinelloidesH3在培养的0—8 d,菌丝增长缓慢,推测培养液中的较高浓度的芘对菌丝生长存在抑制作用;8—14 d,M.circinelloidesH3和P.chrysosporium的菌丝均进入快速生长期,并于第23天分别达到菌丝干质量最大值0.0743、0.0786 g,表明此时菌丝已经适应了环境中芘的浓度,且伴随着菌丝的快速生长带来芘浓度的快速下降;30 d的菌丝干质量比23 d又下降,这是培养后期菌丝产生自溶所致。从图4a可以看出,P.chrysosporium在第14天比第8天的芘浓度还高,由于8 d前芘的去除主要以生物吸附为主,且菌丝达到最大吸附量,8—14 d发生生物解吸,且生物解吸量大于生物吸附量,导致溶液中芘浓度的上升;而在推测23—30 dP.chrysosporium应该产生了降解酶,其对芘的降解量大于解吸量,因此去除率较高。但是M.circinelloidesH3由于其具有储存和产生油脂的作用,具有增溶芘的作用,从而加快芘的降解,导致对芘的消耗量大于解吸量,使芘溶液一直处于下降阶段,因此,对芘的去除率显著高于P.chrysosporium。
据报道,Agrawal et al.(2017)研究Coriolopsis byrsinastrain APC5降解芘中,当初始质量浓度为20 mg·L-1,培养 18 d降解率为 96.1%;Mycobacteriumspp.PO1和PO2降解初始质量浓度为 100 mg·L-1时;6 d降解率达到了 100 %(Wanapaisan,2018);KlebsiellapneumoniaPL1在降解芘初始质量浓度为 20 mg·L-1,10 d降解率为63.4%(Ping et al.,2014);Bacilluscereus降解50 mg·L-1时,21 d降解率达到了 65.8%(蔡丽希,2018)。本研究M.circinelloidesH3降解芘初始质量浓度为 5.00 mg·L-1,摇床培养 30 d降解率为96.0%,由于培养基成分、培养条件的不同,其降解率差异较大。本去除实验用培养液是根据Tien的培养液改良而来,pH为4.4,是P.chrysosporium的最佳生长培养液,但M.circinelloidesH3在该培养液中菌丝干质量和降解率都比P.chrysosporium高。事实上,卷枝毛霉在环境pH为5—8时都能很好地适应(昝新艺,2019)。所以,进一步研究M.circinelloidesH3,发挥其在疏水类环境有机污染物的修复方面的积极作用,就显得意义尤为重大。
3 结论
通过驯化从蚯蚓粪土壤里分离出一株芘降解真菌,采用平板观察、显微镜检和分子比对等手段发现,该菌的培养特征及显微特征与M.circinelloides最相似,ITS序列与M.circinelloides的同源性达99.3%,鉴定该菌为卷枝毛霉,命名为M.circinelloidesH3。该菌30 d对芘的降解率达到96.0%,且能在pH 4.4的培养液中生长良好,是一株有巨大应用潜力的霉菌。
