增温和线虫添加对西双版纳热带雨林土壤呼吸的短期效应
2020-11-23周清秋李静雯王思敏吴彬陈辉邓云吴建平
周清秋 ,李静雯,王思敏 ,吴彬 ,陈辉,邓云,吴建平 *
1.云南大学/云南省植物繁殖适应与进化生态学重点实验室,云南 昆明 650500;2.云南大学生态与环境学院,云南 昆明 650500;3.北京师范大学生命科学学院,北京 100875;4.中国科学院西双版纳热带雨林生态系统研究站,云南 西双版纳 666303
人类活动造成大气CO2浓度持续增加,由此引发的气候变化及温室效应受到社会各界关注(Melillo et al.,2002;IPCC,2013)。土壤呼吸作为陆地生态系统碳循环的关键输出途径,主要以植物根系、土壤动物和土壤微生物的呼吸为主,释放出的CO2影响全球碳平衡及气候变化过程(Davidson et al.,2006;徐小锋等,2007)。土壤动物可直接影响土壤碳排放,或通过间接影响土壤微生物和植物生理活动调控土壤呼吸,对有机碳矿化起重要作用(王学霞等,2018)。
土壤线虫和微生物是陆地生态系统生物多样性的重要组分,在生态系统过程及对全球变化的响应中扮演了重要角色(邵元虎等,2007;陆雅海等,2015)。土壤线虫可调控土壤碳、氮等生物地球化学循环过程(Van den Hoogen et al.,2019)。食细菌线虫和食真菌线虫在捕食过程中会释放出CO2、NH4+及其它含氮化合物,对土壤的C、N矿化造成直接影响(邵元虎等,2007)。通过室内微宇宙实验发现,接种线虫后土壤CO2排放量有显著提高,且线虫对微生物生物量有明显的调控作用(Fu et al.,2005)。但是,增温背景下土壤线虫对微生物的调控及对土壤碳排放的影响研究还鲜有报道。
温度是影响陆地生态系统物质循环的关键环境因素,温度改变引起的诸多重要生理过程(如土壤生物生存动态及土壤养分循环)的变化,是全球气候变化的主要表现形式(Melillo et al.,2002)。温度升高加重土壤水分流失、改变土壤酶活性及热应激效应,使土壤线虫群落结构发生变化(Briones et al.,2009)。此外,增温通过调控植物根系碳输入和凋落物分解等途径间接改变土壤生物多样性,进而影响陆地生态系统功能和全球气候(Cowles et al.,2016;Daniel et al.,2017)。
热带森林土壤生态系统的结构和功能对气候变化较为敏感,研究全球变暖背景下热带地区土壤生物群落动态及其对土壤碳排放的影响具有重要意义(Malhi et al.,2004)。目前,增温对土壤生态系统影响的研究多集中在温带和寒带地区,在热带森林开展研究相对较少(Cavaleri et al.,2015)。因此,本实验通过研究增温和线虫添加条件下热带森林土壤呼吸速率和土壤微生物碳利用效率动态,探讨土壤呼吸对全球变暖和土壤生物互作的响应及其生物调控机制。
1 材料与方法
1.1 土壤样品采集
土壤样品采集于云南省西双版纳热带植物园(101°25′E,21°41′N)。该区海拔 570 m,年均温21.5 ℃,年均降水量约 1400 mm,属热带雨林气候,土壤类型为砖红壤。2018年8月,在20 m×20 m的研究样地内,每隔5 m设置一个取样点,每个取样点用直径5 cm土钻随机取5钻土,取土深度为0—10 cm。将5钻土混合成一个土壤样品,共采集10个混合土壤样品。土样带回实验室后,去除可见根系和石砾,过2 mm筛并测定土壤理化性质(见表1)。有研究表明,热带雨林中土壤微生物活动的最佳含水量为饱和含水量的 70%(Clarisse et al.,2019)。因此,本实验通过称质量和添加去离子水来维持此适宜含水量。

表1 供试土壤理化性状Table 1 Physico-chemical characteristics of Xishuangbanna tropical rainforest soil
1.2 实验设计
将过筛后的10个样品均匀混合,称取1000 g混合土置于容器中,摊成2—3 cm薄层,放入-26 ℃冰箱冰冻3 d,再转入生化培养箱于22 ℃下培养7 d,按此操作反复冻融5—7次。期间用浅盘法进行分离检验,直至去除土壤中所有活体线虫为止(毛小芳等,2004;周际海等,2017)。
本实验中添加的线虫为秀丽隐杆线虫(Caenorhabditiselegans),由云南省生物资源开发与利用国家重点实验室提供。此类线虫取食细菌,常被作为模式生物开展研究(周际海等,2017)。实验开始前,用0.1%硫酸链霉素和0.002%放线菌酮的混合消毒液对线虫进行杀菌,防止其表面微生物对实验产生干扰(李辉信等,2002)。准备30个500 mL的无菌玻璃瓶,每瓶称取30 g冻融土。根据该地区土壤线虫丰度,往线虫添加处理的培养瓶中加入20条杀菌后的线虫(Xiao et al.,2014)。在所有培养瓶盖子上开一个小口,接上 PVC管且连接三通气阀,用热熔胶密封以保证培养过程的密闭性,采气时打开三通气阀。
依据西双版纳年均温和IPCC报告预测的增温范围(1.1—6.4 ℃)(IPCC,2013),实验设置3个增温梯度,共计 30个独立培养瓶。线虫添加完毕后,关闭所有三通气阀,并将培养瓶分别放入21.5、24.5、27.5 ℃的恒温培养箱中。参照土壤生物通用培养研究方法(Treat et al.,2014),本实验将培养时间设置为30 d。具体实验处理为:
(1)处理一T21.5:21.5 ℃培养(CK)
(2)处理二T24.5:24.5 ℃培养
(3)处理三T27.5:27.5 ℃培养
(4)处理四 NeT21.5:21.5 ℃培养+线虫添加(20 条)
(5)处理五 NeT24.5:24.5 ℃培养+线虫添加(20 条)
(6)处理六 NeT27.5:27.5 ℃培养+线虫添加(20 条)
1.3 土壤呼吸和土壤微生物生物量碳测定
基于顶空CO2浓度随时间的变化计算土壤呼吸速率,培养和测量方法参照Chen et al.(2016)。初次测量之前,打开玻璃瓶瓶盖并放入通风橱对流 1 h。待瓶子中的气体浓度分布均匀后,用注射器抽取5 mL顶空气体在气相色谱仪上测定CO2含量,此为CO2初始浓度。为避免负压造成的潜在影响,抽取顶空气体后立即将5 mL无CO2空气注入瓶中。然后将所有玻璃瓶置于各自的设定温度下,48 h后,再次抽取5 mL顶空气体,以测算期间的CO2浓度变化值,此过程共重复3次。从实验的第7天起(即第3次抽气结束后),每隔5—8天测定1次CO2含量,即在实验开始的当天以及培养的第 2、4、6、11、16、23、30天分别对每个玻璃瓶进行抽气,依次记录为 D0、D2、D4、D6、D11、D16、D23、D30。最后1次抽气完成后,用氯仿熏蒸法测定土壤微生物生物量碳(Yao et al.,2000)。
1.4 统计分析
参照Wu et al.(2014)计算土壤CO2呼吸速率(Rt,μg·g-1·d-1),公式如下:
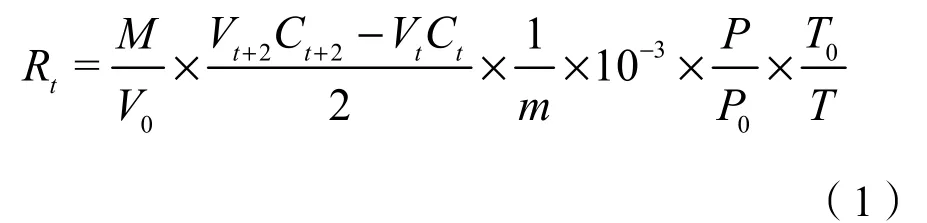
式中:M:CO2摩尔质量,44 g·mol-1;V0:气体体积常数,22.4 L·mol-1;Vt+2:测量当天培养瓶内气体体积(mL);Ct+2:测量当天培养瓶内CO2浓度(μg·g-1);Vt:培养瓶内气体初始体积(mL);Ct:培养瓶内 CO2初始浓度(μg·g-1);m:干土质量(g);P0:标准大气压,1013.25 hPa;P:测量时培养瓶内实际气压(hPa);T0:标准状态热力学温度,273.15 K;T:测量时实际培养温度(K)。
土壤呼吸累积量(Rc)的计算公式参照(王春新等,2017):

式中:Rc为测定时间内的土壤呼吸累积量(μg·g-1);Rt为测量时间内的土壤呼吸速率(μg·g-1·d-1);t为测量时间(d)。
土壤呼吸速率与温度间呈指数函数关系,通常用土壤呼吸的温度敏感性(Q10)来表示温度每升高10 ℃土壤呼吸速率增加的倍数。Q10的计算公式(毛小芳等,2004)为:

式中:Rt为土壤呼吸速率;θ为土壤温度;a、b为实际参数。
土壤微生物生物量碳(MBC)的计算公式为:

式中:ω(C)为微生物生物量碳(mg·kg-1);EC 为已熏蒸土样的可溶性有机碳含量与未熏蒸土样的可溶性有机碳含量差值(mg·kg-1);KEC为微生物体中碳被浸提出来的比例,一般定为0.38(陈国潮,2002)。
微生物碳利用效率(CUE)是衡量微生物群落新陈代谢能力的一个重要参数,其数值大小反映了微生物释放CO2的强弱程度(Spohn et al.,2016)。CUE的计算公式参考(Maynard et al.,2017):

式中:B为土壤呼吸测定结束后的微生物生物量碳含量(μg);R为土壤呼吸测定结束当天的测得的呼吸碳含量(μg)。
用单因素方差分析(One-way ANOVA)比较处理间差异性,处理间的主效应及交互效应用双因素方差分析(Two-way ANOVA)检验,用一元回归分析(Simple regression analysis)检验土壤温度、MBC和 CUE对土壤呼吸速率的影响,所有分析显著水平均设为P<0.05。统计分析和数据整合用Microsoft Excel 2016和SPSS 19.0完成,用Sigma Plot 12.5和Excel软件绘图。
2 结果与分析
2.1 增温和线虫添加对土壤呼吸的影响
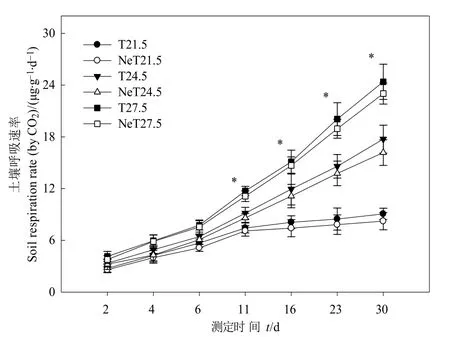
图1 增温和线虫添加对土壤呼吸速率的影响Fig.1 Effects of warming and nematodes addition on soil respiration rate
增温和线虫添加均显著影响土壤呼吸速率(P<0.05,图1)。在培养期内,6组处理的土壤呼吸速率均随培养时间呈明显上升趋势。从第 11天开始,T21.5、NeT21.5的土壤呼吸速率逐渐趋于平稳,其余处理仍呈明显上升趋势;相同温度下未添加线虫与添加线虫处理的土壤呼吸速率差异显著(P<0.05)。第11天时,T24.5、T27.5分别是T21.5的1.23倍和1.58倍;同一温度下添加线虫后土壤呼吸速率比未添加降低4.64%—5.96%。第30天时,T24.5、T27.5分别是T21.5的1.96倍和2.69倍;同一温度下添加线虫的土壤呼吸速率比未添加降低 5.59%—9.25%。
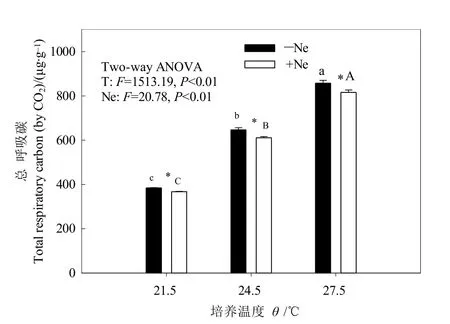
图2 增温和线虫对土壤总呼吸碳的影响Fig.2 Effects of warming and nematode on total soil respiratory carbon
增温和线虫添加对土壤总呼吸碳有显著影响(P<0.05),但二者交互作用不明显(图2)。增温使土壤总呼吸碳显著升高(P<0.05),T24.5、T27.5分别是T21.5的1.68倍和2.23倍。相同温度下,添加线虫后的土壤总呼吸碳比未添加线虫降低4.44%—5.43%。
2.2 增温和线虫添加条件下土壤呼吸的温度敏感性
用指数函数模型计算不同处理下Q10的变化。结果表明,土壤呼吸速率与土壤温度显著正相关(图3)。线虫添加条件下Q10显著提高(P<0.05),较未添加线虫处理升高5.98%。
2.3 增温和线虫添加对MBC和CUE的影响
增温、线虫添加、增温+线虫添加均对MBC有显著影响(P<0.05,图4a)。与T21.5相比,MBC在T24.5下提高8.50%,在T27.5下降低13.88%,线虫添加后显著降低15.57%—20.18%。相同温度下,MBC在线虫添加后显著降低7.31%—23.32%。
增温和线虫添加对 CUE均有显著影响(P<0.05,图4b),但增温与线虫添加处理间交互作用不明显。随着培养温度的升高,相同线虫处理的CUE均显著下降,未添加线虫降低 30.49%—55.90%,添加线虫降低36.16%—52.45%。相同温度下,添加线虫处理 CUE比未添加线虫处理降低2.37%—16.85%。
2.4 MBC和CUE对土壤呼吸的影响
将MBC和CUE与第30天的土壤呼吸速率进行回归分析(图5),结果显示CUE能显著影响土壤呼吸速率(P<0.05,图5a),且模型拟合度较高;而MBC与土壤呼吸速率相关性不显著(图5b)。
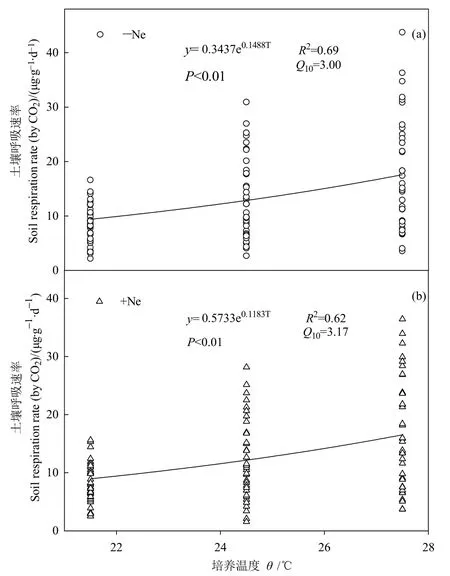
图3 线虫添加条件下温度对土壤呼吸速率的影响Fig.3 Effects of temperature on soil respiration rate under nematodes addition
3 讨论
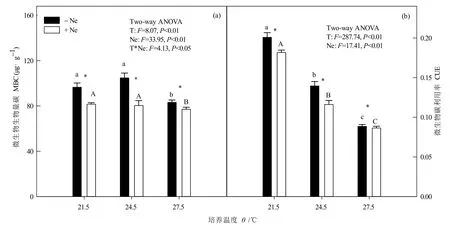
图4 增温及线虫添加对MBC和CUE的影响Fig.4 Effects of warming and nematodes addition on soil MBC and CUE
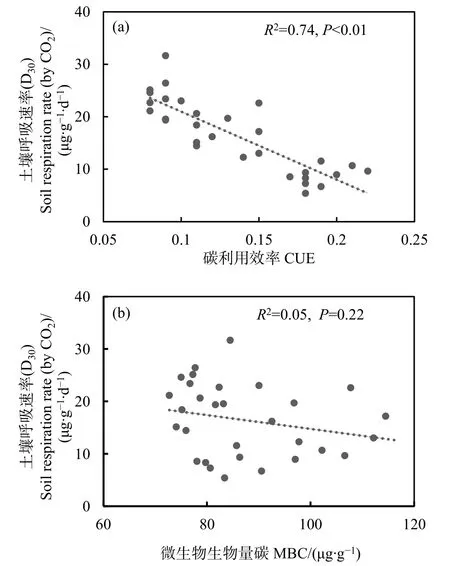
图5 MBC和CUE对第30天土壤呼吸速率的影响Fig.5 Effects of MBC and CUE on soil respiration rate of the 30th day
本研究中,短期增温显著提高土壤呼吸速率,这与增温可短暂增加土壤呼吸量的研究结果一致(Melillo et al.,2017;康静等,2019)。温度作为土壤呼吸速率的主要调控因子,增温可能直接加速微生物分解作用,促进CO2向大气中排放(Melillo et al.,2017)。相反,短期增温降低了CUE。较高的CUE表明土壤中有充足的有效底物供微生物进行自身固碳(Manzoni et al.,2012),而CUE下降则表明微生物同化的碳此时用于呼吸的比例增加,用于自身合成生物量的比例减少,从而促进土壤碳排放。添加线虫后,土壤呼吸速率明显下降,CUE下降趋势则更强,这可能由于微生物受线虫捕食导致数量减少(图 4)。土壤微生物以异养呼吸方式释放出的CO2量,通常能占土壤呼吸总量的一半以上(Bond-Lamberty et al.,2004)。线虫添加后可能大量取食微生物,导致微生物数量减少,土壤呼吸速率减慢。虽然线虫对土壤呼吸也具有一定贡献(Ingham et al.,1985),但不足以弥补因微生物减少而造成的土壤碳排放损失,说明线虫可能通过调控土壤微生物数量而促进土壤碳固定。
随着培养温度的升高,土壤微生物生物量碳呈现先上升后下降的趋势。当培养温度从 21.5 ℃升高至24.5 ℃时,微生物生长繁殖受到适度促进,总数量增加,微生物生物量碳含量增加;当温度继续升高至 27.5 ℃时,微生物数量却大幅减少。一方面,微生物对环境温度变化较为敏感,受增温刺激后生长势态和呼吸作用均会显著增强;另一方面,如果微生物处在未驯化阶段,加速变暖则可能使土壤中的有效底物耗尽,继而对微生物活动产生负反馈效应,微生物生物量则随之降低。Allison et al.(2010)发现微生物特性可间接影响土壤碳排放,通过降低增温样地中土壤微生物生物量来减弱土壤呼吸作用,有效弥补了因增温引起的土壤碳损失。线虫添加后,微生物量碳明显下降,除上述的受到线虫取食外,微生物生存可能还受到生存空间和资源的限制。线虫加入加快了有限资源的消耗,为适应环境,微生物群落组成或将变为生长和周转迅速的r-对策型微生物,而这类微生物生物量较低(周正虎等,2016)。
此外,随着温度升高,土壤呼吸作用增强,Q10也呈现出增大的趋势,这与以往研究结果一致(张彦军等,2019)。添加线虫后,土壤呼吸速率有所减缓,但Q10反而增大,造成这一结果的原因可能与线虫大量繁殖有关,土壤线虫丰度与温度有显著正相关关系(Ruess et al.,1999)。本研究选取的秀丽隐杆线虫是c-p值为1的食细菌线虫,此类线虫世代时间短,产卵量大,在食物富集条件下能快速繁殖(张晓珂等,2013)。线虫刚添加时,充足的土壤养分使其快速繁殖。此时微生物受线虫取食而数量减少,MBC含量明显下降,土壤呼吸速率也随之下降。由于线虫本身呼吸作用,所以线虫添加也贡献了一部分呼吸碳,因此Q10比无线虫处理略高。但由于本实验处理周期较短,受实验限制未能实时监测培养过程中线虫数量变化,且秀丽隐杆线虫的取食偏好在本实验中也未能明确。因此,未能定量分析线虫对土壤呼吸的贡献率,后续研究将从培养过程中线虫的数量动态和微生物群落结构进行补充验证。
4 结论
通过室内的短期增温和线虫添加实验,表明增温显著增强热带雨林土壤的呼吸作用。线虫添加后土壤呼吸速率减小,土壤呼吸的温度敏感性发生变化,且土壤微生物生物量碳随之减少,从而导致微生物碳利用效率下降,影响土壤碳吸存效应,最终可能调控生态系统对全球变暖的响应。
