基于DMSA自组装单分子层的SPR免疫传感器检测沙丁胺醇
2020-11-18李文杰王晨晨颜朦朦李慧冬丁蕊艳方丽萍王兰芝侯运华杨亲正陈子雷齐鲁工业大学山东省科学院生物工程学院生物基材料与绿色造纸国家重点实验室山东济南250353山东省农业科学院农产品质量标准与检测技术研究所山东济南25000山东省食品质量安全检测技术重点实验室山东济南25000山东师范大学生命科学学院山东济南25004
李文杰,王晨晨,颜朦朦,李慧冬,丁蕊艳,方丽萍,王兰芝,侯运华,杨亲正,*,陈子雷,4,*(.齐鲁工业大学(山东省科学院)生物工程学院,生物基材料与绿色造纸国家重点实验室,山东济南 250353;2.山东省农业科学院农产品质量标准与检测技术研究所,山东济南 25000;3.山东省食品质量安全检测技术重点实验室,山东济南 25000;4.山东师范大学生命科学学院,山东济南 25004)
沙丁胺醇(SAL)为瘦肉精的一种,添加微量沙丁胺醇于牲畜饲料内,可以增加牲畜的瘦肉量、减少脂肪。然而其残留会导致人体产生肌肉震颤、头痛、心悸等不良症状,因此在欧盟及中国的动物饲料中已被禁用[1-6]。现有测定SAL的方法很多,如酶联免疫吸附实验(ELISA)[7-9]、气相色谱-质谱法(GC/MS)[10-11]、高效液相色谱-串联质谱法(HPLC-MS/MS)[12-14]和串联质谱法(MS/MS)等[15-16]。然而这些方法大都需要昂贵的设备、熟练的技术人员和长时间的检测分析。因此,开发简单方便、快速灵敏、成本低廉、特异性高的分析方法已成为当前的迫切需要。
表面等离子体共振技术(SPR)最初主要通过光学上的折射率变化应用于监测大分子间的相互作用,如考察抗原-抗体、受体-配体、适配体-识别物之间的亲和力,随后广泛应用到小分子检测领域,其具有快速、无标记、灵敏度高的优点。SPR免疫传感器应用较为常见,其检测方法主要为抑制法[17-21]。定量的抗体与芯片表面的抗原结合时在SPR传感器上产生一个响应值。将这一定量的抗体与待测物混合,待测物会消耗掉一定的抗体。当混合物再与芯片表面作用时,通过计算SPR传感器降低的响应数值可以测算待测物的浓度。SPR免疫传感器研制中,抗原/抗体在SPR芯片上的固定是非常关键的一步。硫醇分子是一种包含巯基和羧基的双功能分子,通过巯基与金形成Au-S键,在金膜表面形成单分子层,有效减少蛋白质在金片上的非特异性吸附。同时,羧基通过碳二亚胺法与抗原/抗体中的氨基共价偶联,从而将抗原/抗体结合在具有基底金膜的芯片表面。作为连接分子,硫醇中羧基基团的密度极大的影响着抗原/抗体结合,进而影响传感器灵敏度和检测性能。近年来,研究人员通过引入了混合硫醇单分子层SAMs来调节表面羧基官能团的浓度,来解决抗原/抗体结合中的空间位阻问题。Gobi等[22]通过不含羧基(1-癸硫醇)和含有羧基(11-巯基十一烷酸)相混合的模式来改变空间环境。Tsai等[23]也提出混合连接体这一策略,通过变换化合物的链长(己硫醇和16-巯基十六烷基酸),以期达到良好的空间微环境。然而,这些混合模式虽然降低羧基密度,但有效的硫醇连接分子无法均匀分布,仍会导致抗原/抗体聚集不均匀,从而影响测试的灵敏度。
基于以上科学问题,本文提出用双巯基双羧酸的DMSA来代替传统的连接分子如单巯基单羧酸的MPA,以降低空间位阻及控制抗体的构型和取向。通过SEM、AFM、电化学等表征手段考察通过不同硫醇单分子连接抗原修饰后的SPR芯片的形貌,并通过考察连接抗原后的SPR芯片与抗体间的识别效率确定SPR免疫传感器的检测性能。
1 材料与方法
1.1 材料与仪器
SPR裸芯片 北京中龙益诚科技公司;巯基丙酸(MPA)、二巯基丁二酸(DMSA) Sigma-Aldrich;沙丁胺醇、莱克多巴胺、盐酸克伦特罗、盐酸马布特罗、西马特罗 BePure;1-乙基-(3-二甲基氨基丙基)羰基二酰亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS) 生工生物工程(上海)公司;乙醇胺盐酸盐 阿拉丁;K3[Fe(CN)6]、K4[Fe(CN)6]·3H2O、KNO3、KCl、三水合乙酸钠 国药集团化学试剂有限公司;沙丁胺醇-牛血清白蛋白偶联物(SAL-BSA)、SAL单克隆抗体(SAL-Ab) 深圳宝安康生物技术有限公司;猪肉 济南华联超市。
YC-SPR-A1表面等离子体共振仪 北京中龙益诚科技公司;CHI 760E电化学工作站 上海辰华仪器有限公司;Cary 5000紫外-可见分光光度计 安捷伦;JSM-6700冷场发射扫描电子显微镜 日本电子;Nano Scope-IIIa原子力显微镜 美国DI公司。
1.2 实验方法
1.2.1 传感器芯片修饰及检测原理 传感器芯片修饰过程如图1a所示,以MPA和DMSA作为自组装单分子层分别通过碳二亚胺法将沙丁胺醇-牛血清白蛋白偶联物(salbutamol hydrochloridbovine serum albumin conjugate,SAL-BSA)固定在SPR裸芯片表面。抑制法检测沙丁胺醇的原理如图1b所示,首先将待测物与抗体混合,当无沙丁胺醇时,抗体与芯片表面的抗原结合数量多,SPR的折射率强。当存在沙丁胺醇时,沙丁胺醇会消耗掉其中的部分抗体,SPR的折射率减小。SPR 的折射率随着沙丁胺醇浓度的不同而不同。
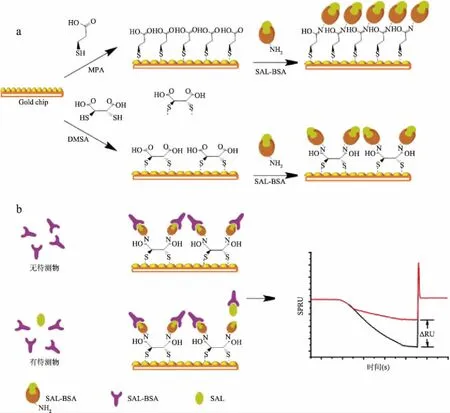
图1 原理图Fig.1 Schematic diagram注:a:以DMSA和MPA为SAMs的沙丁胺醇免疫传感器芯片的修饰过程;b:抑制法测试沙丁胺醇。
1.2.2 不同连接单分子对SPR裸芯片的修饰 将SPR裸芯片分别置于0.5 mmol/L MPA和DMSA溶液中,反应24 h。反应结束后,用乙醇和去离子水冲洗SPR芯片,并用氮气干燥。
1.2.3 沙丁胺醇抗原的组装 将1.2.2所制备SPR芯片置于400 mmol/L EDC和100 mmol/L NHS的溶液中,室温下反应30 min。反应结束后,用去离子水冲洗SPR芯片,并用氮气干燥。
用200 μL SAL-BSA溶液(1 mg/mL)涂覆上述处理的SPR芯片,并用乙醇胺溶液(1.0 mol/L,pH8.5)封闭未反应的活性位点,最后用PBS溶液冲洗,得到MPA-SAL-BSA和DMSA-SAL-BSA SPR芯片,在4 ℃下密封保存。
1.2.4 SAL-BSA修饰的SPR芯片活性考察 将不同浓度(12.5、25、50、75、100 μg/mL)的SAL-Ab PBS溶液分别泵入SPR反应池中与MPA-SAL-BSA和DMSA-SAL-BSA的SPR芯片反应,流速为100 μL/min,再生溶液为100 mmol/L NaOH,再生液流速为400 μL/min,再生时间为30 s,并记录表面等离子体共振仪的响应值变化。
1.2.5 SAL-BSA修饰的SPR芯片表征
1.2.5.1 电化学表征 SPR芯片为工作电极,铂(Pt)为对电极,Ag/AgCl为参比电极,在0.5~1 V电压范围内扫描20圈,扫描速率为100 mVs-1。以铁氰化钾溶液(5.0 mmol/L[Fe(CN)6]3-,0.1 mol/L KCl和0.1 mol/L KNO3)为探针溶液,通过循环伏安曲线(CV)表征MPA-SAL-BSA和DMSA-SAL-BSA芯片的电化学行为。
1.2.5.2 表面形貌表征 用SEM和AFM对MPA-SAL-BSA和DMSA-SAL-BSA SPR芯片的表面形貌进行表征。SEM仪器参数:二次电子像分辨率:1.0 nm(15 kV),2.2 nm(1 kV);背散射电子像分辨率:3 nm(15 kV,WD=8 mm);放大倍数:50000;加速电压:15 kV;电子束流:10-13~2×10-9A;数字图像采集系统分辨率:1280×1024。AFM仪器参数:空间分辨率:XY:0.2 nm,Z:0.1 nm;扫描分辨率:1024×1024 pixels;光谱分辨率:1 cm-1;纳米化学像空间分辨率10 nm;激光波段:950~1900 cm-1,2700~4000 cm-1。
1.3 沙丁胺醇的测定
1.3.1 沙丁胺醇抗体浓度的选择 将浓度为25 μg/mL的SAL-Ab和不同浓度的SAL标准溶液(5、10、20、30、40、60、80、100、150 ng/mL)等体积混合,在37℃条件下温育30 min,每个浓度重复测定3次,记录SPR仪的响应值变化。
1.3.2 实际样品添加回收 本实验所用猪肉用UPLC-MS/MS检测无沙丁胺醇。将不同浓度(5,10,20 ng/mL)的沙丁胺醇标准溶液加入到1 g猪肉空白样品中,静置1 h,然后加入10 mL乙腈,均质提取1 min,取1 mL上清液于5 mL离心管中,氮气吹干,再用2 mL正己烷溶解,然后加入1 mL PBS溶液,充分振荡均匀,并在85 ℃的水浴中温育3 min,收集底部液体作为测试液体,待测液体通过0.22 μm滤膜过滤,取250 μL用于SPR免疫传感器检测,并重复制备每种浓度,每种添加浓度水平重复3次。
1.3.3 样品的UPLC-MS/MS检测 取1 mL 1.3.2制备的提取液于5 mL离心管中,氮气吹干,再用2 mL正己烷溶解,然后加入1 mL甲醇溶液,充分振荡均匀,取甲醇部分溶液上机检测,并通过0.22 μm滤膜过滤,每种添加浓度水平重复3次。
1.3.4 UPLC-MS/MS检测条件 色谱柱:EclipsePlus C18 RRHD(100×2.1 mm,1.8 μm,Agilent);柱温:30 ℃;流动相条件:流动相A和流动相B分别为乙腈和0.1%甲酸-水溶液,比例为75∶25;洗脱程序:等度洗脱;流速:300 μL/min;进样量:5 μL。离子源:电喷雾离子源(ESI);扫描模式:正离子扫描,多反应监测模式(MRM);干燥气温度:350 ℃;干燥气流速:6 L/min;雾化器压力:35 psi;毛细管电压:4000 V;喷嘴压力:500 V;去簇电压:28 V;母离子(m/z):240.0;子离子(m/z):148.0*/222.0(*为定量离子);裂解电压(V):100/100;碰撞能量(V):15/5。
1.4 数据处理
以无待测SAL分子抑制的响应值为B0,一定浓度的待测SAL分子抑制时的响应值为B值,可计算抑制率:抑制率(%)=[(B0-B)/B0]×100,以SAL分子浓度C的对数log C为横坐标,以抑制率为纵坐标,用软件进行曲线拟合绘制标准曲线,每个样品三次重复(n=3)。
2 结果与分析
2.1 SAL-BSA修饰的SPR芯片活性考察
为了研究MPA-SAL-BSA芯片和DMSA-SAL-BSA SPR芯片上抗原/抗体结合的结合效率,以相同浓度的SAL-Ab流经SPR芯片表面产生的SPR信号响应值的变化作为判断标准。在SAL-Ab的浓度相同时,芯片的折射率差值即SPR信号响应值(ΔRU)越高说明芯片上SAL-Ab结合的数量越多。图2为MPA-SAL-BSA芯片和DMSA-SAL-BSA芯片在相同SAL-Ab浓度下的SPR信号响应情况,由图2可知,当SAL-Ab浓度同为75 μg/mL时,两芯片可结合的SAL-Ab的浓度已经饱和,此时MPA-SAL-BSA芯片和DMSA-SAL-BSA SPR芯片的折射率差值为58.8和115.6,这表明DMSA芯片在相同的实验条件下可以结合更多的SAL-Ab。
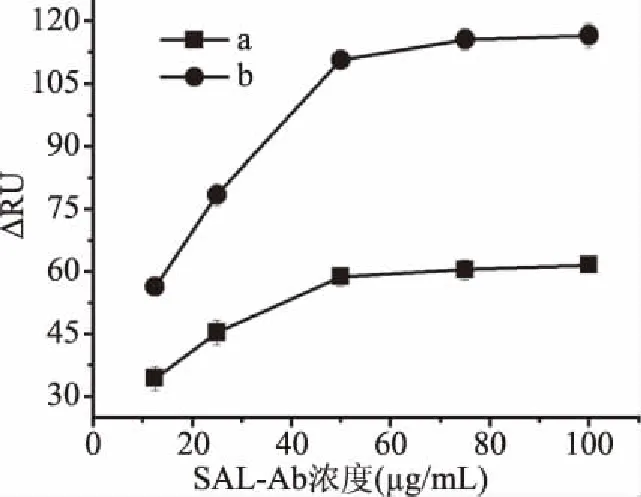
图2 在不同SAL-Ab浓度下芯片折射率变化 Fig.2 SPR index change of chip at different SAL-Ab concentrations注:a:MPA-SAL-BSA芯片SPR折射率变化情况;b:DMSA-SAL-BSA芯片的SPR折射率变化情况。
2.2 SAL-BSA修饰的SPR芯片表征
2.2.1 表面形貌表征 通过SEM和AFM对MPA-SAL-BSA和DMSA-SAL-BSA芯片进行了形貌表征。SEM结果(图3a~图3c)表明,DMSA-SAL-BSA芯片的表面均匀程度优于MPA-SAL-BSA芯片,这一结果进一步由AFM表征图证明,如图3d~图3f所示,裸芯片(图3d)的表面粗糙度Rq和Ra值分别为0.836、0.684 nm,MPA-SAL-BSA芯片(图3e)的表面粗糙度Rq和Ra值分别为2.09、1.66 nm,而DMSA-SAL-BSA芯片(图3f)的表面粗糙度Rq和Ra值分别为1.86、1.49 nm。因此,DMSA-SAL-BSA的芯片表面比MPA-SAL-BSA的更平整、更均匀。结合活性考察实验结果,推测MPA芯片性能不佳是由于芯片上的SAL-BSA分布不均匀,与SAL-Ab结合的活性位点相互阻隔,从而导致SAL-BSA和SAL-Ab结合减少。因此,DMSA能够改善抗原之间的空间微环境,进而提高抗原-抗体之间结合效率。

图3 SPR芯片形貌图Fig.3 SPR chip shape diagram注:a~c分别为裸芯片、MPA-SAL-BSA芯片、DMSA-SAL-BSA芯片的SEM图;d~f分别为裸芯片、MPA-SAL-BSA芯片、DMSA-SAL-BSA芯片的AFM图;SEM图放大倍数50000×;AFM图尺寸大小1×1 μm。
2.2.2 电化学表征 采用循环伏安法在铁氰化钾溶液中比较了不同SPR芯片的循环伏安特征。如图4所示,MPA-SAL-BSA芯片和DMSA-SAL-BSA芯片的氧化还原峰均小于裸芯片的氧化还原峰,表明SAL-BSA均修饰到芯片上,而MPA-SAL-BSA芯片的氧化还原峰大于DMSA-SAL-BSA芯片的氧化还原峰,说明MPA-SAL-BSA芯片表面的SAL-BSA不均匀,存在较大的间隙,提供了电子通道允许铁氰化钾离子通过溶液接触到芯片表面,提高了氧化还原峰的响应值,结合AFM结果,进一步说明DMSA-SAL-BSA芯片上的SAL-BSA均匀程度更高,充分利用了芯片表面的空间,阻碍了铁氰化钾离子与芯片表面接触。因此,DMSA作为连接分子效果优于传统的MPA连接分子。
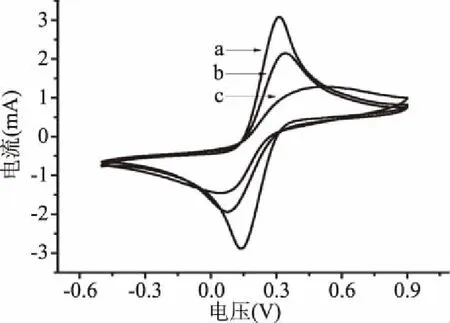
图4 SPR芯片的CV图Fig.4 CV of SPR chip 注:a:裸芯片CV图;b:MPA-SAL-BSA芯片CV图;c:DMSA-SAL-BSA芯片CV图。
2.3 沙丁胺醇测定
2.3.1 最佳抗体浓度的选择 在优化的实验条件下,考察了DMSA-SAL-BSA芯片检测沙丁胺醇实验中SAL-Ab的最佳浓度。从图5可以看出,当SAL浓度增大的情况下,SAL对SAL-Ab抑制率均增大。其中图5a的线性方程为:y=-0.0086x2+1.7883x+18.524(R2=0.912),图5b的线性方程为:y=-0.0054x2+1.471x-1.7194(R2=0.987),图5c的线性方程为y=0.0006x2+0.1862x+2.5692(R2=0.961)抗体浓度为25 μg/mL时,检测灵敏度最好。考虑到实验成本和检测灵敏度,将SAL-Ab浓度25 μg/mL作为反应浓度。数据点的相对标准偏差(RSD)在4%以内,并在图中显示为误差线(图5b)。
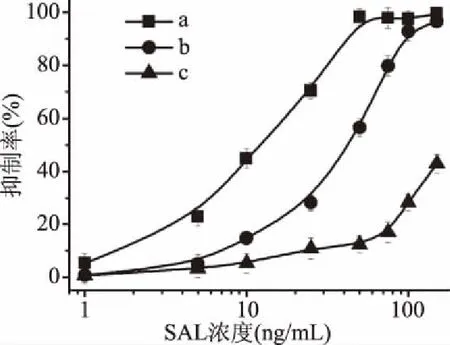
图5 三个不同SAL-Ab浓度在相同SPR条件下检测SAL的抑制率变化与SAL浓度的关系Fig.5 Relationship between the change of inhibition rate of SAL and the concentration of SAL detected by three different SAL-Ab concentrations under the same SPR condition注:a:12.5 μg/mL;b:25 μg/mL;c:50 μg/mL。
2.3.2 标准曲线绘制 在上述最佳条件下,将基于DMSA为连接体的SPR免疫传感器应用于SAL的检测。如图6所示以SAL分子浓度C的对数为横坐标,以抑制率为纵坐标,用软件进行曲线拟合绘制标准曲线,获得回归方程y=0.008x2-1.95x+114.29(R2=0.982),将传感器检测沙丁胺醇能被测定的最低量作为LOQ,为5 ng/mL,IC50为39.1 ng/mL。
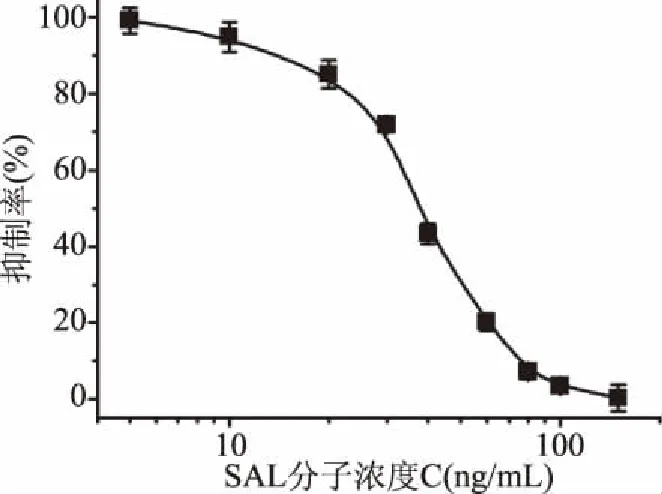
图6 SPR免疫传感器检测SAL的标准曲线Fig.6 Standard curve for SAL detection by SPR immunosensor
2.3.3 猪肉样品中SAL的检测 为了验证SPR方法的准确性和可靠性,将猪肉用作样品基质,添加浓度为5、10和20 μg/kg时的添加回收实验(n=3),结果如表1所示,本文方法检测SAL的回收率为94.9%~108.0%,RSD为1.30%~5.58%,与UPLC-MS/MS方法的结果相比,具有良好的一致性。因此,本文建立的方法适用于猪肉样品中SAL的定量分析。
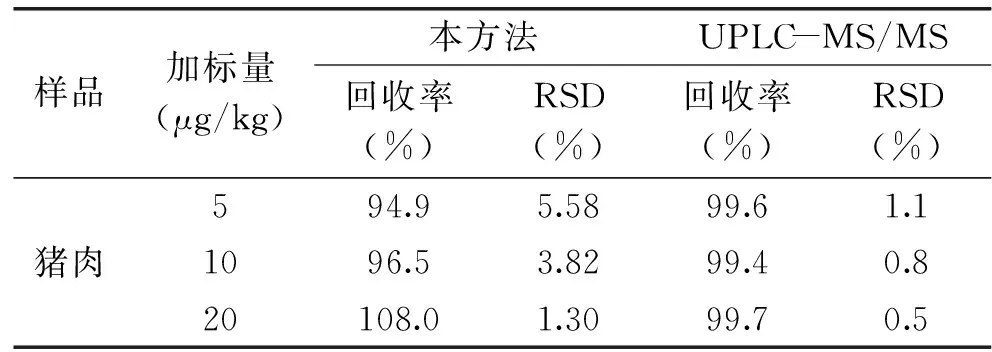
表1 猪肉样品中沙丁胺醇的DMSA-SPR免疫传感器和UPLC/MS/MS测定结果(n=3)Table 1 Results of salbutamol in pork samples by DMSA-SPR immunosensor and UPLC/MS/MS (n=3)
为了考察本文方法的识别特异性,选取了相同浓度(120 ng/mL)的莱克多巴胺、盐酸克伦特罗、盐酸马布特罗和西马特罗为SAL的结构类似物。如图7所示,SAL的抑制率明显高于其他化合物,而且与混合物(120 ng/mL)的抑制率相差不大。因此,本文方法具有很好的特异识别性能。
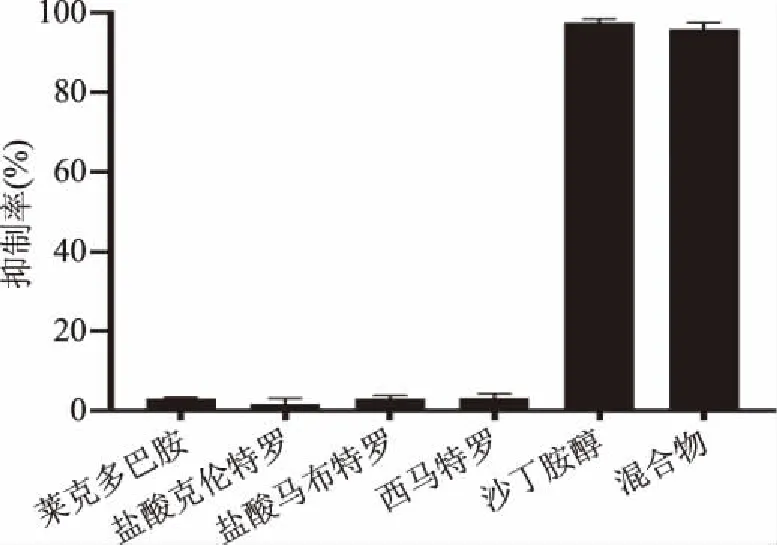
图7 DMSA-SPR免疫传感器特异性分析Fig.7 Specific analysis of DMSA-SPR immunosensor
同时将所提出的竞争性DMSA-SPR免疫传感器方法与先前报道的用于检测沙丁胺醇的方法相比较,如表2所示,SPR传感器的方法的检测范围与最低检测值都低于表中所列方法,表明竞争性DMSA-SPR免疫传感器方法是一种灵敏的方法,可用于食品中沙丁胺醇的检测。
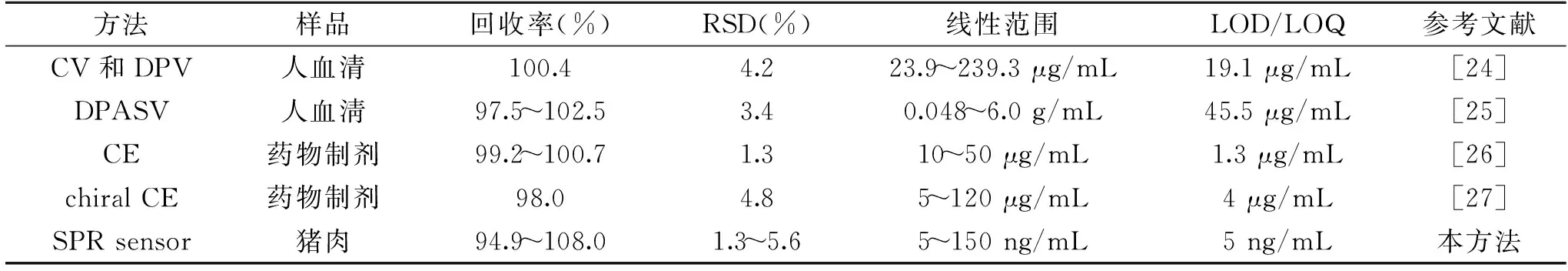
表2 沙丁胺醇检测方法之间的比较Table 2 Comparison between salbutamol detection methods
3 结论
本实验首次比较了DMSA和MPA作为SAMs的表面羧基官能团的浓度和排布,从实验结果分析,具有双巯基、双羧酸特殊结构的DMSA相较于单巯基、单羧酸的MPA传统连接分子构建的SPR芯片,SPR传感器灵敏度更高。验证了硫醇中羧基基团的密度和分布会影响SPR芯片表面抗原/抗体的结合。本文提出的通过使用DMSA作为SAMs来提高SPR免疫传感器的检测效率是一种有效的新思路,可应用于其他小分子的方便快捷、高灵敏检测。
