胰岛素调控miR-34a/Sirt1轴对妊娠糖尿病大鼠内质网应激的影响
2020-11-11魏秀玲郑素梅李世丹
王 娟 魏秀玲 郑素梅 李世丹 张 燕
(诸城市妇幼保健院,山东诸城 262200)
妊娠糖尿病(gestational diabetes mellitus,GDM)是妊娠期间首次发现或发生的以血糖升高为主要表现的代谢性疾病,可导致不良妊娠结局产生[1]。微小 RNA-34a(miR-34a)/ 沉 默 信 息 调 节 因 子(Silent information regulator,Sirt1)轴可调控ERS 及细胞凋亡等生理活动并参与疾病发展过程。本研究通过建立GDM 大鼠模型和设置Sirt1 抑制剂,探讨胰岛素降低胰岛素抵抗改善GDM 的具体分子机制,为临床合理用药提供参考。
1 材料与方法
1.1 实验材料
1.1.1 动物 清洁级同遗传背景SD 大鼠,体重 200 ~220 g,由广东省医学实验动物中心提供,生产许可证号为SCXK(粤) 2018-0002,动物质量合格证号为广东省科委2000A027。
1.1.2 主要试剂及仪器 胰岛素(美国MP Biomedicals 公司,CAS 号:12584586,规格:1 mg);链脲佐菌素(STZ)注射液(北京凯瑞基生物科技有限公司,批号:82342,规格:20 mg/瓶);HE 染色试剂盒(上海名劲生物科技有限公司); Trizol 总RNA 提取试剂盒(上海名劲生物科技有限公司)。
1.2 方法
①选取50 只已受孕大鼠构建大鼠GDM 模型[2]:随机选取10 只经腹腔注射给予柠檬酸缓冲液,并给予正常饲料喂养作为正常妊娠组(正常组);剩余40 只大鼠造模成功后,随机分为模型组(GDM 组)、胰岛素组(20 U/kg)、塞利司他组(EX527,Sirt1 抑制剂,2 mg/kg,抑制剂组)、胰岛素+Sirt1 抑制剂组(20 U/kg+2 mg/kg,联合组),每组10只。各组大鼠于妊娠第5 d 开始按照相应计量给药,正常组与GDM 组经皮注射等剂量生理盐水,各组连续给药14 d,1 次/d。②各组大鼠末次给药禁食禁水12 h 后用3%戊巴比妥钠麻醉后处死,经腹主动脉取血3 mL,离心取上清液,置于-20℃冰箱中保存。快速摘取胰腺组织,经磷酸缓冲盐冲洗后,取0.5 g 组织,用组织匀浆器匀浆后,离心分离取上清液置于-20 ℃冰箱保存,剩余部分迅速置于4%中性多聚甲醛中固定24 h。
1.3 观察指标
① 检 测 FBG、FINS(空 腹 胰 岛 素 含 量),HOMAIR=FBG×FINS/22.5。②采用 2-ΔΔCt法计算 miR-34a 相对表达量。③分析 GRP78、caspase-12、Sirt1、UCP-2 蛋白相对表达水平。④观察并计算被染成棕色的细胞数(凋亡细胞数)及总细胞数,胰岛细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.4 统计学分析
以SPSS 22.0 软件对实验数据进行统计分析,计量资料以()表示,多组间比较进行单因素方差分析,进一步两组间比较行LSD-t 检验,P <0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠各指标结果比较
GDM 组及联合组大鼠FBG 含量、HOMA-IR、胰腺组织miR-34a表达、胰岛细胞凋亡率均高于正常组(P<0.05);胰岛素组各指标均低于GDM 组和联合组(P <0.05);抑制剂组各指标均高于其他组(P <0.05);GDM 组与联合组比较,差异无统计学意义(P >0.05),见表1。
2.2 各组大鼠胰腺组织GRP78、caspase-12、Sirt1、UCP-2 蛋白表达结果
GDM 组及联合组大鼠胰腺组织GRP78、caspase-12、UCP-2 蛋白表达高于正常组(P < 0.05),Sirt1 表达低于正常组(P <0.05);胰岛素组上述蛋白表达低于GDM 组和联合组(P < 0.05),Sirt1 表达高于 GDM 组和联合组(P <0.05);抑制剂组大鼠上述蛋白表达均高于其他组(P < 0.05),Sirt1 表达低于其他组(P < 0.05)。GDM 组与联合组比较差异无统计学意义(P >0.05),见图1、表2。

图 1 各组大鼠胰腺组织GRP78、caspase-12、Sirt1、UCP-2蛋白表达免疫印迹图
表1 各组大鼠各指标结果比较()
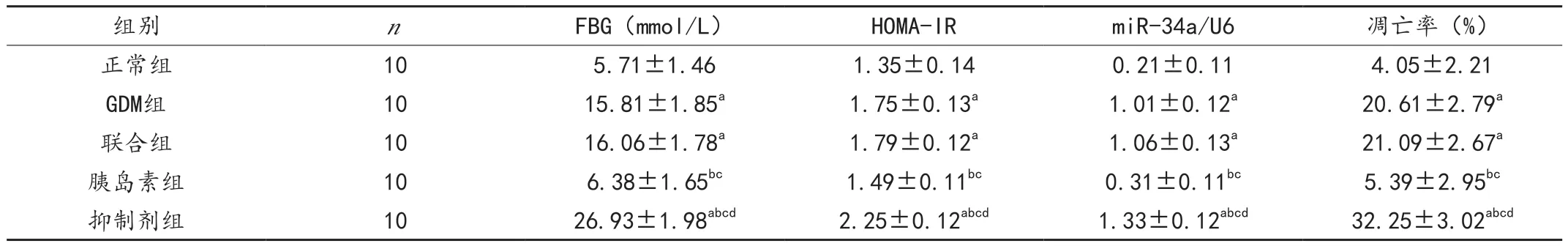
表1 各组大鼠各指标结果比较()
注:与正常组比较,aP <0.05;与GDM 组比较,bP <0.05;与联合组比较,cP <0.05;与胰岛素组比较,dP <0.05。
组别 n FBG(mmol/L) HOMA-lR miR-34a/U6 凋亡率(%)正常组 10 5.71±1.46 1.35±0.14 0.21±0.11 4.05±2.21 GDM组 10 15.81±1.85a 1.75±0.13a 1.01±0.12a 20.61±2.79a联合组 10 16.06±1.78a 1.79±0.12a 1.06±0.13a 21.09±2.67a胰岛素组 10 6.38±1.65bc 1.49±0.11bc 0.31±0.11bc 5.39±2.95bc抑制剂组 10 26.93±1.98abcd 2.25±0.12abcd 1.33±0.12abcd 32.25±3.02abcd
表2 各组大鼠胰腺组织GRP78、caspase-12、Sirt1、UCP-2 蛋白表达比较()
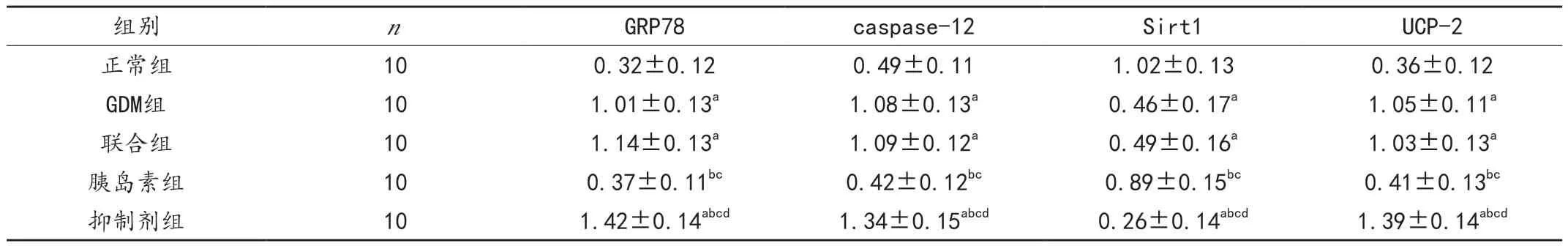
表2 各组大鼠胰腺组织GRP78、caspase-12、Sirt1、UCP-2 蛋白表达比较()
注:与正常组比较,aP <0.05;与GDM 组比较,bP <0.05;与联合组比较,cP <0.05;与胰岛素组比较,dP <0.05。
组别 n GRP78 caspase-12 Sirt1 UCP-2正常组 10 0.32±0.12 0.49±0.11 1.02±0.13 0.36±0.12 GDM组 10 1.01±0.13a 1.08±0.13a 0.46±0.17a 1.05±0.11a联合组 10 1.14±0.13a 1.09±0.12a 0.49±0.16a 1.03±0.13a胰岛素组 10 0.37±0.11bc 0.42±0.12bc 0.89±0.15bc 0.41±0.13bc抑制剂组 10 1.42±0.14abcd 1.34±0.15abcd 0.26±0.14abcd 1.39±0.14abcd
3 讨论
GDM 的主要病理特点为胰岛素抵抗、血糖升高、胰岛细胞凋亡等[3]。本研究结果表明,胰岛素可有效控制GDM大鼠血糖水平、减轻胰岛素抵抗、改善胰腺组织损伤。有研究发现[4-5],GDM 过程中,胰腺组织会发生ERS(内质网应激),可引起胰岛细胞凋亡、胰岛功能缺陷和胰岛组织损伤。GRP78 是ERS 的特异性标志物之一,caspase-12 是介导细胞凋亡者主要因子[6]。郎丽翔[7]等发现ERS 参与GDM 过程,GDM 大鼠胰腺组织GRP78、caspase-12 蛋白表达升高,ERS 及胰岛细胞凋亡、胰腺组织损伤均加重。本研究结果表明,GDM 组大鼠胰腺组织ERS 处于激活状态,可能与胰腺组织损伤有关。进一步分析发现,胰岛素可抑制GDM 大鼠胰腺组织ERS 激活,可能与改善胰腺组织损伤有关,然而其机制并不清楚。
Sirt1 可在胰腺内分泌细胞中表达,并参与胰岛细胞功能调节,UCP-2 是线粒体内膜上的转运蛋白,可直接与Sirt1 结合,共同参与胰岛细胞分泌及功能调节。CARLONI[8]等发现腹膜注射退黑素,可抑制miR-34a 表达,上调Sirt1 表达,降低新生儿脑组织ERS 及炎症损伤。本研究结果显示GDM 组大鼠胰腺组织中miR-34a 表达上调、Sirt1 表达下调,可能使得Sirt1 对UCP-2 蛋白表达的抑制作用降低,进一步影响胰岛素分泌及胰腺组织ERS 损伤。与GDM 组相比,胰岛素组miR-34a 表达降低,Sirt1 表达升高,UCP-2蛋白表达均降低,推测胰岛素可能通过下调miR-34a 并上调Sirt1 表达,抑制GDM 大鼠胰腺组织ERS,进而抑制胰腺组织损伤及细胞凋亡。为验证这一推测,本研究同时给予GDM 大鼠胰岛素和Sirt1 抑制剂进行治疗,发现与GDM 组比较,联合组大鼠胰腺组织损伤程度、胰岛细胞凋亡率及胰腺组织中各蛋白表达差异无统计学意义,提示Sirt1 抑制剂可逆转胰岛素对GDM 大鼠胰腺组织ERS 的抑制作用及对胰腺组织损伤、胰岛细胞凋亡的保护作用,进一步提示胰岛素可能通过下调miR-34a 并上调Sirt1 表达,抑制胰腺组织ERS,进一步缓解GDM 大鼠胰岛组织损伤和胰岛细胞凋亡。
综上所述,胰岛素可通过调节miR-34a/Sirt1 信号轴,抑制胰腺组织ERS 表达,缓解GDM 大鼠胰腺组织损伤,为临床治疗GDM 提供一定参考。GDM 胰腺组织ERS 极其复杂,胰岛素还可能通过其他途径治疗和缓解GDM 病理症状,这有待后续继续深入研究。
