五子衍宗丸对少精症小鼠睾丸基因表达谱的影响
2020-11-09孟雪丹赵崇军赵霞张文婷王昭懿顾念念冯丹吴怡青邹迪新林瑞超
孟雪丹 赵崇军 赵霞 张文婷 王昭懿 顾念念 冯丹 吴怡青 邹迪新 林瑞超
不育不孕在全球的患病率约为9%[1-2],少精症是男性不育的主要临床表型,发病机制复杂(基因突变、环境污染、性激素内分泌紊乱等),现代医学尚无有效的药物治疗方案[3]。
五子衍宗丸是中医治疗少弱精症的经典名方,由五味子、枸杞子、覆盆子、菟丝子、车前子组成,临床上对于少精子症治疗效果显著[4]。大量临床观察和实验研究不断拓展了对五子衍宗丸药理性质的认识,但多数评价仍停留在某个或某几个角度或水平进行研究,缺乏五子衍宗丸作用机制的系统研究,限制了该方的进一步开发和临床应用[5]。白消安可造成睾丸生精细胞的损伤,是诱导少精症动物模型的常见方法[6]。为了从整体上探讨五子衍宗丸治疗少精症的分子机制,本研究应用基因芯片技术,分析经五子衍宗丸治疗后的少精症小鼠睾丸组织基因表达谱的变化,应用生物信息学从药物调控基因的功能、信号通路等方面,为全面系统地探讨五子衍宗丸治疗少精症的分子机制提供实验依据。
1 材料与方法
1.1 实验动物与分组
Balb/c雄性小鼠,(20±2)g,10周龄,SPF级,购于北京维通利华实验动物技术有限公司(中国,北京)[许可证号:SCXK(京) 2018-0010]。动物饲养于屏障系统中,温度为 ( 25±1) °C,相对湿度为50%~60%,自由饮水及进食。动物实验与操作遵照北京中医药大学伦理委员会的要求进行。将36只Balb/c小鼠随机分成少精症组、五子衍宗丸治疗组和正常对照组,共3组,每组各12只。少精症组给药方法:小鼠腹腔注射白消安的DMSO溶液(1 mg/mL),给药剂量为20 mg/kg,建造白消安致小鼠少精症模型。小鼠自白消安腹腔注射第2天,口服灌胃生理盐水(14 mL/kg/d),每日1次,连续14天。五子衍宗丸治疗组给药方法:小鼠自白消安腹腔注射第2天,口服灌胃给予五子衍宗丸 (1.56 g/kg/d),每日1次,连续14天。正常对照组给药方法:小鼠腹腔注射DMSO(1 mL/kg),作为正常对照组。小鼠自DMSO腔注射第2天,口服灌胃给予生理盐水溶液(14 mL/kg/d),每日1次,连续14天。
1.2 药物与试剂
五子衍宗丸:枸杞子、五味子、覆盆子、菟丝子、车前子购于同仁堂药业有限公司(中国北京),制备标准参照2015版《中华人民共国药典》,由北京中医药大学中药品质评价中心(北京市重点实验室)制备成大蜜丸,4°C保存备用。白消安购于麦克林生物化学公司 (中国上海),二甲基亚砜( DMSO)购于国药集团化学试剂公司 (中国北京) ,牛血清白蛋白购自索莱宝公司(中国北京),胎牛血清( BI) 、DMED/F12 培养基购于Sigma 公司(美国密苏里州),70 μm细胞筛购于Corning公司(美国纽约州),Trizol试剂购于Invitrogen公司(美国加利福尼亚州),QIAGEN RNeasy Mini Kit购于Qiagen公司(德国杜塞尔多夫),GeneChip WT PLUS Kit、GeneChip IVT Labeling Kit、Affymetrix Mouse Clariom®S Array购于Affymetrix公司(美国加利福尼亚州)。
1.3 实验仪器
CIOC-XSI-G型生物显微镜(重庆光电仪器有限公司,中国);BP-D精密电子天平(北京赛多利斯天平有限公司,中国);RJ-TGL-16G台式高速离心机(无锡市瑞江分析仪器有限公司,中国);FACSCalibur单激光流式细胞仪(BD公司,美国);Thremo Nanodrop 2000(Thermo公司,美国);Agilent Bioanalyzer 2100(Agilent公司,美国),Affymetrix Fluidics Station 450(Agilent公司,美国),GeneChip Scanner 3000(Agilent公司,美国)。
1.4 小鼠睾丸病理分析
末次给药24小时后,称取小鼠体重,乙醚麻醉,剖开腹腔取出睾丸,颈椎脱臼法处死小鼠。取右侧睾丸置于体积分数4%的甲醛溶液中固定后,制成HE染色石蜡切片,显微镜下观察并分析记录组织形态。
1.5 睾丸单细胞悬液的制备
左侧睾丸置于1%双抗的PBS中清洗,手术剪刀剪开睾丸白膜,暴露生精小管,移生精小管入含I型胶原酶(120 U/mL)的PBS中,于32℃水浴摇床上,温和震摇5分钟。随后加入适量0.25%Trypsin和DNaseI,至DNaseI 终浓度为300 μg/mL,消化5~7分钟后,加入含有10%胎牛血清的DMEM/F12培养基终止消化,用PBS预润的细胞筛(70 μm)过滤去除未消化的组织,将滤液移入离心管中,4℃,500×g,离心5分钟,弃上清,重悬细胞,吹打混匀,制成睾丸单细胞悬液(浓度≥106个细胞/mL)。
1.6 睾丸中不同倍体精子细胞比例测定
取上述正常对照组、少精症组和五子衍宗丸治疗组的睾丸单细胞悬液样品,每组6份,置冰上避光暂存,进行流式细胞测定。应用Cell Quest软件,根据DNA 含量确定单倍体(精子细胞)、二倍体(G1期精原细胞和次级精母细胞)和四倍体(G2期精原细胞和初级精母细胞)的细胞群比例。
1.7 睾丸细胞的基因芯片检测
取正常对照组、少精症组和五子衍宗丸治疗组的睾丸单细胞悬液样品,每组6份,提取各组的总RNA,经纯化、杂交等过程处理后,应用基因芯片进行基因表达强度的检测,获得各基因的表达强度值。
1.8 统计学处理
将处理后的标准数据导入Significance Analysis of Microarrays (SAM) 软件,计算两两实验组间的基因表达值的变化倍数(Fold Change,FC)和显著性差异值(P-value)。以|FC|>1.5且P-value<0.05为标准条件,筛选组间差异基因。将筛选出的差异基因导入DAVID数据库(https://David.ncifcrf.gov/)进行GO功能分析、KEGG信号通路分析。采用SPSS 20.0软件对流式细胞术检测结果进行数据处理。计量资料采用均数±标准差(mean±SD)的形式,经正态性、方差齐性检验,结果显示检验数据均符合正态分布且方差齐。对空白对照组、少精症组和五子衍宗丸治疗组使用单因素方差分析进行组间比较,P<0.05表示差异具有统计学意义。
2 结果
2.1 睾丸组织病理分析
与正常对照组相比,少精症组小鼠睾丸组织病理切片出现明显的少精症的睾丸损伤病理改变,如生精小管萎缩、生精小管上皮变薄、管腔内生精细胞层级减少,排列紊乱,生精细胞间隙变宽,生精细胞发育阻滞在精母细胞阶段。与少精症组相比,五子衍宗丸治疗组小鼠睾丸组织病理切片的生精小管排列整齐,结构完整;管腔内生精细胞排列紧密、层次清晰。见图1。
2.2 睾丸精子细胞比例
与正常对照组相比,少精症组的睾丸精子细胞比例显著下降,与文献报道的少精症睾丸精子细胞比例相近[7]。与少精症组相比,五子衍宗丸治疗组的睾丸精子细胞比例显著增加。见图2和表1。
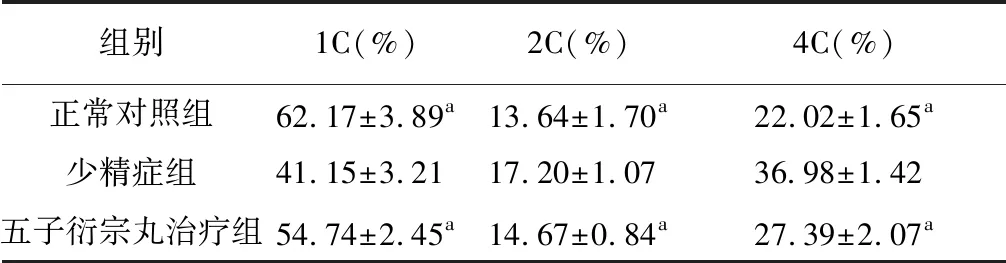
表1 正常对照组、少精症组、五子衍宗丸治疗组小鼠睾丸组织精子细胞比例比较(n=6)

注:A1、A2为正常对照组;B1、B2为少精症组;C1、C2为五子衍宗丸治疗组。
2.3 睾丸基因表达谱分析
2.3.1 差异基因筛选 应用SAM 软件对基因芯片表达数据进行组间差异基因的筛选,结果显示,五子衍宗丸治疗组与少精症组相比,五子衍宗丸治疗组共有839个差异表达基因,其中426个基因上调(差异基因集1),613个基因下调(差异基因集2),见图3A;正常对照组与少精症组相比,正常对照组共有1791个差异表达基因,其中915 个基因上调(差异基因集3),876个基因下调(差异基因集4),见图3B。为筛选与少精症组相比,五子衍宗丸治疗组和正常对照组同时上调的基因,对差异基因集1和差异基因集3作交集(五子衍宗丸上调的差异基因),结果表明五子衍宗丸上调的差异基因共有55个。见图4A。进一步筛选与少精症组相比,五子衍宗丸治疗组和正常对照组同时下调的基因,对差异基因集2和差异基因集5作交集(五子衍宗丸下调的差异基因),结果显示,五子衍宗丸下调的差异基因有542个,见图4B。
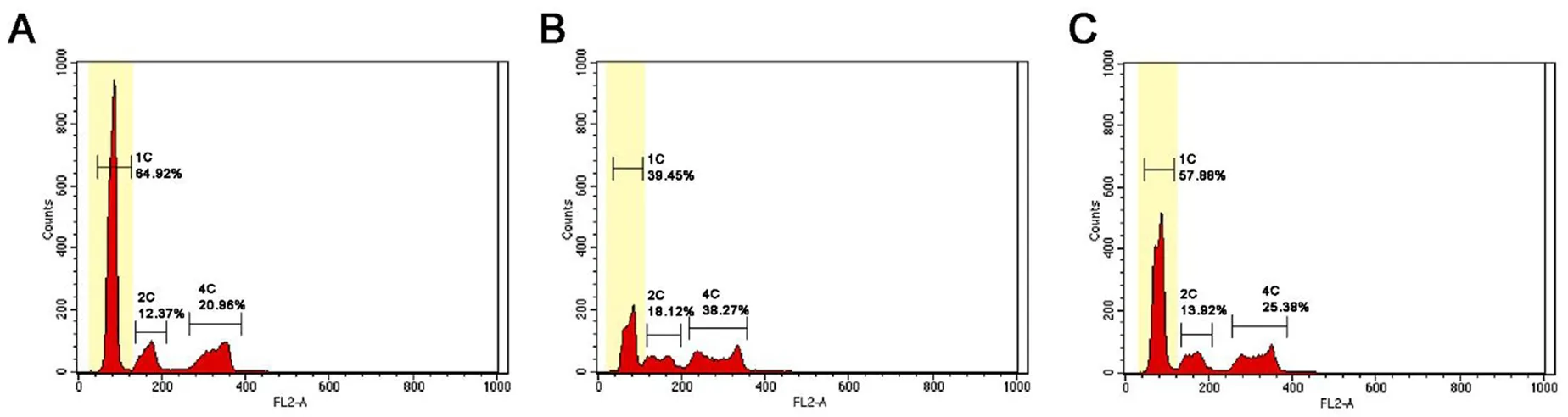
注:A为正常对照组;B为少精症组;C为五子衍宗丸治疗组;图中 “1C”表示睾丸组织中的精子细胞(DNA含量为单倍体的细胞);“2C”表示睾丸组织中的G1期精原细胞和次级精母细胞(DNA含量为二倍体的细胞);“4C”表示睾丸组织中的G2期精原细胞和初级精母细胞(DNA含量为四倍体的细胞)。
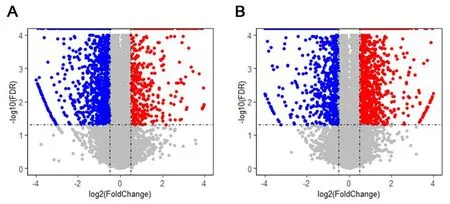
注:A 为五子衍宗丸治疗组与少精症组之间的差异表达基因火山图; B 为正常对照组与少精症组之间的差异表达基因火山图;图中蓝色代表下调基因;红色代表上调基因;灰色代表无显著表达变化基因。
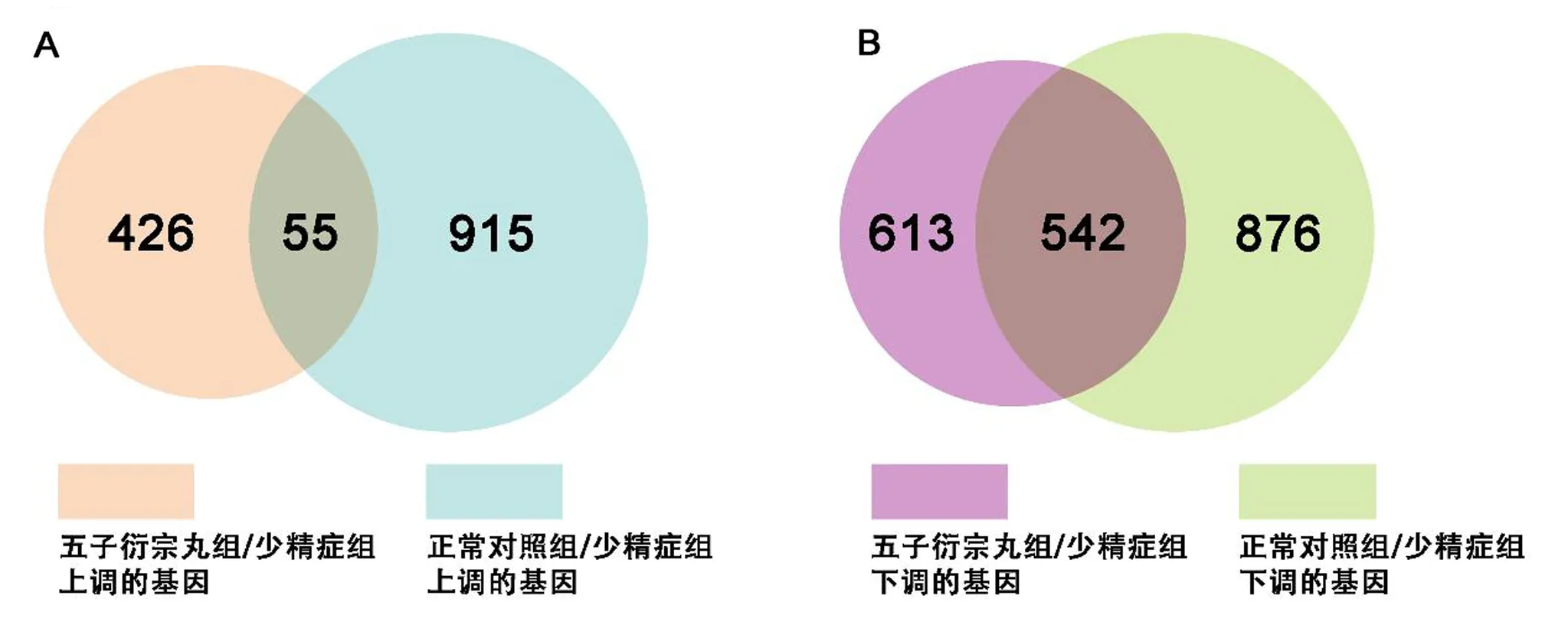
注:A为五子衍宗丸组与少精症组相比上调的基因及正常对照组与少精症组相比上调的基因,交集部分为五子衍宗丸治疗组和正常对照组共同上调的基因;B为五子衍宗丸组与少精症组相比下调的基因和正常对照组与少精症组相比下调的基因,交集部分为五子衍宗丸治疗组和正常对照组共同下调的基因。
2.3.2 GO功能分析 对五子衍宗丸上调的差异基因进行GO生物过程分析,结果显示,药物上调基因共显著富集到68条GO条目(P<0.05),以P值对其进行显著性差异的排序,上调排名前10名的GO条目见图5A和表2,其中与调节男性生殖有直接联系的GO条目为对精子生成的调控、对生精细胞减数分裂周期的调控、对精子细胞分化的调控、对生精细胞减数分裂过程中非姐妹染色单体交叉点形成的调节、对生精细胞减数分裂过程中联会复合体形成的调节、对生精细胞减数分裂中的同源染色体配对的调控。五子衍宗丸下调的差异基因进行GO生物过程分析后,显著富集到1042条GO条目(P<0.05),按照P值排序,下调排名前10名的GO条目见图5B和表2,涉及氧化还原过程、酶原活化、脂质代谢过程、 全身动脉血压的调节、 脂肪酸代谢过程 、 甾体生物合成过程、 对有机环状化合物的响应、老化、免疫系统过程和谷胱甘肽代谢过程。
2.3.3 信号通路分析 对五子衍宗丸上调的差异基因进行KEGG 信号通路分析,结果显示,药物上调基因显著富集到3条信号通路(P<0.05),见图6A和表3,包括同源重组通路、内质网蛋白质加工通路和蛋白质输出通路,这三条通路均与生命体的遗传信息处理密切相关。对五子衍宗丸下调的差异基因进行KEGG 信号通路分析后,共显著富集到53条信号通路(P<0.05),以P值对其进行显著性差异的排序,下调排名前10名的信号通路见图6B和表3,主要涉及肾素-血管紧张素系统、胆固醇代谢、药物代谢-细胞色素P450通路、 脂肪酸代谢、内分泌和其他因素调节的钙再吸收等信号通路。

注:A为五子衍宗丸上调的差异基因(55个)高度富集的前10条GO生物过程条目;B为五子衍宗丸下调的差异基因(542个)高度富集的前10条GO生物过程条目

表2 五子衍宗丸调控睾丸差异基因高度富集的GO生物过程条目注释
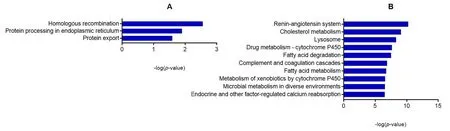
注:A为五子衍宗丸上调的差异基因(55个)显著富集的KEGG信号通路; B为五子衍宗丸下调的差异基因(542)高度富集的前10条KEGG信号通路。
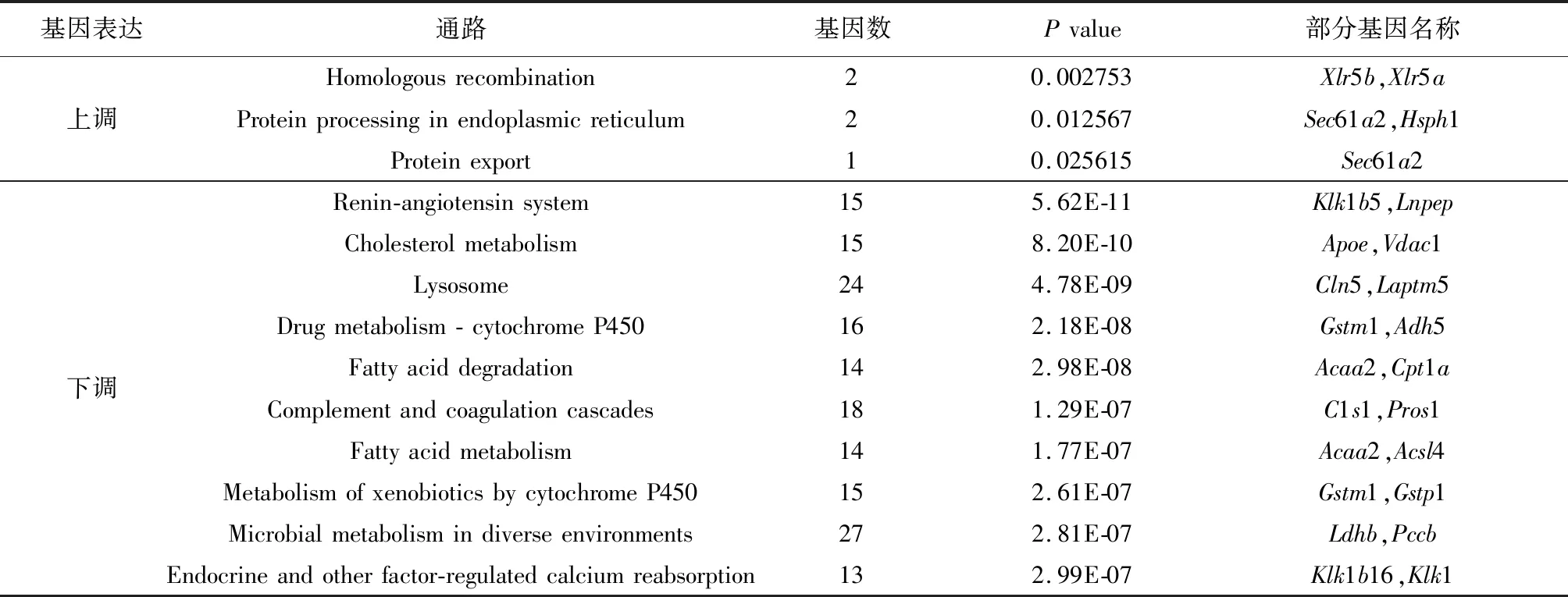
表3 五子衍宗丸调控睾丸差异基因高度富集的KEGG信号通路注释
3 讨论
本研究以白消安致少精症小鼠为阴性对照,以五子衍宗丸口服给药为实验对照,以正常动物为空白对照,从睾丸病理和睾丸精子细胞比例两个方面考察了五子衍宗丸口服给药治疗少精症的效应,研究结果显示五子衍宗丸能明显修复少精症小鼠睾丸组织病理损伤,提高睾丸组织内精子细胞比例,治疗实验性少精症疗效显著。在此基础上,为了进一步探讨五子衍宗丸治疗少精症的分子机制,应用基因芯片技术分析了睾丸组织基因表达谱,系统地筛选出五子衍宗丸调控的少精症小鼠睾丸基因有597个,其中55个上调,542个下调。五子衍宗丸调控的睾丸基因主要参与的GO 条目有精子生成、生精细胞减数分裂的周期、精子细胞分化、生精细胞减数分裂中的同源染色体配对、联会复合体形成、非姐妹染色单体交叉点形成、氧化还原过程、酶原活化、脂质代谢等生物过程;参与的信号通路主要有同源重组、内质网蛋白质加工、蛋白质输出、肾素-血管紧张素系统、胆固醇代谢、细胞色素P450对药物的代谢等。
五子衍宗丸治疗后,少精症小鼠睾丸组织中调控精子生成的基因Rnf17、Trip13、Sohlh2 等表达上调,Rnf17在睾丸组织中特异性表达,是编码精子生成的关键调控因子,该基因突变可导致雄性成年小鼠不育[8]。Trip13基因的表达可调节精母细胞减数分裂重组和DNA双链断裂修复,Trip13突变无法完成小鼠精母细胞的减数分裂重组,出现重组缺陷,触发精母细胞阶段阻滞,精子生成停滞[9-10]。Sohlh2是精子生成的特异性转录因子,仅在减数分裂前的精原细胞中表达,可通过调节A型精原细胞分化为B型精原细胞,影响分化精原细胞的活力,缺少Sohlh2的雄性小鼠由于精子生成的早期阻滞而无法生育[11]。Sycp1是编码减数分裂横丝蛋白的基因,调节精母细胞减数分裂重组、突触复合体组装和XY染色体形成,是维持男性生育力所必需的基因,Sycp1突变小鼠的精母细胞不形成XY染色体,且不能完成减数分裂重组的修复,触发精子生成的中断[12]。Gasz是仅在生殖细胞中表达的进化保守基因,编码具有四个锚蛋白重复序列,不育α基序和亮氨酸拉链的蛋白,可抑制雄性生殖细胞中反转录转座子表达,并影响雄性生殖细胞的减数分裂,Gasz功能的丧失会导致男性不育,并具有成核和piRNA生物合成方面的缺陷[13]。另外,Gasz可与生殖细胞关键调节剂Dazl相互作用,以协同方式促进胚胎干细胞衍生的生殖细胞,Gasz缺乏导致胚胎干细胞分化过程中生殖细胞明显减少[14]。由上可知,五子衍宗丸可调节少精症小鼠睾丸精子生成过程中多个基因的表达,提示这些基因的改变可能与该方有效治疗少精症的分子机制高度关联。
同源重组(homologous recombination,HR)信号通路不仅在生精细胞减数分裂的同源染色体配对、联会、交换等具有重要的调节作用,而且参与修复DNA双链断裂、单链断裂和链间交联等损伤,该通路抑制后,会导致生精细胞的减数分裂受阻,造成雄性不育缺陷[15]。本研究中,五子衍宗丸显著上调了少精症小鼠睾丸组织中的HR信号通路,提示药物修复的HR信号通路可能与五子衍宗丸对少精症小鼠睾丸精子生成的调节作用高度关联。五子衍宗丸显著下调少精症小鼠睾丸组织中的信号通路主要有肾素-血管紧张素系统(renin-angiotensin-system,RAS)和胆固醇代谢。在男性生殖系统中,RAS信号通路的成分在睾丸Leydig细胞、附睾上皮细胞、附睾脂肪垫和前列腺腺上皮中表达,以旁分泌、自分泌或内分泌方式参与精子成熟,精浆维持电解质和睾丸类固醇生成[16],有研究表明抑制该信号通路有助于睾丸类固醇(睾丸酮、雌二醇和促黄体生成素)的生成,进而影响睾丸生精功能[17],提示五子衍宗丸下调少精症小鼠睾丸组织中的RAS信号通路可能影响了睾丸类固醇的生成。胆固醇稳态与男性生育力密切相关,一方面胆固醇是睾丸雄激素的合成前体,另一方面其是生殖细胞细胞膜的主要成分,对膜的流动性、离子通道功能和信号传导途径的激活具有重要的调节作用[18],有文献报道睾丸组织生精障碍会引起胆固醇代谢异常,可能直接影响生殖细胞的胆固醇稳态[19]。 本研究中,少精症小鼠睾丸组织的胆固醇代谢途径异常上调,五子衍宗丸治疗后下调了该信号通路,提示五子衍宗丸可能通过干预胆固醇代谢途径,维持生殖细胞的胆固醇稳态,进而发挥药物效应。
本研究应用基因芯片技术系统分析了五子衍宗丸对少精症小鼠睾丸组织基因表达谱的影响,从基因层面表征了五子衍宗丸治疗少精症的分子机制。结果显示,少精症小鼠经五子衍宗丸治疗后睾丸组织中与精子生成相关的多个基因和多条信号通路发生了显著变化,通过生物信息学挖掘,发现五子衍宗丸主要是通过调节生精细胞的减数分裂、睾丸HR信号通路、睾丸RAS信号通路、睾丸胆固醇代谢等影响精子生成及睾丸生精功能,从而对少精症起到治疗作用,同时,为阐明五子衍宗丸治疗少精症的药理作用机制、进一步实验研究及临床应用提供了一定的参考。
