重组PCV3 Cap 蛋白在酵母细胞中的表达与鉴定
2020-11-03潘毅平郭苗苗肖升东闫鹏先张国庆
潘毅平,郭苗苗,肖升东,闫鹏先,张国庆,贺 笋
(1.天康生物股份有限公司,新疆乌鲁木齐 830032;2.天康生物(上海)有限公司,上海 201203)
猪圆环病毒(porcine circovirus,PCV)是一种无囊膜的单股环状DNA 病毒,是最小的DNA病毒之一,目前已发现PCV1、PCV2、PCV3 以及PCV4。PCV1 为非致病性病毒;PCV2 为致病性病毒,是断奶仔猪多系统衰竭综合征(PMWS)的主要病原;PCV4 与水貂圆环病毒的基因组一致性最高(66.9%),与其他PCV 基因组的一致性仅为43.2%~51.5%。据报道[1],PCV4 检出猪群患有严重临床症状,并有多种病原微生物共感染现象。
2015 年,美国首次报道了PCV3 在猪群中流行[2]。PCV3 病毒粒子呈二十面体结构,无囊膜,其基因组为单股DNA,全长约2 000 bp,包含3 个主要开放阅读框(open reading frame,ORF),主要抗原Cap 蛋白与PCV2 Cap 蛋白基因同源性很低,仅30%左右。2016 年起,我国在多个猪场检测到PCV3。这些猪场无一例外,均出现母猪繁殖障碍、多系统炎症反应和新生仔猪数量急剧下降等问题[3-5]。PCV3 自发现以来,已经逐渐成为影响我国养猪业的重要病原体。目前还没有体外繁殖PCV3 分离株获得成功的报道,这也在一定程度上制约了PCV3 灭活疫苗的研发。
研究人员相继将PCV3 Cap 蛋白在大肠杆菌和杆状病毒/昆虫表达系统中表达并成功组装成病毒样颗粒(virus-like particle,VLP)[6-8]。但是大肠杆菌表达的PCV Cap 蛋白可溶性低,且有内毒素污染,后期去除内毒素工艺复杂且成本较高;昆虫杆状病毒系统表达的VLP 具有很好的免疫效果,但是昆虫杆状病毒系统表达的Cap 蛋白VLP 产量低、生产成本高、工艺复杂,难以用于动物疫苗的大规模生产及应用推广。酵母表达系统作为一个高效的蛋白表达系统,具有成本低、蛋白可溶性表达等优点。由于PCV3 Cap蛋白自身核定位序列(NLS)的影响,酵母系统直接表达该蛋白时很容易形成不溶性蛋白聚集。本试验通过对PCV3 Cap 蛋白NLS进行改造,在酵母系统完成PCV3 Cap 蛋白的表达、纯化,成功组装PCV3 VLP,以期为进一步研发PCV3 亚单位疫苗奠定基础。
1 材料方法
1.1 菌株与载体
菌株Pichia pastoris X33、载体pPICZαA,均购自Invitrogen 公司。
1.2 主要仪器与试剂
1.2.1 主要仪器 离心机,购自HITACHI 公司;恒温摇床,购自上海智诚分析仪器制造有限公司;分光光度计,购自上海美普达仪器有限公司;电转仪,购自BIO-RAD 公司。
1.2.2 主要试剂 YEAST EXTRACT(No.2194133)、tryptone(No.2330844),均购自OXOID 公司;D-sorbitol(No.BCBX1172/MKCF5469)、DTT(No.SLBW1508)、生物素(No.SLBZ4553),均购自Sigma 公 司;HEPES(No.EZ2811E176),购 自BioFROXX 公 司;Zeocin(No.ZEL-40-05),购自invivogen 公司;YNB(No.7332771)购自BD公司;D(+)-无水葡萄糖(No.20180711)、磷酸二氢钾(No.20190225)、磷酸氢二钾(No.20180323)、甲醇(No.20181231)、KOH(No.20180919),均购自沪式公司。
1.3 PCV3 Cap 蛋白一级序列预测及合成
根据NCBI 中PCV3 Cap 蛋白(GenBank 登录号ATD53354.1)序列信息,利用cNLS Mapper(http://nls-mapper.iab.keio.ac.jp),将PCV3 Cap 蛋白的NLS 进行突变;优化密码子,并在优化核酸序列的5'端添加碱基GCCACC(与起始密码子ATG 共同形成KOZAK 序列),然后送金唯智公司合成。
1.4 重组PCV3 Cap 蛋白表达载体构建与转染准备
将合成的序列用TAKARA 无缝克隆试剂盒,经同源重组的方式整合到pPICZαA 载体酶切位点PstI 和XbaI 之间,获得重组质粒pPICZαAPCV3。随后,把上述重组质粒转化到Top10 感受态细胞中培养。在培养平板上挑取单克隆菌落,抽提质粒并经1%核酸电泳验证、酶切鉴定为阳性后,将线性化的质粒用冷乙醇沉淀方法回收。冷乙醇沉淀的具体操作,参照《分子克隆实验指南》[9]进行。
1.5 酵母表达PCV3 Cap 蛋白与纯化
1.5.1 电转染 将10 µL 线性化质粒和90 µL X33感受态细胞在电转杯中混匀,冰上孵育5 min;然后将电转仪设定为时间恒定模式,电转参数为电压1 200 V、时间5.5 ms、电转杯直径0.1 cm;电击后迅速加入4 ℃遇冷的YPDS 培养基,即获得稳定表达目标蛋白的细胞库;然后将细胞库置于29 ℃恒温培养箱中静置培养3 h;最后将菌液涂布到含有3 mg/mL zeocin 的YPDS 平板上,29 ℃避光静置培养3 d。在此高浓度抗生素筛选出的菌落均是高拷贝菌株。
1.5.2 诱导表达 将上述长出的单菌落转接至含1 mg/mL zeocin 的YPD 平板,然后对PCV3 Cap蛋白菌株进行菌体培养及诱导表达。培养及表达步骤为:挑取酵母单菌落至BMGY 培养基中,250 r/min 29 ℃过夜培养至菌液OD 值为2~6,20 ℃ 3 000 g 离心5 min,抛去上清;用BMM 培养基重悬菌体至菌液OD 值为2 左右,继续放在29 ℃培养箱中震荡培养24 h;然后补加0.5%甲醇,继续29 ℃震荡培养24 h;再次补加0.5%甲醇,同样的条件继续培养24 h。随后离心收集菌体,抛去上清,再用等体积的裂解液(1×protein loading buffer)进行重悬菌体,沸水浴煮沸10 min。随后进行SDS-PAGE 分析,根据SDS-PAGE 结果挑选出表达量最高的菌株。
1.5.3 纯化 用高压冷冻破碎仪裂解细胞,收取上清;然后用20%硫酸铵沉淀目标蛋白,最后用HEPES buffer 重悬。重悬蛋白经过分子排阻层析纯化,获取PCV3 Cap 蛋白。
1.6 PCV3 Cap 蛋白VLP 组装及电镜观察
纯化蛋白在50 mmol/L HEPES、200 mmol/L NaCl、pH7.4 缓冲液中,自组装成大小均一的VLP,负染电镜观察颗粒,用4K CCD 相机获取电镜照片。
2 结果
2.1 PCV3 Cap 蛋白序列优化
参考GenBank ATD53354.1 序列,利用在线工具cNLS Mapper,对PCV3 Cap 蛋白的NLS 序列进行突变。突变后的序列(Opti-Cap)经NLS 预测网站分析发现,不再具有NLS 序列特点(图1)。

图1 优化的PCV3 Cap 蛋白氨基酸序列
2.2 重组PCV3 Cap 蛋白表达载体构建与鉴定
重组质粒pPICZαA-PCV3 经PmeI 酶切后进行1%核酸电泳验证。结果(图2)显示,重组质粒pPICZαA-PCV3 完全线性化。
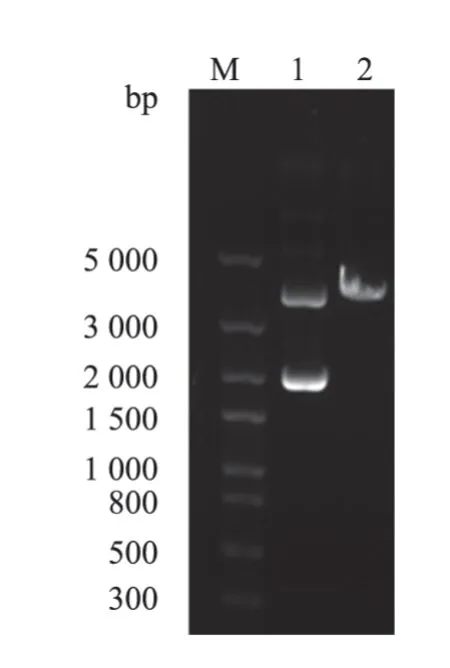
图2 重组质粒pPICZαA-PCV3 酶切结果
2.3 重组PCV3 Cap 蛋白表达与鉴定
表达PCV3 Cap 蛋白的菌体裂解后进行硫酸铵沉淀及SEC 纯化,将目的蛋白进行12% SDSPAGE 分析,可见大小约27 kDa 的蛋白条带(图3-A)。对目的条带进行MS 分析,鉴定是PCV3 Cap 蛋白。
PCV3 Cap 蛋白经负染制备样品、电镜观察后,用4K CCD 相机获取电镜照片(图3-B),可见均一的颗粒,颗粒直径约18 nm。

图3 PCV3 Cap 蛋白鉴定结果
3 讨论
2015 年,美国初次分离鉴定出PCV3 毒株,随后我国多地发现PCV3 感染[2-5]。PCV3 阳性猪场出现猪皮炎肾病综合征、母猪繁殖障碍、多系统炎症反应等症状。其中:母猪受孕率降低、流产率增加,产木乃伊胎;仔猪主要表现为呼吸、泌尿、肠道、淋巴、心血管、神经、繁殖系统以及皮肤的功能紊乱,致使保育猪体质变弱,容易继发感染。
PCV2 疫苗在我国已应用推广多年,PCV2 疫苗对PCV3 感染能否提供保护尚缺乏足够的证据。由于PCV3 分离株未能实现体外培养,病原学研究尚未深入开展,导致PCV3 的灭活疫苗研发进展受阻。研究人员尝试通过基因工程平台拯救PCV3病毒,并在PK15 细胞上传代成功,这或许会推动PCV3 疫苗的研发进展[10]。根据PCV2 亚单位疫苗研发经验,利用大肠杆菌或细胞直接表达其Cap蛋白制备亚单位疫苗,是一种简单、有效、安全的疫苗生产方式[11-12]。已有研究[7-8]报道,PCV3 VLPs 组装成功,并应用于检测试剂盒研发等。
大肠杆菌表达系统产量高,遗传背景清楚,但是表达产物的内毒素含量高,为产业化生产带来不便;杆状病毒/昆虫细胞表达系统对蛋白的折叠和修饰都较好,但是每次蛋白表达都要控制感染病毒的数量(即感染MOI 与蛋白表达产量有一定的制约关系),且生产工序复杂,因而影响其扩大生产,此外杆状病毒/昆虫细胞表达系统生产成本也较高。酵母表达系统在研发宫颈癌(HPV)疫苗、人乙肝(HBV)疫苗和人诺如疫苗等方面获得广泛应用。该表达系统具有一定的蛋白修饰功能,而且培养简单、成本低廉,对于兽用生物制品研发、生产有很好的应用前景[13-15]。PCV3 Cap 蛋白的NLS 序列对其蛋白稳定具有重要作用。若完全删除NLS 序列,其在酵母系统中表达极不稳定;保留NLS 序列,则Cap 蛋白在酵母表达系统中易发生不溶性表达。因此,本研究通过突变PCV3 Cap蛋白NLS 区序列,使PCV3 Cap 蛋白在酵母细胞实现可溶性表达,从而为PCV3 Cap 蛋白亚单位疫苗的研发奠定了基础。
