发酵乳杆菌发酵人参工艺优化及人参皂苷抗氧化活性测定
2020-11-02屈青松赵崇妍史新元
屈青松 林 峰 赵崇妍 马 涛 宋 帅 史新元∗
(1.北京中医药大学, 北京100029; 2.江苏菌钥生命科技发展有限公司, 江苏 盐城224000)
乳酸菌是有较高认可度的益生菌[1],广泛应用于农业、食品加工等行业中[2],例如常用于酸奶、泡菜等发酵食品中[3]。大量研究表明,乳酸菌能调节肠道菌群,改善胃肠道功能,降低血液中的胆固醇水平[4]。此外,乳酸菌能产多种酶类,如超氧化物歧化酶、β⁃葡萄糖苷酶、α⁃淀粉酶、纤维素酶等[5],各种产酶乳酸菌已经用于生产之中[6],其中发酵乳杆菌被CFDA 认定为可用于食品生产的益生菌,有较高的安全性[7]。
人参为五加科多年生草本植物,2012 年卫生部批准其(5 年及5 年以下人工种植的)作为新资源食品。现代医学证明人参具有诸多生物活性功能[8],不仅抗癌、抗衰老、抗氧化[9],还有效改善机体的免疫调节系统[10]。但目前国内市售人参产品形式单一,以药物为主,在食品领域的应用并不广泛[11],因而生产系列产品,如饮料、保健茶等具有广阔前景[12]。
利用益生菌发酵中草药现已成为研究热点[13]。本实验以发酵乳杆菌作为发酵菌种,以益生菌的活菌数为检测指标,在单因素试验基础上利用响应面法优化发酵工艺,HPLC 法分析益生菌发酵后人参皂苷含有量和SOD 活性变化,以期为人参发酵研究和深层次开发积累资料。
1 材料
1.1 试剂与药物 人参、发酵乳杆菌Lactobacillus fermentium购自江苏菌钥生命科技发展有限公司;人参皂苷Rg1(货 号 X13O8L45573)、人参皂 苷 Re(货 号B10M8S35243)、人参皂苷Rb1(货号Z16J9X52719)、人参皂苷Rc(货号M18J9S53098)、人参皂苷Rd(货号Z13N8X48155)购自上海源叶生物科技有限公司;总超氧化物歧化酶采用T⁃SOD 试剂盒购自南京建成生物工程研究所;MRS 液体培养基购自青岛海博生物科技有限公司。
MRS 液体培养基由蛋白胨10 g、牛肉浸粉8 g、酵母浸粉4 g、葡萄糖20 g、磷酸氢二钾2 g、柠檬酸氢二胺2 g、乙酸钠5 g、硫酸镁0.2 g、硫酸锰0.04 g、吐温⁃80 1 g、蒸馏水1 L 组成。调节pH 为6.0~6.2,121 ℃下灭菌15 min。MRS 固体培养基在MRS 液体培养基内添加20 g 琼脂/L。
1.2 仪器 BXM⁃30R 立式压力蒸汽灭菌器(上海博讯实业有限公司);洁净工作台(上海汇龙仪表电子有限责任公司);AR1502CN 精密电子天平[奥豪斯仪器(上海)有限公司];XW⁃80A 微型旋涡混合仪(上海沪西分析仪器厂有限公司);高效液相色谱仪(美国Waters 公司);DL⁃820E 智能超声波清洗器(上海之信仪器有限公司);SHZ⁃95A 循环水真空泵(巩义市予华仪器有限责任公司)。
2 方法
2.1 工艺流程 选用3~5 年干参,经过打粉处理后过药典四号筛,人参粉末以去离子水混悬后制备为匀浆,高压蒸汽法进行灭菌,温度为121 ℃,时间为20 min,冷却后接种一定量,采用MRS 液体培养基制备的发酵乳杆菌种子液,在28 ℃下进行发酵,达到发酵终点时停止,即得,冷藏保存。
2.2 活菌计数 无菌条件下将发酵液梯度稀释至不同浓度,涂布于MRS 固体培养基中,28 ℃下培养36 h,选择菌落数在30~300 个的平板进行计数,每个梯度重复3 次。
2.3 单因素试验 以发酵时间16 h、人参与水料液比1 ∶20、发酵温度36 ℃、接种量2%、摇床转速160 r/min 为初始发酵条件,分别考察发酵时间(4、8、12、16、20、24、48、72 h)、人参添加量(1%、2%、4%、6%、8%、10%、12.5%、20%)、发酵温度(24、28、32、36、40 ℃)、乳酸菌接种量(1%、2%、3%、4%、5%、6%、7%)对乳酸菌活菌数的影响。
2.4 响应面优化 依据单因素试验结果,以人参添加量、发酵时间、温度、接种量为因素,以活菌数为响应值对发酵工艺进行优化。因素水平见表1。

表1 因素水平
2.5 人参皂苷转化分析
2.5.1 对照品溶液的制备 精密称取人参皂苷Rg1、Re、Rb1、Rc、Rd 对照品3.75、3.00、3.50、2.50、5.95 mg,溶于甲醇中,定容至5 mL,即得。
2.5.2 线性关系考察 精密吸取对照品溶液,甲醇稀释100、50、20、10、5、2 倍,各进样10 μL 测定。以峰面积为纵坐标(Y),进样量为横坐标(X)进行线性回归。
2.5.3 样品处理 取发酵液匀浆与相同浓度的人参匀浆,冷冻干燥处理,取粉末0.30 g,置于具塞三角瓶中,加80%甲醇25 mL,密塞后称定质量,摇匀,超声(250 W、50 kHz)提取1 h,离心收集上清,沉淀以相同条件提取2次,收集上清,挥干后甲醇溶解并定容至10 mL,溶液过0.45 μm 微孔滤膜,即得。
2.5.4 色谱条件 安捷伦 Eclipse XDB⁃C18色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈(A)⁃0.05 mol/L磷酸二氢钾(B),梯度洗脱(0~10 min,20% A;10~22 min,20%~22% A;22~30 min,22%~29% A;30~50 min,29%~29% A;50~60 min,29%~35% A;60~65 min,35%~40% A;65~75 min,40%~30% A;75~85 min,30%~20%A;85~90 min,20%~80%A);体积流量1 mL/min;柱 温30 ℃;检测波 长203 nm;进样量10 μL;分析时间90 min。
2.6 SOD 活性检测 取发酵液,12 000 r/min 离心30 min后取上清,过0.22 μm 滤膜,得澄清发酵液,未发酵人参匀浆以相同操作方法制得,MRS 益生菌发酵液在相同发酵条件下以MRS 液体培养基发酵后,离心取上清制得。取上述母液,用去离子水制成不同质量分数的样品溶液(1%、5%、10%、20%、50%、100%),利用T⁃SOD 试剂盒测定不同浓度溶液的SOD 活性。
3 结果
3.1 发酵时间对活菌数影响 乳酸菌在初始发酵条件下72 h 内的生长曲线见图1A。由此可知,36 h 为乳酸菌生长的最佳时间,活菌数可达3.5×109CFU/mL,因此选择24~48 h 作为发酵时间区间。
3.2 人参添加量对活菌数影响 由图1B 可知,人参的最佳添加量为8%,活菌数为8.2×109CFU/mL,因此选择人参添加量6%~10%为添加量区间。
3.3 发酵温度对活菌数影响 不同温度对乳酸菌生长的影响见图1C。由此可知,发酵最适温度为28 ℃,活菌数为4.5×1012CFU/mL,因此选择24~32 ℃为发酵温度区间。
3.4 乳酸菌接种量对活菌数影响 乳酸菌接种量对乳酸菌生长的影响见图1D。由此可知,乳酸菌的最佳添加量为3%,活菌数为2.3×1013CFU/mL,因此选择2%~4% 作为接种量区间。
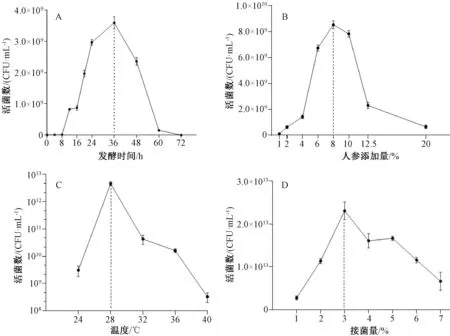
图1 不同条件对乳酸菌活菌数的影响
3.5 Box⁃Behnken 设计 根据单因素试验结果确定因子的水平范围,以活菌数Y作为响应值,进行4 因素3 水平的响应面分析(表2),方差分析见表3。
应用Design Expert 6.0.5 软件对表2 数据进行二次多元回归拟合,得到二次多项回归方程为Y=394.20+0.81A-2.17B+9.83C-27.75D-8.33AB+3.25AC-68.50AD-4.42BC-13.08BD-10.50CD-74.74A2-215.12B2-180.29C2-1.58D2。
该方程的相关系数R2为0.952 3,说明模型拟合程度良好,可用分析和预测。由表3 可知,该模型的F=12.010,P<0.05,较显著;失拟项P=0.362>0.05,不显著;调整复相关系数RAdj2 =0.904 7,说明该模型能解释约90%响应值的变化,拟合程度较好。
由回归方程系数显著性检验可知,模型中一次项D(接种量)极显著,A(发酵时间)、B(人参添加量)、C(温度)影响不显著;二次项A2、B2、C2均处于极显著水平,说明其对响应值影响大;交互项AD处于显著水平,说明发酵时间和接种量之间存在交互作用,并且对活菌数影响较大。
由二元回归方程绘制响应面分析图,见图2。最终确定,最优工艺为发酵时间4 h,人参添加量8.03%,温度28.24 ℃,接种量2%,乳酸菌 活菌数 为4.372 × 1013CFU/mL。
3.6 验证试验 利用优化条件进行3 批试验,测得乳酸菌活菌数的 平均值 为 4.5 × 1013CFU/mL,与预测 值4.372×103CFU/mL相比无显著差异,表明模型可靠,有一定的实用价值。
同时,优化后的活菌数(4.5×1013CFU/mL)比优化前(2.3×1013CFU/mL)提高了1.95 倍,说明所确定的优化方案合理有效,能够显著提高乳酸菌的生长情况。
3.7 HPLC 分析 经乳酸菌发酵后,发酵体系中各人参皂苷含有量均有一定的提高(表4),其中人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rc、人参皂苷Rd 分别提高了69%、62%、73%、34%、64%,成分6 增加了约2 倍,并且经发酵后产生了新成分7。人参皂苷的线性关系考察结果见表5,可知在各自范围内线性关系良好。
3.8 SOD 活性测定 随着溶液质量分数增加,发酵后的人参匀浆上清SOD 活性从29.9 U/mL 上升到51.0 U/mL,并且在50%~100%时从40.5 U/mL 提升至51.0 U/mL,升高约26%。此外,MRS 益生菌发酵液也存在一定的SOD 活性,但与人参发酵液相比较低。见图3。
4 讨论
近年来,利用益生菌对人参进行发酵越来越受到人们的关注[14],本文利用响应面法优化乳酸菌在人参中发酵的最佳条件优化后最佳发酵条件为发酵时间42 h,人参添加量8.03%,温度28.24 ℃,接种量2%,乳酸菌活菌数为4.372×1013CFU/mL,且经过验证,优化结果可靠。
人参皂苷是人参的主要功能性成分[15],利用微生物的葡萄糖苷酶的去糖基化作用,可将其转化为生理和药理活性更强的稀有人参皂苷[14]。经HPLC 分析发现,经发酵后几种人参皂苷含有量均有一定程度的上升,其原因可能为①发酵乳杆菌产生的某些纤维素酶水解了人参木质部细胞的细胞壁,从而提高人参皂苷提取率,导致人参皂苷含有量增加;②发酵乳杆菌可能产生连接酶,从而将已被水解的糖苷重新连接成新的单体皂苷,导致人参皂苷含有量增加,具体还需进一步研究。

表2 试验设计与结果

表3 方差分析
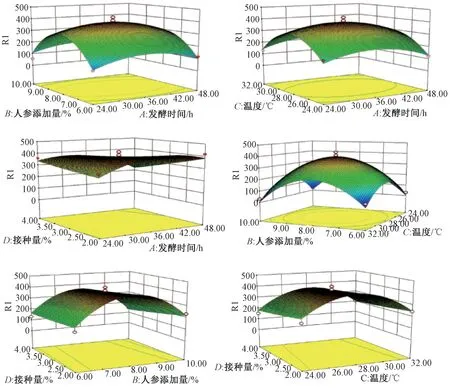
图2 各因素响应面图

表4 发酵前后人参皂苷的变化

表5 人参皂苷线性关系
微生物及其酶的去糖基化作用可将人参皂苷转化为生理、药理活性更强的稀有品种。本实验发现,在发酵前后人参有新物质峰产生,表明发酵乳杆菌中可能存在某些酶类,可对人参皂苷进行转化。
SOD 可对抗与阻断氧自由基对细胞造成的损害,并及时修复受损细胞[16]。SOD 活性实验发现,经发酵后发酵液其活性有一定的提升,说明在发酵时乳酸菌中多种酶类发挥作用,并可能释放一些对人体有益的酶类(如SOD 等)。
综上所述,本实验以发酵乳杆菌为发酵菌株,其安全可靠,对人体健康十分有益,在食品生产加工、临床医疗等领域已经得到广泛关注。人参被称为“百草之王”,在抗肿瘤、提高机体免疫力、改善记忆、延缓衰老等方面具有很好的疗效,乳酸菌发酵该药材有较高的应用价值,可为其深加工奠定基础。

图3 SOD 活性测定结果
