玉米组蛋白乙酰转移酶的鉴定与表达规律分析
2020-10-30马宇馨杜璇玥李肖慧张林旺邢继红董金皋
马宇馨,杜璇玥,李肖慧,任 莹,张林旺,邢继红,2,张 康,2,董金皋,2
(1. 河北农业大学 生命科学学院,河北 保定 071000;2. 河北省植物生理与分子病理学重点实验室/河北农业大学 真菌毒素与植物分子病理学实验室,河北 保定 071000;3. 河北省荣军医院,河北 保定 071000)
组蛋白末端的翻译后修饰包括甲基化、乙酰化、磷酸化、泛素化等[1]。其中,组蛋白的乙酰化修饰是表观遗传修饰的重要组成部分,这一过程主要是由组蛋白去乙酰转移酶(Histone deacetylases, HDACs)和组蛋白乙酰转移酶(Histone acetyltransferases,HATs)共同完成的[2]。组蛋白乙酰转移酶将乙酰辅酶A 中的乙酰基转移到特定的赖氨酸残基上,中和赖氨酸侧链的正电荷,减少与带负电荷DNA 的亲和性,增加侧链的疏水体积,破坏氢键的形成能力,使核小体构象变得松弛,最终促进转录因子与DNA 分子的结合,激活特定基因的转录[2-3]。组蛋白去乙酰转移酶的作用与此相反,其作用是抑制基因的转录。在植物中,赖氨酸乙酰化除了发生在组蛋白上,还发生在细胞质、叶绿体和线粒体等细胞内的各种非组蛋白中[3]。
根据HATs 的结构和性质,植物HATs 可以分为GNAT 家族(GCN5 相关的N 端乙酰转移酶)、MYST 家 族(MOZ、Ybf2/Sas3、Sas2、Tip60)、p300/CBP 家族、TAFII250 家族以及核受体共激活因子(SRC-1、ACTR、TIF2)亚家族[4]。根据HATs 在细胞核内的定位和对底物的特异性,又可将其分为A 型和B 型,A 型HATs 主要在细胞核中起作用,B 型HATs 主要在细胞质中起作用[5]。研究发现,HATs 在植物的生长、发育和胁迫反应过程中发挥重要的调控作用。例如,拟南芥中AtHACs 蛋白家族参与调控植株的开花时间,其中AtHAC1 通过乙酰化修饰FLC 的上游因子——自主通路蛋白(FPA),从而影响FLC 所在区域染色质的重塑,进而调节FLC 的转录水平,在拟南芥开花时间调控过程中发挥主要作用[6-8]。拟南芥组蛋白乙酰转移酶GCN5 参与调控lncRNA AT4 的乙酰化水平和转录水平,从而调控拟南芥在缺磷条件下对磷的重新分配[9]。水稻组蛋白乙酰转移酶GCN5 的抑制表达会引起水稻根冠分生组织的细胞分裂降低,进而影响根的形态发育[10]。菜心p300/CBP 乙酰转移酶基因BrcuHAC1能提高植物应对外界环境变化的能力[11-13]。进一步研究发现,HATs 大多以复合物的形式存在,参与转录激活、基因沉默、细胞周期调节、DNA 复制、修复和染色体组装等多种细胞过程[1,14]。此外,HATs 还参与光反应过程和乙烯信号途径[15-16]。
目前,玉米组蛋白乙酰转移酶HATs 家族的系统研究尚未见报道。本研究利用同源比对的方法,获得了玉米组蛋白乙酰转移酶HATs 家族基因;利用生物信息学方法,对玉米HATs 家族基因进行系统进化分析、保守结构域分析、组织表达特性分析以及生物和非生物胁迫下的表达规律分析;并利用Real-time PCR 技术,检测HATs 家族基因在激素处理后不同时间下的表达规律,为阐明玉米HATs 家族基因在玉米中的功能及其调控机制奠定基础。
1 材料和方法
1.1 材料
供试玉米自交系为B73,来源于河北农业大学真菌毒素与植物分子病理学实验室。
1.2 基因序列数据的下载
在玉米基因组数据库MaizeGDB(https://www.maizegdb.org,基因组版本:RefGen_v3.27)下载玉米(Zea mays)完整的蛋白质序列数据信息,从拟南芥信息资源数据库TAIR(www.arabidopsis.org)和水稻基因组注释计划数据库RGAP(http://rice.plantbiology.msu.edu/)获得拟南芥及水稻HATs 家族成员的蛋白质序列信息。以玉米所有蛋白序列为库,利用BLAST 软件对拟南芥和水稻种的HATs 家族成员进行分析,鉴定玉米HATs 家族成员。
1.3 系统发育树的构建
通过ClustalX 软件对拟南芥、水稻和玉米的组蛋白乙酰转移酶家族基因的蛋白质序列进行多重序列对比,利用MEGA7.0 中的临近法构建系统发育树,bootstrap 值设置为1 000。
1.4 保守结构域分析
利用玉米蛋白质数据,获得组蛋白乙酰转移酶家族基因的蛋白质序列。通过在线网站SMART(http://smart.embl-heidelberg.de/)和Pfam(http://pfam.xfam.org)共同确定HATs 家族基因的结构域,并利用IBS1.0.3 工具绘制基因的保守结构域。
1.5 组织表达特性分析及生物/非生物胁迫下的表达分析
利用从NCBI(https://www.ncbi.nlm.nih.gov/)中的SRA 数据库下载的数据,对玉米HATs 家族基因在不同组织以及生物胁迫和非生物胁迫下的表达谱分析,挖掘玉米HATs 家族基因的表达规律。
1.6 不同激素处理下的基因表达分析
在玉米生长3周时,用10 mmol/L茉莉酸和10 mmol/L 水杨酸处理玉米幼苗,分别在处理后的0、3、6、12、24 h 取 样。 利 用Real-time PCR 技 术,分析玉米HATs 家族基因在茉莉酸和水杨酸处理下的表达情况。Real-time PCR 体系:PCR Mix 7 μL、cDNA 2 μL、引物各0.5 μL,总计10 μL; Real-time PCR 程序:94 ℃预变性1 min;94 ℃变性30 s,55 ℃退火15 s,72 ℃延伸30 s,循环30 次。采用比较Ct 值法(2-ΔΔCt法),分析基因的相对表达水平,试验所用引物见表1。
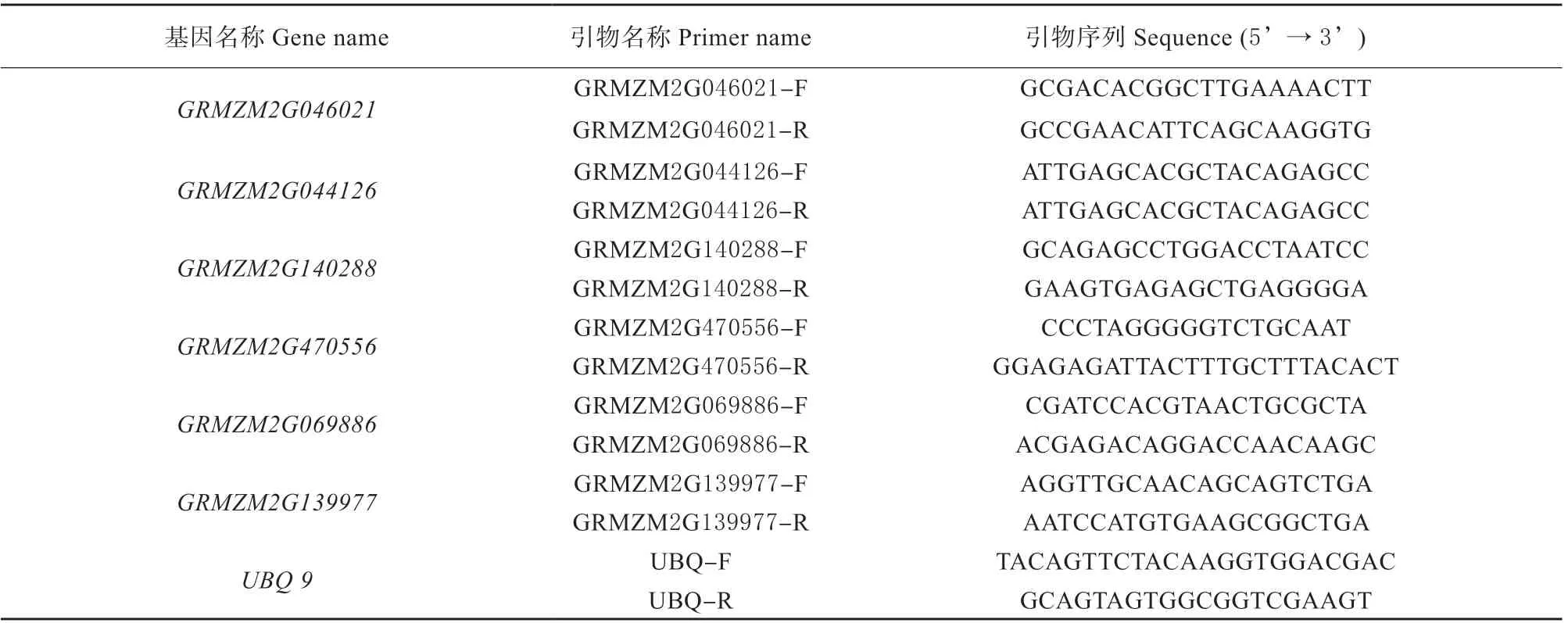
表1 Real-time PCR 所用引物Table 1 Primers used in Real-time PCR
2 结果与分析
2.1 玉米HATs 家族基因的鉴定
从玉米基因组数据库MaizeGDB(https://www.maizegdb.org,基因组版本:RefGen_v3.27)获得玉米HATs 家族基因的位置信息、序列长度及其编码蛋白的氨基酸;利用在线服务器ExPASy(http://web.expasy.org/protparam)中的生物信息学软件ExPASy-ProtParam tool,对玉米HATs 家族基因所编码的蛋白质的分子质量和等电点这些理化性质进行分析。结果发现,玉米HATs 家族基因包含6 个家族成员。从各基因所编码的蛋白来看,其长度差别较大, 其 中GRMZM2G046021、GRMZM2G044126、GRMZM2G140288 长 度 分 布 在444 ~959 aa,相对分子质量相对较小;GRMZM2G470556、GRMZM2G069886、GRMZM2G139977 长度分布在 1 214 ~1 720 aa,相对分子质量较大。从预测的HATs 蛋白的等电点数据可以得知,6 个玉米HATs 家族蛋白均呈酸性,且基本在4.8 左右(见表2)。

表2 玉米中的HATs 家族基因信息Table 2 Information of HATs family genes in maize
2.2 玉米HATs 家族基因的系统发育分析
为了明确玉米HATs 家族成员之间的系统发育关系,试验将拟南芥、水稻中已经鉴定的HATs 家族成员的蛋白质序列进行多序列比对,并分别以拟南芥的HATs 家族基因的亚分类为标准,利用MEGA7.0软件,选取临近法构建系统发育树。结果发现,玉米HATs 家族成员可以被分为3 个亚家族,分别为MYST、GANT 和CBP 亚家族。其中,CBP 亚家族中包含GRMZM2G139977、GRMZM2G470556和GRMZM2G069886,GANT 亚 家 族 中 包 含GRMZM2G044126 和GRMZM2G140288,MYST亚家族包含GRMZM2G046021(图1)。
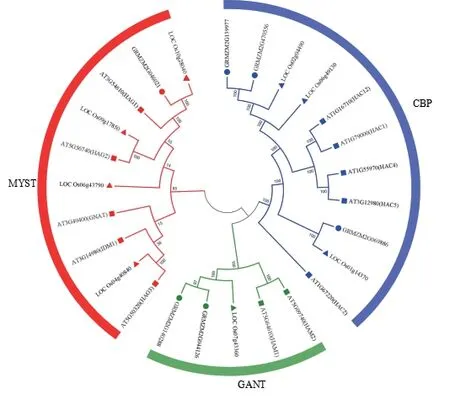
图1 拟南芥、水稻和玉米组蛋白乙酰化酶(HATs) 系统发育树Fig.1 Phylogenetic tree analysis of histone acetyltransferases (HATs) in Arabidopsis, rice and maize
2.3 玉米HATs 家族基因的保守结构域分析
通过SMART(http://smart.embl-heidelberg.de/)和Pfam(http://pfam.xfam.org)数据库对玉米的HATs 家族基因的蛋白质保守结构域进行分析,然后利用IBS1.0.3 工具对蛋白质保守结构域进行绘制。结果发现,玉米HATs 家族蛋白均包含多个保守的结构域,且同一亚家族的蛋白所包含的结构域高度相似。其中,CBP 亚家族GRMZM2G139977、GRMZM2G470556 和GRMZM2G069886 蛋 白 均 包含ZnF_TAZ 和KAT11 保守结构域,GANT 亚家族的GRMZM2G044126 和GRMZM2G140288 均 包 含CHROMO 和ZnF_C2H2 保守结构域(图2)。

图2 玉米组蛋白乙酰化酶家族成员的保守结构域分析Fig.2 Conserved domain analysis of HATs family proteins in maize
2.4 玉米HATs 家族基因的组织表达特性分析
使用SRA 数据库中的转录组数据,对玉米HATs 家族基因的组织表达特异进行分析,结果发现,玉米HATs 家族基因的表达模式可分为2 个簇。第一簇包括GRMZM2G046021 和GRMZM2G044126,GRMZM2G046021 在茎尖分生组织、初始发育的小穗和胚中表达较高,GRMZM2G044126 在初始发育的小穗和胚中表达较高,在叶、种子和茎尖分生组织中表达水平低于GRMZM2G046021。第二簇所包含的4 个基因在花粉中的表达水平明显低于第一簇的基因,其中,GRMZM2G140288 在叶尖和苗期叶子中表达水平较高,与另外3 个基因相比具有明显的组织特异性(见图3)。

图3 玉米HATs 家族基因在不同组织中的表达谱 Fig.3 The expression pattern of maize HATs family genes in maize different tissues
2.5 玉米HATs 家族基因在生物和非生物胁迫下的表达分析
对玉米HATs 家族基因在高温、低温、盐、紫外线和干旱胁迫下的转录组数据进行分析,结果发现,玉米HATs 家族基因在不同非生物胁迫下呈现出不同的表达规律(图4)。其中,高温胁迫下,GRMZM2G046021 上调表达,其余基因均下调表达;低温胁迫下,GRMZM2G470556 上调表达,其余基因均下调表达;盐胁迫下,GRMZM2G046021、GRMZM2G044126 上调表达,其余基因均下调表达;紫外线胁迫下,所有基因均下调表达;干旱胁迫下,GRMZM2G140288 下调表达,其余基因均上调表达。推测,玉米HATs 家族基因可能通过调节组蛋白乙酰化水平参与玉米对非生物胁迫的响应。
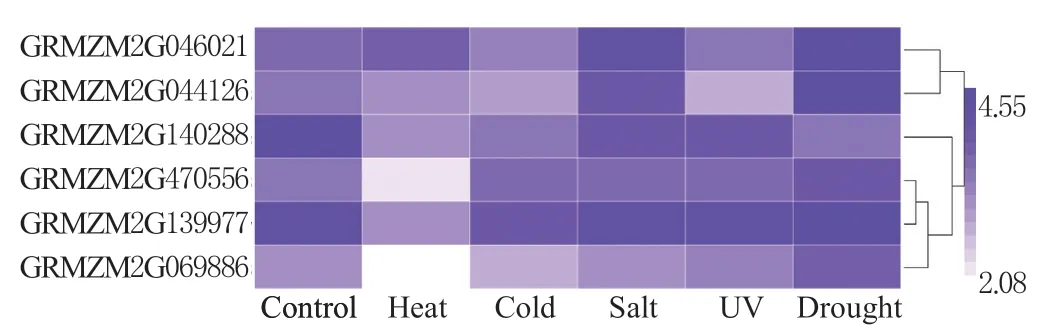
图4 玉米HATs 家族基因在热、冷、盐、紫外线 和干旱胁迫下的表达模式 Fig.4 The expression pattern of HATs family genes under heat, cold, salt, UV and drought stress
对玉米HATs 家族基因在拟轮枝镰孢侵染玉米籽粒过程中的表达规律进行分析,结果发现,玉米HATs 家族基因在病菌侵染的4 和12 h 呈现较高的表达水平,但在病菌侵染的24、48 和72 h 呈现明显的下调表达趋势,其中GRMZM2G044126 和GRMZM2G140288 在病菌侵染的整个过程中始终处于较高的表达水平;GRMZM2G470556 在病菌侵染的整个过程中始终处于较低表达水平,且在病菌侵染的24、48 和72 h 不表达。推测,玉米HATs 家族基因通过调节组蛋白乙酰化水平参与玉米对生物胁迫的响应。
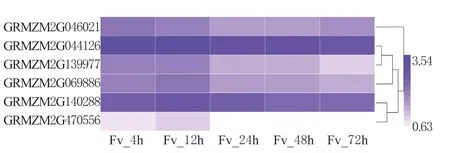
图5 玉米HATs 家族基因在拟轮枝镰孢 侵染玉米籽粒后的表达模式 Fig.5 The expression pattern of HATs family genes with Fusarium verticillioides infection in maize kernel
2.6 玉米HATs 家族基因在不同激素处理下的表达分析
利用MeJA(茉莉酸)和SA(水杨酸)对3 周的玉米幼苗进行处理,在不同时间点(0、3、6、12、24 h)取样,检测玉米HATs 家族基因的表达水平。结果发现,在茉莉酸处理中,玉米HATs 家族大多数基因在处理3 h 表达水平呈现明显的下调趋势,处理6 h 有短暂的上升,在处理12、24 h 表达水平又开始下降,最终维持在较低水平。GRMZM2G046021 在茉莉酸处理3 h 呈现明显的诱导表达,在处理6 h 后表达水平呈现明显下降趋势,与该家族中其他基因的表达规律明显不同(图6)。

图6 经茉莉酸处理后玉米HATs 家族基因的表达分析Fig.6 Expression level of HATs family genes with jasmonic acid treatment in maize
在水杨酸处理中,玉米HATs 家族基因基本上在处理3 h 表达水平呈现明显的下调趋势,在6、12 h 表达水平略有恢复,最终在24 h 又降低到较低水平。其中,GRMZM2G140288 在水杨酸处理3 h 后表达水平明显下调,在处理12 h 表达水平有短暂的上调,在处理24 h 表达水平最低(图7)。

图7 经水杨酸处理后玉米HATs 家族表达量Fig.7 Expression level of HATs family genes with salicylic acid treatment in maize
3 讨论与结论
组蛋白乙酰转移酶(HATs)是一类在核心组蛋白(H2A、H2B、H3 和H4)中添加乙酰基的酶[16],从而调节基因表达和基因组的稳定性,在植物生长发育和对环境胁迫的反应中发挥关键调控作用[17]。拟南芥、水稻HATs 家族基因的研究较为深入,已明确了其HATs 家族基因的成员、系统进化关系以及部分基因在植物生长发育及其响应生物和非生物胁迫过程中的作用。但是,玉米HATs 家族基因的系统研究至今尚未见报道。本研究对玉米基因组进行了系统的分析,鉴定出6 个玉米HATs 家族基因,系统发育分析将其分为MYST、GANT 和CBP 共3个亚家族,并发现玉米HATs 基因家族与拟南芥和水稻HATs 家族基因在各个亚家族的数量分布是类似的,且玉米HATs 家族蛋白的保守结构域的数量和排列在同一亚族中相对保守。资料显示,GANT亚家族含有GCN5 相关的N 端乙酰转移酶,GCN5是Spt-Ada-Gcn5(SAGA)乙酰转移酶和转录适配器ADA 的催化亚基[18]。在拟南芥中,GCN5 和ADA2 能够参与对极端温度的响应[17],GCN5 突变后会导致植物形态的多种突变[19]。MYST 亚家族一般含有MOZ、Ybf2/Sas3、Sas2、Tip60 等保守结构域[20],在酵母、人和果蝇中的研究相对较多,主要作为发育调节剂其作用[21]。CBP 亚家族参与调控细胞的生殖和生长发育过程[22]。本研究中,MYST、GANT 和CBP 亚家族中各玉米HATs 家族基因的功能还需要进一步的深入研究予以鉴定。
本研究中,玉米HATs 家族基因在不同组织和响应生物/非生物胁迫过程中的表达水平呈现出明显的差异,推测玉米HATs 家族基因在玉米生长发育以及响应生物和非生物胁迫过程发挥重要的作用。其中,玉米CBP 亚家族包含的3 个组蛋白乙酰转移酶在花粉中变化明显,所以推测它们与植物的生殖生长有关;GRMZM2G044126 和GRMZM2G140288在拟轮枝镰孢侵染玉米籽粒过程中始终处于较高的表达水平,且在病菌侵染的24、48 和72 h 后呈现明显的下调表达趋势,推测其与玉米响应病菌侵染过程密切相关。此外,本研究用茉莉酸和水杨酸处理玉米幼苗,发现了玉米HATs 家族基因在茉莉酸和水杨酸处理后表现出不同的表达规律,推测玉米HATs 家族基因可能参与了茉莉酸和水杨酸介导的植物防御反应。研究结果为阐明玉米HATs 家族基因的功能及其调控机制奠定了基础。
