小麦NF-Y 型转录因子基因TaNF-YC1 介导 烟草植株抵御渗透协迫功能研究
2020-10-30马自飞宋文腾史美华白菁华路文静
马自飞,宋文腾,史美华,白菁华,路文静,肖 凯
(1. 河北农业大学 生命科学学院,河北 保定 071001; 2. 河北农业大学 农学院,河北 保定 071001)
转录因子 (TFs) 又称反式作用因子,通过与下游启动子区顺式作用元件结合,启动基因转录,在介导植株生长、发育和抵御非生物逆境中发挥重要功能[1]。核因子 (NF-Y) 由NF-YA、NF-YB 和NFYC 3 种亚基组成三聚体形式,与细胞核内下游基因启动子中顺式元件CCAAT 盒特异互作,参与对植株生物学过程的调节[2]。对小麦种属研究表明,该种属含有10 个NF-YA 家族基因,11 个NF-YB 家族基因和14 个NF-YC 家族基因[3]。功能鉴定结果表明,NF-Y 家族成员广泛参与植株生长、发育和逆境抵御等众多生物学过程的调控。其中,NF-YA家族基因参与植株配子发生、胚胎发育、种子发育和开花[4-6]、豆科植物器官建成和共生根瘤等过 程[7];NF-YB 家族成员与植株开花[8]、胚乳发 育[9]、根系伸长[10]、光合作用和光形态建成过程密切相关[11];NF-YC 蛋白参与花器官建成和细胞增殖等生物学过程的调节[12]。此外,NF-Y 家族成员通过调控下游逆境防御基因转录,广泛参与植株适应和防御非生物逆境过程。如拟南芥AtNF-YA5在气孔保卫细胞呈干旱诱导表达模式,通过加快气孔关闭速率增强植株抗旱功能[13]。大豆GmNFYA3 表达受到多种胁迫处理诱导,过表达该基因株系中部分干旱响应基因表达上调,植株水分利用效率显著提高[14]。表明植物NF-Y 家族成员在介导植株抵御非生物逆境能力中发挥重要调控效应。小麦是我国重要粮食作物,增强该作物抗旱耐盐能力对于保障我国粮食安全具有重要实践价值。本研究针对迄今有关麦类种属NF-YC 家族成员功能研究尚少的现状,以前期鉴定的小麦NF-YC 家族 成员TaNF-YC1 为基础,对该基因分子特征、应答渗透胁迫表达模式及介导植株抵御渗透胁迫能力进行研究,旨在为今后小麦抗旱和耐盐遗传改良提供理论依据。
1 材料与方法
1.1 TaNF-YC1 的系统进化特征分析
利用Protparam 在线分析供试基因 TaNF-YC1 ( 登录号:KJ862216) 编码蛋白的等电点和分子量。以TaNF-YC1 cDNA 序列为基础,对NCBI中GenBank 进行同源基因查找,获得与该小麦转录因子基因同源的植物种属基因,采用DNAStar软件建立供试基因与其植物种属同源基因的系 统进化树。
1.2 TaNF-YC1 应答渗透胁迫的表达模式研究
以小麦品种‘石麦22’为材料,参照本实验室建立的方法,用MS 营养液水培小麦幼苗。三叶期时,在营养液内补充5%聚乙二醇(PEG-6000)和200 mmol/L NaCl 进行干旱和盐分处理。处理1、3、 9 和27 h 后收获根系样本,研究TaNF-YC1 应答渗透胁迫的表达模式;为揭示供试基因对恢复处理的响应,将部分经27 h 渗透胁迫处理的幼苗转入正常MS 营养液进行恢复处理,处理后1、3、9 和27 h收获根系样本。以渗透胁迫处理前 (0 h) 根系作对照。采用TRIzol 试剂提取样本总RNA,采用反转录酶M-MLV 进行样本mRNA 反转录合成cDNA。参照Guo 等的方法[15],鉴定各样本TaNF-YC1 转录本数量,扩增引物见表1。以小麦组成型表达基因Tatubulin 作为均一化目标基因转录本内标,扩增该内标基因引物见表1。各处理下目标基因和内标转录本检测均进行3 次重复。

表 1 试验用PCR 引物Table 1 PCR primers used in this study
1.3 TaNF-YC1 编码蛋白亚细胞定位研究
通过检测TaNF-YC1 与绿色荧光蛋白(Green Fluorescent Protein,GFP)报告基因融合蛋白(TaNF- YC1-GFP)在细胞内位置,明确TaNF-YC1 蛋白经内质网分选后的亚细胞定位特征。方法如下:采用DNA 重组技术构建表达载体 pCAMBIA1300-TaNF-YC1-GFP。采用PCR 技术扩增TaNF-YC1 编码区,扩增引物见表1。采用农杆菌介导法将表达质粒转化烟草表皮细胞,转化后48 h,用激光共聚焦显微镜 (FV10-ASW, OLYMPUS) 检测融合蛋白信号。以pCAMBIA1300-GFP 空载体作对照。
1.4 干旱和盐分处理下TaNF-YC1 转基因植株表型和生物学性状分析
以干旱处理小麦根系cDNA 为模板,采用RTPCR 技术扩增TaNF-YC1 的编码阅读框 (ORF) 正、反义序列。采用的引物见表1。利用DNA 重组技术,构建基因正义和反义表达质粒。利用农杆菌介导的遗传转化技术,建立将TaNF-YC1 正、反义序列转化至烟草(cv. Wiscosin 35)的转基因植株。具体过程参照Sun 等的方法[16]进行。
以典型转化TaNF-YC1 T3 正义烟草植株Sen 1、反义烟草植株Anti 1 和野生型(WT)烟草植株为材料,参照Sun 等的方法[17],采用溶液培养法培养供试材料至5 叶期。然后,部分植株继续进行正常培养处理,另将部分长势均匀植株转入含有5% PEG-6000 和150 mmol/L NaCl 的MS 营养液中进行干旱和盐分处理。正常生长和渗透胁迫处理4 周,用相机对不同处理供试材料照相,记录植株长势。另选取各处理供试材料代表性植株3 株称取鲜重,然后将植株样本烘干称重,获得植株干重。各处理转化株系和WT 测试均进行3 次重复。
1.5 干旱和盐分处理下转基因植株光合参数测定
以正常生产和逆境处理下转基因植株上位功能叶为测试对象,参照Guo 等的方法[15],测定不同处理下转基因植株和WT 的光合参数。包括光合速率 (Pn)、光系统II 光化学活性 (ΨPSII) 和叶绿素非光化学淬灭系数 (NPQ)。各处理转化株系和WT 测试均进行3 次重复。
1.6 干旱处理下转基因植株叶片气孔关闭特征和失水率测定
以正常生长条件下TaNF-YC1 正义烟草转基因株系Sen 1、反义烟草转基因株系Anti 1 和WT 为材料,将供试材料进行干旱处理,利用显微镜观测处理前 (0 h)和处理后0.5、1 和2 h 各时间点的气孔开度特征。测试不同时间点 (0 min、10 min、20 min、 30 min、1 h、1.5 h、2 h 和3 h) 叶片鲜重,计算供试材料植株叶片的失水率。各处理转化株系和WT测试均进行3 次重复。
1.7 数据统计学分析
采用Microsoft Excel 和DPS 7.05 软件处理和统计分析数据。各测定数据均源于3 次测试重复结果。
2 结果与分析
2.1 TaNF-YC1 系统进化特征
TaNF-YC1 cDNA 全长839 bp,开放阅读框为771 bp,编码256 个氨基酸残基。该基因编码蛋白分子量为28.44 kD,等电点pI 为5.12。蛋白结构保守域预测分析表明,TaNF-YC1 蛋白含有一个保守HAP5 结构域 (87 ~183 aa),归属于CCAAT 盒结合的NF-Y 型转录因子家族成员。系统进化分析表明,TaNF-YC1 与大豆、百慕大草和玉米等植物种属的NF-YC 家族基因在核苷酸序列组成上具有较高一致性 (图1),TaNF-YC1 可能与上述成员具有相似的进化途径。

图1 TaNF-YC1 与其植物种属同源基因的系统进化关系Fig.1 The relations among TaNF-YC1 and its homologous genes in plant species
2.2 TaNF-YC1 应答渗透逆境表达模式
表达模式分析表明,正常生长条件下,小麦根系中的TaNF-YC1 转录水平相对较低;干旱和盐分处理下,TaNF-YC1 表达被诱导,表现在27 h 处理时间内该基因呈现上调表达模式;将渗透胁迫植株转入正常生长条件进行恢复处理后,该基因表达逐渐下调 (图2)。上述结果表明,TaNF-YC1 表达呈典型的渗透胁迫应答模式。
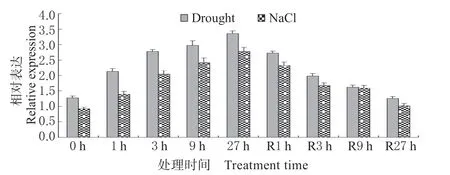
图2 TaNF-YC1 应答干旱和盐分胁迫逆境的表达模式Fig. 2 Expression patterns of TaNF-YC1 under the drought and salt treatments
2.3 TaNF-YC1 编码蛋白亚细胞定位及渗透逆境处理下转基因植株生长特征
采用试验方法鉴定TaNF-YC1-GFP 融合蛋白的亚细胞位置。结果表明,融合蛋白GFP 信号仅在细胞核内得到检测 (图3A),这与TaNF-YC1 归属转录因子在核中调控下游基因转录的特征相吻合。采用溶液培养法,鉴定了遗传转化TaNF-YC1 对植株抵御干旱和盐分逆境的影响。结果表明,与野生型(WT)相比,正义转化供试基因的烟草植株 (Sen 1)干旱和盐分处理下植株长势明显增强 (图3B);与此相反,干旱和盐分处理下,反义转化TaNF-YC1 的烟草植株 (Anti 1) 则较WT 植株长势显著变差 (图3B)。结果表明TaNF-YC1 在介导植株抵御干旱和盐分胁迫过程中发挥着重要生物学功能。
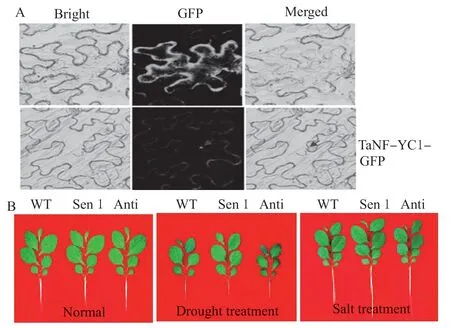
图3 TaNF-YC1 编码蛋白亚细胞定位及转基因植株在干旱和盐分处理下植株长势Fig. 3 The subcellular location of TaNF-YC1 and phenotypes of transgenic TaNF-YC1 plant under drought and salt treatments
对不同处理下转基因植株和WT 的单株鲜重、干重和叶面积测定结果表明,正常生长条件下,转基因植株与WT 的上述植株性状无明显差异 (图4A)。干旱和盐分处理下,与WT 相比,Sen 1 单株鲜重和干重增加,植株上、中和下位叶叶面积增大 (图4B);Anti 1 则表现为单株鲜重和干重降低,植株各位置叶片的叶面积减小 (图4C)。上述植株性状表现特征与前述植株长势相一致。

图4 干旱和盐分处理下TaNF-YC1 转基因植株生长参数Fig.4 Plant growth traits of the TaNF-YC1 transformed plant under drought and salt treatments
2.4 干旱和盐分处理下转基因植株光合特性
对正常生长和干旱及盐分处理下转基因植株的光合碳同化特性进行了测定。从结果可看出(图5),与WT 相比,正常生长条件下转基因植株 (Sen 1 和Anti 1) 的光合速率 (Pn)、光系统II 光化学效率 (ΨPSII) 和叶绿素非光化学淬灭系数 (NPQ) 与WT 相似。但在干旱和盐分处理下,与WT 相比,Sen 1 植株 Pn和ΨPSII 显著增高、NPQ 降低,Anti 1 植株Pn 和ΨPSII 显著下降、NPQ 增高。结果表明,TaNF-YC1对渗透逆境下植株光合能力具有较大的调控效应。

图 5 盐分和干旱胁迫下转基因植株的光合参数Fig.5 Photosynthetic parameters of the transgenic plant under salt and drought treatments
2.5 干旱处理下转基因植株叶片气孔关闭及失水特征
以干旱处理下转基因植株和WT 植株叶片为材料,对TaNF-YC1 介导植株气孔关闭特征进行了研究。结果表明,在2 h 逆境处理时间内,随着处理进程,供试材料气孔均呈开度逐渐变小特征。与WT 相比,正义烟草植株 (Sen 1) 气孔随处理进程的关闭速率加快,而反义植株 (Anti 1) 气孔随处理进程的关闭速率变慢 (图6A)。表明TaNF-YC1 对干旱胁迫下的植株气孔运动特征产生重要调控。对干旱处理下转基因植株和WT 叶片失水率测试结果表明,随着3 h处理进程,Sen 1 失水率低于WT,而Anti 1 的失水率则高于WT (图6B)。表明TaNF-YC1 调控干旱处理下气孔运动进而调节植株持水能力,是其介导植株抵御渗透胁迫的重要基础。

图6 渗透胁迫处理下转基因植株的气孔关闭特征和 叶片失水率Fig. 6 Stomatal closure properties and leaf water loss rates in transgenic plant under osmotic stress treatments
3 讨论与结论
特定NF-Y 型转录因子家族基因通过在转录水平上对非生物逆境产生应答,增强蛋白翻译效率和功能三聚体 (NF-YA/YB/YC) 数量及生物学功能[2-3]。 本研究对小麦NF-YC 家族成员TaNF-YC1 研究表明,该基因呈典型的干旱和盐分逆境表达模式,表现为上述渗透胁迫处理下转录本数量增多;逆境诱导增多的该基因转录本在恢复正常处理下数量随处理进程不断减少。这表明,TaNF-YC1 通过在渗透胁迫下增强表达,参与植株对渗透胁迫的抵御过程。有关该基因应答渗透胁迫的转录机制有待进一步探讨。
NF-YC 蛋白除调控植株花器官建成、共生真菌侵染宿主和细胞增殖[18]等生物学过程外,在介导植株抵御非生物逆境中也发挥着重要调节作用。对模式植物拟南芥NF-YC1 研究表明,该NF-YC 家族成员与下游低温应答基因启动子顺式作用元件结合,启动低温逆境下的基因转录,增强植株适应和抵御低温逆境的能力[2,12]。本研究利用TaNF-YC1转基因植株,对该基因介导植株抵御渗透胁迫的生物学功能进行了鉴定。结果表明,正、反义表达该小麦NF-Y 家族基因的烟草植株,抵御干旱和盐分逆境的能力发生明显改变。表现为上调表达该基因的转基因植株抵御渗透胁迫的能力显著增强。因此,TaNF-YC1 在植株抵御渗透胁迫逆境中发挥正调控效应,该转录因子基因可作为创制小麦等麦类作物优良抗逆品系的重要基因资源。
干旱等渗透胁迫下植株叶片气孔关闭速率加快,能有效减少植株水分散失,维持植株体内相对良好的水分状况[19],进而提高干旱等渗透胁迫条件下植株的光合碳同化能力和干物质生产力。研究表明,拟南芥中AtNF-YA5 的表达受到干旱、盐分和渗透压力的强烈诱导,AtNF-YA5 的转录调控通过ABA依赖型途径和miR169 的转录后调控。在保卫细胞中,AtNF-YA5 调节气孔孔径大小,提高干旱耐受性并减少叶片水分缺失;在非保卫细胞中,AtNF-YA5可能通过激活参与氧化应激反应的基因来提高对干旱的耐受性[13]。正义转基因植株 (Sen 1) 随干旱处理进程的持续气孔关闭速率加快,气孔开度呈逆境下迅速变小特征;与此相反,反义转基因植株 (Anti 1) 随着上述渗透胁迫处理进程,气孔关闭速率减慢。与上述结果相对应,随干旱处理叶片进程,Sen 1 失水率较WT 下降,而Anti 1 失水率较WT 提高。这表明,TaNF-YC1 介导植株抵御渗透逆境能力的增强,与其加快气孔关闭进而改善植株的持水能力有关。增强的植株持水力进一步改善上调表达植株的光合碳同化能力、干物质生产和植株长势。拟南芥中报道At-NF-YC2 和At-NF-YB3 首先在细胞质中形成异源二聚体,然后转移至细胞核与At-NF-YA4相互作用形成异源三聚体。本研究通过对TaNFYC1-GFP 荧光蛋白在烟草表皮细胞中的瞬时表达表明TaNF-YC1-GFP 荧光蛋白位于细胞核中,这与先前关于CdtNF-YC1 的报道一致[20]。在大豆中,经过NaCl、外源ABA 和PEG 处理,GmNF-YA3 的转录本升高,过量表达GmNF-YA3 的拟南芥转基因植株通过调控常见的干旱响应基因显示出叶片失水减少和耐旱性增强,并增加了ABA 生物合成(ABA1和ABA2)、ABA 信号传导(ABI1 和ABI2)和胁迫响应(RD29A 和CBF3)基因的表达[14]。前人研究表明,脱落酸 (ABA) 信号转导通路在介导渗透逆境下ABA 诱发气孔运动、改善植株抵御干旱逆境能力中发挥重要作用[21]。有关TaNF-YC1 介导渗透逆境下叶片气孔关闭特征及其与ABA 信号通路的联系有待进一步探讨。
本研究表明TaNF-YC1 与部分植物种属NF-YC家族基因具有高度序列一致性特征。该基因呈典型的渗透胁迫逆境表达模式,编码蛋白定位于细胞核内。上调表达TaNF-YC1 显著增强植株抵御干旱和盐分逆境的能力,表现为植株长势增强、干重增加、光合能力提高、干旱处理下气孔关闭速率加快,植株失水速率减慢。TaNF-YC1 研究结果将丰富对小麦抵御渗透胁迫分子机制的认识,并为小麦抗旱、耐盐遗传改良提供有价值的基因资源和理论依据。
