无创产前检测实验过程中的质量控制探讨
2020-10-29许泽辉谢文妍崖娇练蔡鹏飞罗世强徐玉婵严提珍
许泽辉 谢文妍 崖娇练 蔡鹏飞 罗世强 徐玉婵 蔡 稔 严提珍 唐 宁
1 广西柳州市妇幼保健院医学遗传科 545001; 2 柳州市出生缺陷预防与控制重点实验室
无创产前检测(Non-invasive Prenatal Testing,NIPT)技术是一项先进的产前筛查技术,仅需采集孕妇静脉血即可完成胎儿唐氏综合征(T21)、爱德华综合征(T18)和帕陶氏综合征(T13)三大染色体疾病的检测。早在1997年,香港大学卢煜明教授首次报道[1]了胎儿细胞可以通过胎盘渗透到母血中,被母体免疫系统破坏,胎儿游离DNA从而残留在母体血浆中。利用高通量测序技术(High-throughput sequencing)对母体外周血浆中的游离DNA片段(包含胎儿游离DNA)进行测序,并将测序结果进行生物信息技术分析,可以从中得到胎儿的遗传信息,从而检测胎儿是否患有染色体病。
2016年11月,国家卫生计生委在总结NIPT临床试点工作经验的基础上,结合国际科研成果,制定了我国《孕妇外周血胎儿游离DNA产前筛查与诊断技术规范》,指导全国规范有序地开展NIPT。越来越多的医院选择与第三方检测机构合作的方式[2],在保证NIPT实验室具有产前诊断资质、临床基因扩增检验实验室资质和母婴保健技术服务执业许可证的前提条件下进行实验[3]。整个NIPT实验流程都可以在医院实验室独立完成,并出具检测报告。孕妇外周血胎儿游离DNA的提取质量是极其重要的,但是针对NIPT实验流程的具体步骤鲜少有人探讨。本实验室通过比较由同一实验员进行DNA提取和DNA文库构建两个实验步骤获得的样本浓度与分别由不同实验员独立操作获得的数据,利用qPCR进行浓度关联性对比,研究NIPT中孕妇外周血胎儿游离DNA提取的浓度与DNA文库构建定量后浓度的关系,探讨在NIPT实验操作步骤中提高DNA提取质量、文库构建的转化率等方面的质量控制经验。
1 对象与方法
1.1 观察对象 收集2018年1—12月经知情同意的正常产检的孕妇外周血标本7 125份,送达的外周血样本均按照外周血运送规则进行采集、存放和运输。能够进行孕妇外周血胎儿游离DNA提取与DNA文库构建实验的样本必须满足外周血血浆分离后没有出现凝血、严重溶血,送达的外周血样本时间距采血时间不超过72h的原则,才能继续实验[4]。
1.2 实验方法
1.2.1 孕妇外周血胎儿游离DNA提取:取冻存在-20℃冰箱已经分离好的外周血血浆1支,离心力17 900g离心5min,待提取DNA。按提取个数准备对应的BD管数量后,在BD管中加入磁珠、裂解液等相关提取试剂后,将离心好的血浆上清液加入到BD管中,然后使用垂直混匀仪混匀,接着用磁力架沉淀BD管中的磁珠。生物磁珠是具有细小粒径的超顺磁微球,其具有丰富的表面活性基团,可以与各类生化物质偶联,并在外加磁场的作用下实现分离。用于DNA分离提取的磁珠为硅基磁珠,利用氧化硅纳米微球的超顺磁性,在Chaotropic盐(盐酸胍、异硫氰酸胍等)和外加磁场的作用下,DNA分子可被特异高效地吸附[5]。因此,血浆胎儿游离DNA已吸附于经垂直混匀的磁珠里。将沉淀好的磁珠转移至放在磁力架上的中转管中,吸走上清液,随后加入清洗液清洗磁珠,随后吸走残液加入洗脱液进行水浴,溶液转移到新EP管中,即完成DNA的提取[6]。使用Qubit 2.0测定DNA提取浓度,符合DNA提取浓度范围的样本放入-20℃冻存,等待进行文库构建的实验。不合格的样本放入不合格样本储存盒中,并记录在电子表格中。
1.2.2 DNA文库构建:整个建库流程分为反应一,反应二和纯化三个步骤。首先取出DNA样本解冻,瞬时离心收集。反应一和反应二均在冰上操作。按一定比例加入缓冲液和酶,配制混合溶液mix1,混匀后分装到0.2ml的PCR管中,并加入提取的外周血游离DNA,混匀离心后放置于设定程序的PCR仪中反应。反应二同样需要按一定比例加入缓冲液和酶配制mix2,混匀后分装到0.2ml PCR管中,再加入Adaptor T后离心拨弹混匀,放置于设定程序的PCR仪中反应。准备好两套中转管,用于分装平衡好的磁珠和最终收集文库。反应二结束后,将样本从0.2ml PCR管中的产物转入分装了磁珠的EP管中。轻柔混匀后静置几分钟,后瞬时离心置于磁力架上吸附磁珠。吸弃上清,用清洗液清洗磁珠表面,后瞬离吸取残液,在室温晾干,加入洗脱液重悬。混匀后瞬时离心收集,置于磁力架上吸附磁珠。吸取洗脱的文库到最终管中,即完成文库构建实验,文库放置于-20℃冻存[7]。构建完后进行qPCR定量实验对文库的浓度进行测定,详细实验步骤参照“qPCR定量(Real-time Quantitative PCR Detecting System)”。
1.2.3 qPCR定量:从-20℃冰箱取出上述文库样本,以及标准品、Mix、浓度标准品等试剂解冻。将18μl的稀释液分装到0.6ml EP管中。每个样本取2μl加入,离心后涡旋混匀。另将198μl的稀释液分装到0.6ml EP管中,加入2μl 浓度标准品,再将稀释了一次的浓度标准品样本取2μl加入新的已加入198μl稀释液的管中,离心后涡旋混匀。一版qPCR需要标准曲线standards做5个点,浓度标准品做双重复和一个阴性对照(NTC,稀释液)。依据说明书按一定比例配制反应液Mix,分装到qPCR版中。将稀释好的样本、浓度标准品、NTC及标准品加入孔板中,检查无误后封膜离心。根据qPCR结果判断文库构建的质量并换算出文库浓度。
2 结果
2.1 孕妇外周血胎儿游离DNA的提取浓度、建库浓度与实验操作者之间的关联性 孕妇外周血胎儿游离DNA的提取浓度与实验操作者在总体上无直接关联性,实验员的提取DNA平均浓度均在0.1ng/μl以上,不属于偏低范围0.05~0.1ng/μl。操作步骤均按照SOP进行实验,保证DNA的质量。在使用磁珠法构建文库满足文库构建浓度最低要求的情况下,通过qPCR结果查看峰型情况,文库峰型较为尖锐且Tm值<81,可粗略判断出构建所需目的片段,见图1、图2。
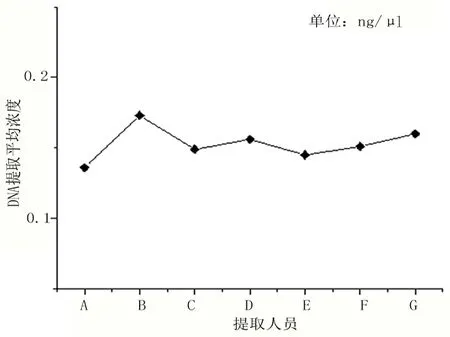
图1不同提取人员DNA提取平均浓度
2.2 孕妇外周血胎儿游离DNA的提取浓度与建库浓度的关联性 经不同实验员对大量样本提取、建库的实验数据来看,通过qubit,qPCR测定出的浓度结果,孕妇外周血胎儿游离DNA提取的浓度与文库构建后的浓度在总体上呈正相关关系,见图3。
2.3 不同操作者提取的孕妇外周血胎儿游离DNA浓度差比较 在同一时间分离血浆并冻存的标本,经不同操作者提取孕妇外周血胎儿游离DNA测定出的浓度无显著性差异,见图4。
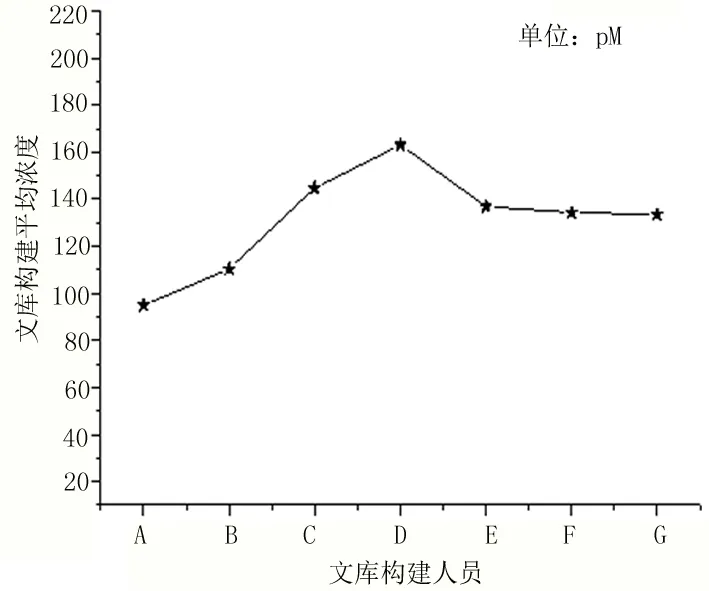
图2 不同建库人员与建库平均浓度
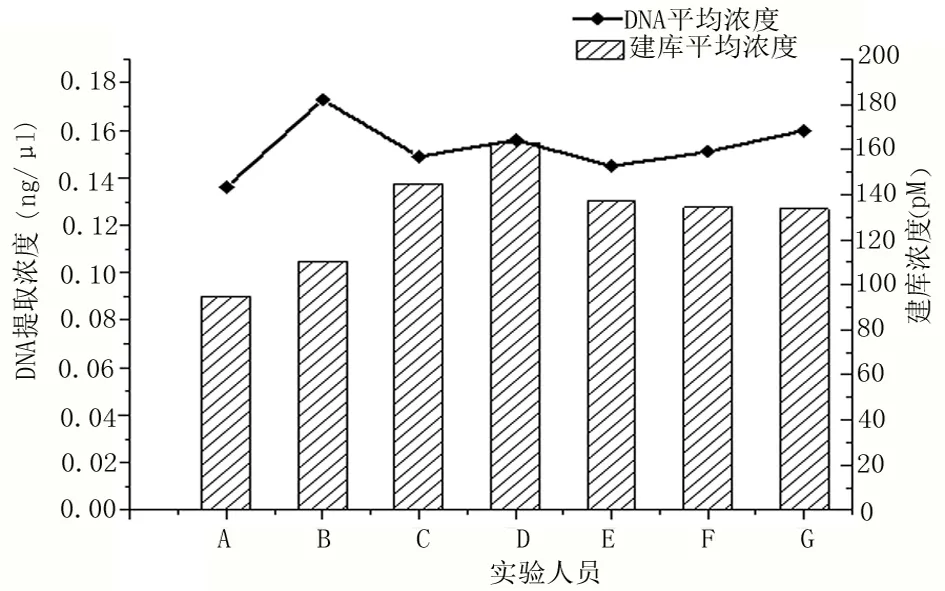
图3 孕妇外周血胎儿游离DNA的提取浓度qPCR后文库浓度比较

图4不同操作人员两次提取的DNA浓度差对比
3 讨论
3.1 提高DNA提取的转化率 在DNA提取实验过程中,经垂直混合仪混匀一段时间后,孕妇外周血胎儿游离DNA已经吸附于磁珠中,此时如何减少磁珠的损耗是提高DNA浓度在人为操作方面的可控手法。可以从以下两方面着手:一方面是在沉磁珠的时候,将磁珠沉淀到管子底部,做到肉眼可见BD管侧壁清澈,无大量磁珠散布,接着将磁珠从BD管完全转移至磁力架中管上的时候,转移完全,涮洗几次枪头后再将枪头打入BD管中;另一方面是在清洗过程中,清洗后使用真空泵吸弃上清液的时候,切勿触碰磁珠,保持离心管在磁力架上,即可减少磁珠的损耗。
3.2 提高文库构建的转化率 在文库构建的过程中,同样需要在遵守SOP的情况下尽可能地减少产物的损耗。在将DNA加入0.2ml PCR管时,注意全部加入,混匀时盖好管盖,轻弹混匀,防止漏液,造成污染和损耗;在上反应二前加入混合溶液mix2的时候,注意慢吸慢打,做到加入量准确;将反应二产物转移至分装好磁珠的EP管中时,注意转移完全;在进行纯化过程中,轻柔摇动磁力架清洗磁珠,并在吸弃上清时注意不要带走磁珠;晾干的时候注意不要晾干过度,避免后续实验步骤中加入洗脱液混匀时磁珠结块,混匀不均,影响文库质量。
3.3 通过qPCR图像反映文库构建质量 目前评估文库质量和数量的主要参数为文库片段大小及浓度[5],通过qPCR结果的峰型和位置可以判断文库的质量是否合格,如出现峰宽、双峰、峰的Tm值>81(dimer峰),都影响着文库质量。除此之外,文库的转化率和复杂度也会对检测的准确性产生影响。在建库反应一二过程中操作不够迅速,导致酶反应温度过高;配制的试剂或接头加入0.2ml PCR管的量不够;清洗时过于剧烈以及上反应之前混匀时没将气泡弹净都可能影响文库的转化率。当文库浓度偏低时,扩增所形成的DNA样本簇将减少,测序数据量也将减少,可能导致测序失败;当上机前文库浓度过高时,文库样本流经测序芯片(Flowcell) 时将产生过多的结合,从而导致样本簇生成过密,最终在一级生物信号分析时无法区分各簇的荧光信号,造成测序失败。
3.4 样本开始采集时间可适当延后 规定孕12+0~22+6周采血,是因为从妊娠第5周开始才能在孕妇外周血中检测出少量的胎儿游离DNA,胎儿游离DNA的浓度随孕周的增加而升高[7-8]。在12~22周时,通过测序,大多数孕妇能检测到胎儿游离DNA含量较大,为5%~30%。由于个体差异可能个别孕妇胚胎含量较低,需要等孕周再大一些再次采血进行检测。本实验室目前没有足够的数据量支撑孕12周采血一定不能正常出具检测报告,但是出现过孕周过小导致胚胎含量不足,后期需要通过孕周增加后重新采血重做正常出结果的情况。妊娠16~24周是做产前诊断的最佳穿刺抽取羊水时间。由于此时胎儿较小而羊水较多,胎儿周围有较宽的羊水带且浮在羊水中,此时抽取羊水不易刺伤胎儿,对子宫腔的影响较小[9]。在不影响后续诊断的情况下,建议最小孕周可以适当增加几周,此时能够检测到的胚胎含量相对来说更多,能切合实验后期生物信息分析的胚胎含量。随着分析水平的提高及试剂的优化,后期所需的胚胎含量肯定还会下降,能更早的检测胎儿是否患有三大染色体疾病,这是大家共同追求的目标,也是对出生缺陷更好的防治手段。
3.5 外部因素的影响 除了人员实验操作意外之外,实验环境温湿度、保存试剂的冰箱温度也很重要,它直接影响着实验的检测结果,每项实验的进行都需要精确可靠的监测仪器提供准确的环境参数数据。主要识别仪器的需要、试剂的需要、实验程序的需要及实验室员工的人性化考虑,因此实验室环境
温湿度必须控制在温度18~28℃,湿度20%~80%较为适宜,并每天按时记录[10]。不同的试剂储存的温度不同,在收到试剂后,放置试剂于对应温度的冰箱,并监测冰箱温度的稳定性,每天按时记录。
3.6 试剂稳定性的影响 由于试剂生产批次不同,效能不同,因此不排除试剂稳定性、人为操作对实验的影响。不同人的操作手法存在略微的差别,可能会在配制提取/建库试剂时,提取游离DNA清洗过程中,文库构建纯化过程中,引起GC偏移。DNA浓度在一定程度上可以反映提取质量,以上情况仅针对本实验室分析讨论,供其他地区实验室参考。
国家卫计委现已取消NIPT试点,制定相关规范文件,由此说明NIPT项目已步入市场化成熟状态。与唐氏筛查相比,无创产前检测技术检出率高,它应用二代测序,与一代测序相比提高了测序通量,与三代测序相比降低了测序成本,不仅能应用于产前筛查,还能应用于单基因遗传病检测、肿瘤靶向治疗、临床药物基因检测等方面,以后肯定有更广阔的市场。但是无创产前检测并不能取代产前筛查,通过临床观察,产前筛查高风险孕妇除了排除唐氏综合征的同时,还伴有其他的脏器异常情况也常见。因此,产前筛查,无创产前检测,产前诊断,产前超声检查四者缺一不可[11]。在实验过程中应总结经验,经常交流,提高样品的DNA提取质量和文库的转化率。
