鲎素Tachyplesin Ⅰ在大肠杆菌中的重组表达及其抑菌活性
2020-10-23王若诚
王若诚,辛 瑜,张 梁
(江南大学粮食发酵工艺与技术国家工程实验室,江南大学生物工程学院,江苏无锡 214122)
抗生素的广泛应用拯救了无数生命,然而过度依赖抗生素导致药物残留与细菌耐药性问题日益严重[1-2],传统大分子抗生素开发逐渐停滞[3]。因此,寻找抗生素替代品成为社会发展与科技进步的必要方向。抗菌肽(antimicrobial peptide,AMPs)作为生物先天免疫的第一道重要防线[4-5]逐渐进入大家的视野。作为小分子抗菌物质[6],抗菌肽作用机制多样[7],可以参与细胞信号传导[8],具有抗氧化[9]与降血压[10]作用。
鲎是一种生活在海洋中的大型节肢动物,从奥陶纪出现至今已有4亿多年的历史[11]。鲎素作为鲎血细胞中的阳离子抗菌肽[12],对细菌与真菌均具有抑菌活性[13-14]。此外,研究表明鲎素还可以抗病毒[15]、抑制肿瘤细胞增殖[16]和诱导癌细胞分化[17]。鲎素Tachyplesin Ⅰ(TP1)由17个氨基酸残基组成,两个β-折叠通过β-转角连接在一起,疏水的氨基酸残基定位于平面一侧,分子中6个阳离子氨基酸残基主要分布在分子的尾部[18]。Edwards利用氨基酸残基修饰调节重组肽所带电荷和疏水性,以评估鲎素及其类似物对于耐药菌的抑菌活性[19];Woodbum等将RP557与鲎素抗菌肽共同使用,降低伤口感染风险[20];Vernen等研究发现鲎素与癌细胞具有很强的结合能力,可以帮助化疗药物靶向针对癌细胞[21]。这些研究说明鲎素在医学领域具有广阔的应用前景与巨大经济价值。目前,抗菌肽主要通过生物提取、化学合成和基因工程3种方法获取。从生物体内分离纯化抗菌肽,公众接受度高但步骤繁琐,产率较低。鲎作为珍贵的海洋生物,数量稀少,从鲎血细胞中直接提取不能满足大量制备的需求[22]。而利用化学方法固相合成,产物纯度可得到保障,但价格极其昂贵,无法满足工业化应用。利用基因工程技术来生产鲎素,能够减少环境负担,大幅降低鲎素获取成本[23],为鲎素的理论研究与工业化应用创造良好环境。
本研究选用大肠杆菌作为宿主细胞,为降低目的抗菌肽对宿主菌的杀伤作用,将鲎素抗菌肽与硫氧还蛋白标签以可溶形式进行融合表达。并对经过蛋白纯化和羟胺切割获得的重组TP1蛋白进行质谱鉴定和抑菌活性表征,为鲎素工业化应用提供参考。
1 材料与方法
1.1 材料与仪器
质粒pET-32a(+)、大肠杆菌(Escherichiacoli)JM109、大肠杆菌BL21(DE3)、枯草芽孢杆菌(Bacillussubtilis)、金黄色葡萄球菌(Staphylococcusaureus) 本实验室保藏;限制性内切酶BamH Ⅰ/HindⅢ、预染蛋白Marker Page Ruler Prestained Protein Ladder 美国Thermo公司;T4DNA连接酶 大连Takara公司;2×TaqMaster Mix、2×PfuMaster Mix 杭州宝赛生物科技有限公司;质粒DNA小量提取、DNA片段纯化、DNA凝胶回收试剂盒 美国Axygen公司;氨苄青霉素(Ampicillin,Amp) 美国INALCO公司;异丙基硫代-β-D-半乳糖苷(Isopropylβ-D-thiogalactoside,IPTG) 上海生工生物工程有限公司;蛋白胨、酵母提取物 英国OXOID公司;其他试剂 均为国产分析纯。
S100D型PCR仪、Chemi Doc凝胶成像仪 美国Bio-Rad公司;DYY-6C 核酸电泳仪 北京六一仪器厂;Pico17高速离心机 美国Thermo Fisher Scientific公司;MLS-3750型全自动高压蒸汽灭菌锅 日本SANYO公司;HYL-C 型组合式摇床 太仓市实验设备厂;UV-3200型紫外可见分光光度计 上海美谱达仪器有限公司;Sonic VCX-750型超声波细胞破碎仪 南京新辰生物科技有限公司;SCG蛋白纯化系统 苏州赛谱仪器有限公司;MALDI SYNAPT MS超高效液相色谱串联四极杆飞行时间质谱联用仪 美国Waters公司;HH-2数显恒温水浴锅 金坛市荣华仪器制造有限公司。
1.2 实验方法
1.2.1 目的基因的获得 参考NCBI数据库中鲎素抗菌肽Tachyplesin Ⅰ(TP1)的全长cDNA序列(GenBank登录号:P14213.2),根据大肠杆菌的密码子偏好性对编码其成熟肽进行密码子优化,交由上海生工生物工程有限公司合成。将TP1基因序列克隆在pUC57质粒上,命名为pUC57-TP1。以质粒pUC57-TP1为模板,设计正向引物F1:5′-CGGGATCC AACGGCAAATGGTGCTTTCGCG-3′,反向引物R1:5′-CCAAGCTTTCATTAGCCGTTGCGGCA GCGGCGATA-3′,下划线依次BamH Ⅰ、羟胺切割位点和HindⅢ限制性内切酶位点。利用PfuDNA高保真聚合酶扩增TP1基因片段。
1.2.2 原核表达质粒的构建和鉴定 扩增得到的PCR产物纯化后使用BamH I与Hind Ⅲ进行双酶切,酶切产物经过纯化后与同样双酶切纯化后的pET-32a片段按摩尔比(5∶1)用 T4DNA连接酶16 ℃连接过夜,连接产物即pET-32a-TP1。表达设计框架为:TrxA+羟胺切割位点(aacggc)+TP1目的抗菌肽。连接产物转化E.coliJM109感受态细胞并过夜培养,挑取菌落为模板,以F1和R1为引物,通过菌落PCR与酶切验证目的片段是否连接到目的载体上,将筛选得到的阳性转化子送至上海生工生物工程有限公司测序。
1.2.3 融合蛋白的诱导表达 将鉴定正确的pET32a-TP1质粒转化到大肠杆菌BL21感受态细胞中,在含有100 μg/mL氨苄的LB培养基中,分别在37、30、25 ℃下,200 r/min转速下培养至对数生长期时(OD600=0.6),加入终浓度1 mmol/L的IPTG进行诱导表达,发酵结束后12000 r/min,4 ℃离心10 min收集菌体重悬于磷酸盐缓冲液中,洗涤3次在冰浴中进行超声破碎,功率为400 W,共15 min(工作1 s,间隔2 s)。然后在4 ℃下12000 r/min离心20 min,分别收集上清与沉淀,通过15% SDS-PAGE分析蛋白表达情况。
1.2.4 目的蛋白纯化 将诱导后离心收集的菌体经PBS缓冲液洗涤2次,超声破碎后离心收集上清,将样品通过HisTrap FF亲和层析凝胶柱进行纯化。进样前,利用50 mL平衡缓冲液(500 mmol/L NaCl、20 mmol/L Na2HPO4、20 mmol/L 咪唑,pH7.4)平衡柱子。进样后,用5~10倍体积的洗脱缓冲液(500 mmol/L NaCl、20 mmol/L Na2HPO4、500 mmol/L咪唑,pH7.4)洗脱,收集洗脱峰的洗脱液。
1.2.5 羟胺切割与产物质谱鉴定 将1.2.4中收集到的洗脱液注入透析袋中,用磷酸盐缓冲液(pH7.4)透析过夜以除去高浓度咪唑。透析后样品12000 r/min离心20 min收集得到的上清液冻干后,加入羟胺切割液(200 mmol/L Tris,2 mol/L盐酸羟胺,pH9.0)中,在45 ℃条件下反应4 h[24]。切割获得的产物利用透析袋进行脱盐处理。然后将样品利用冷冻干燥仪进行浓缩。使用LC-MS TOF超高效液相色谱串联质谱联用仪对浓缩样品进行质谱检测,以鉴定切割产物成分。
色谱条件:液相系统:Waters ACQUITY UPLC;色谱柱:ACQUITY UPLC BEH C18色谱柱(2.1×150 mm,1.7 μm);柱温:45 ℃;流动相A:乙腈;流动相B:0.1%甲酸;流速0.30 mL/min;总分析时间15.00 min;进样体积:5.0 μL。
质谱条件:质谱系统:Waters SYNAPT MS检测仪;软件:Waters Masslynx V4.1质谱工作站;离子源:ESI电离源;电离模式:ESI+;扫描m/z范围:20~2000;毛细管电压:3.5 kV;锥孔电压:20 V;离子源温度:100 ℃;脱溶剂气温度:400 ℃;脱溶剂气流量:700 L/h;锥孔气流量:50 L/h。
1.2.6 重组TP-1的抑菌活性检测 用琼脂孔扩散实验对重组表达的鲎素抗菌肽TP1检测抑菌活性。将金黄色葡萄球菌和枯草芽孢杆菌分别培养至对数期(OD600=0.4~0.6),利用灭菌后的PBS溶液,将菌液浓度稀释至5×105CFU/mL。将无菌LB固体培养基冷却至50 ℃,按照1%的比例接种指示菌,混匀后倾注平板。等平板凝固后用打孔器进行打孔,分别标记数字1、2、3、4、5。1号孔加入化学合成的TP1(40 mg/L),2号孔加入Trxa-TP1融合蛋白(40 mg/L),3号孔切割后的TP1重组蛋白(40 mg/L),4号孔加入10 mg/mL氨苄青霉素,5号孔加入灭菌后的PBS溶液。每孔上样50 μL液体,37 ℃静置培养过夜,观察抑菌圈情况。
最小抑菌浓度的测定:将处于对数期的金黄色葡萄球菌和枯草芽孢杆菌稀释至104~105CFU/mL,取1 mL菌液和10 μl不同浓度的重组TP1加入到EP管中,以PBS缓冲液作阴性对照,37 ℃、200 r/min振荡培养3 h,测菌液的OD600,以吸光度值无变化处所对应的TP1浓度为最小抑菌浓度(MIC)。
1.3 数据处理
本研究中涉及的实验内容均重复3次;应用Waters Masslynx V4.1软件分析质谱数据与Adobe Illustrator CC2018软件作图。
2 结果与分析
2.1 目的抗菌肽TP1基因获得
TP1基因的开放阅读框编码的氨基酸序列为KWCFRVCYRGICYRRCR,该基因编码的抗菌肽长度为17个氨基酸残基。以重组质粒pUC57-TP1为模板,通过PCR扩增获得目的基因,其凝胶电泳结果如图1所示,在3%琼脂糖凝胶电泳上可以看到大小约为80 bp的清晰条带,与目的片段大小一致。
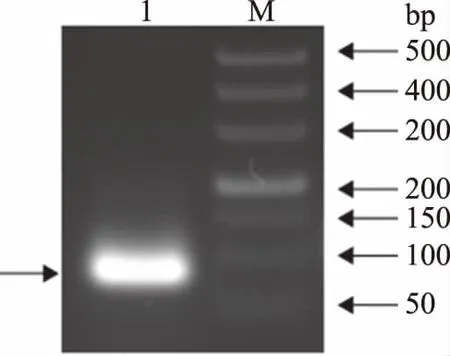
图1 TP1基因的克隆
2.2 鲎素TP1原核表达载体的构建与鉴定
对构建的pET32a-TP1表达载体进行双酶切验证,双酶切后出现两条特异性条带,其中小片段与TP1大小一致,另一条带与双酶切后的pET-32a大小相同,结果如图2所示,表明基因TP1已经成功连接到pET-32a载体上。提取重组质粒转化大肠杆菌BL21感受态细胞,筛选获得重组菌。由于目的抗菌肽TP1对于宿主大肠杆菌可能存在一定的杀伤作用,为提高目的抗菌肽的产量,利用TrxA蛋白融合标签与目的抗菌肽融合表达,以此降低TP1的毒性,保护宿主菌生长。后期再通过羟胺裂解液分离TrxA蛋白与目的抗菌肽,释放TP1的抑菌活性。

图2 pET32a-TP1重组质粒的双酶切鉴定
2.3 融合蛋白的诱导表达
结果如图2显示,在37 ℃培养条件下的菌体破碎上清中,20 kDa左右处有明显特异表达的蛋白条带,与预期的TrxA-TP1融合蛋白的大小基本一致,表明融合蛋白成功表达并以可溶形式存在。
2.4 融合蛋白TrxA-TP1的纯化
收集菌体超声破碎后的上清,使用HisTrap FF柱进行分离纯化。将洗脱缓冲液洗脱后获得后的样品进行SDS-PAGE电泳检测,结果如图3所示,进样流出部分无目的蛋白析出,说明目的蛋白与镍柱有效结合;当洗脱液中咪唑浓度为100 mmol/L时,剩余杂蛋白充分洗脱;当洗脱液中咪唑浓度为200 mmol/L时,大量目的蛋白析出,SDS-PAGE分析显示为单一条带,大小约为20 kDa。结果表明利用镍柱纯化后能够获得纯度较高的TrxA-TP1融合蛋白。
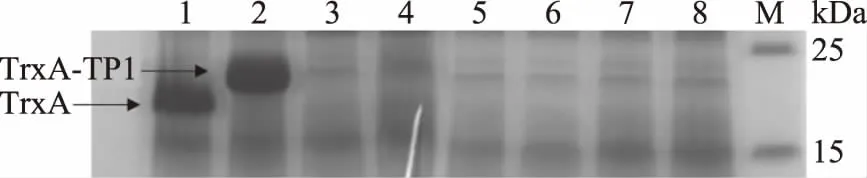
图3 TrxA-TP1融合蛋白的SDS-PAGE分析
2.5 融合蛋白的切割与质谱鉴定
将纯化后的TrxA-TP1融合蛋白进行羟胺切割,经过除盐与浓缩处理后利用LC-MS TOF对切割产物进行分析。结果如图4所示,切割产物分子质量为2330.55 u,与预测结果一致。根据上述结果以及SDS-PAGE分析,表明了重组菌BL21-pET32a-TP1能够成功表达TrxA-TP1融合蛋白,且可以利用羟胺切割的方法将TrxA蛋白与目的抗菌肽TP1分开,从而能够获得单一的TP1重组蛋白。

图4 纯化后的融合蛋白TrxA-TP1的SDS-PAGE分析
2.6 重组TP1的抑菌活性检测
为了检测羟胺切割后重组TP1的抗菌活性,以氨苄青霉素为阳性对照,灭菌后的PBS溶液为阴性对照,使用金黄色葡萄球菌和枯草芽孢杆菌作为实验菌,利用琼脂糖孔扩散法对获得的重组TP1蛋白的抗菌活性进行测定。结果如图5所示,通过对抑菌圈大小与透明程度进行比较,表明TrxA-TP1融合蛋白对金黄色葡萄球菌与枯草芽孢杆菌均不具有抑菌活性,而切割后获得的重组蛋白TP1对这两种菌均具有抑菌活性。由此表明了TP1蛋白与TrxA蛋白融合表达后,利用羟胺切割可以获得具有抗菌活性的单一TP1重组蛋白。通过液体抑制测定法确定了重组TP1对金黄色葡萄球菌和枯草芽孢杆菌的最小抑菌浓度分别为6和10 mg/L。
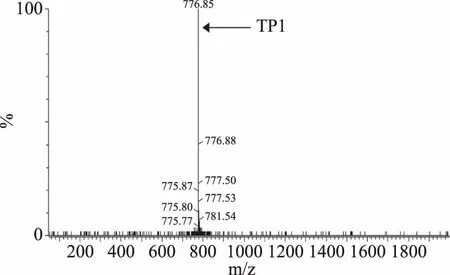
图5 重组TP1的质谱分析

图6 重组TP1的抑菌效果检测
3 讨论与结论
本研究成功利用大肠杆菌表达系统对鲎素TP1进行了高效表达。在菌体破碎液上清中,检测到重组融合蛋白的条带大小约为20 kDa,表明TrxA-TP1融合蛋白在大肠杆菌中以可溶形式进行了融合表达。融合蛋白经过镍柱纯化,能够获得条带较为单一的融合蛋白,纯化后的样品利用羟胺裂解液进行切割后,质谱分析证明了羟胺切割后能够成功的将TrxA蛋白标签与鲎素TP1抗菌肽分开,从而获得单一的TP1抗菌肽。后期抑菌活性实验表明,融合蛋白TrxA-TP1对金黄色葡萄球菌和枯草芽孢杆菌没有明显的杀伤作用,而裂解后获得的单一的重组TP1单体蛋白对这两种菌均具有明显抑菌活性。
迄今为止,已有许多研究人员在不同宿主中成功表达抗菌肽[25]。大肠杆菌作为目前应用最为广泛的表达系统[26],具有在短时间内表达水平高和成本低廉等优点,非常适用于规模化生产,有望使抗菌肽成为帮助人类抵御疾病的新型药物。许多利用大肠杆菌重组表达的抗菌肽,如拟穴青蟹抗菌肽[27]与PlnF抗菌肽[28]都以包涵体形式存在。然而包涵体后续处理繁琐且复性后目的蛋白可能丧失活性[29]。本文选取TrxA蛋白标签与鲎素TP1抗菌肽进行融合表达,不仅促进融合蛋白的可溶性表达,更降低了重组TP1对于宿主大肠杆菌的杀伤作用,提高了融合蛋白的表达量,为鲎素抗菌肽的大规模生产与其他抗菌肽的重组表达提供了一定理论依据。
