丹参多酚酸配伍三七总皂苷通过调节PI3K/AKT信号通路对大鼠脑缺血/再灌注损伤神经元凋亡的影响
2020-10-19贾壮壮陈红阳王少峡柴丽娟胡利民
贾壮壮,袁 庆,陈红阳,张 彤,赵 磊,王少峡,柴丽娟,郭 虹,胡利民
(天津中医药大学中医药研究院,天津市中药药理学重点实验室,方剂学教育部重点实验室,天津 301617)
缺血性脑卒中具有高发病率、高致残率和高致死率的特点[1],其病理机制包括炎症反应、氧化应激、兴奋性氨基酸毒性、细胞凋亡等[2]。细胞凋亡参与多种疾病病理过程,与脑缺血/再灌注损伤病理机制有密切联系[3],其中Bcl-2家族蛋白中的促凋亡蛋白Bax与抗凋亡蛋白Bcl-2在体内处于动态变化过程中,共同参与调节细胞凋亡[4]。caspase-3作为caspase 家族重要成员参与介导了凋亡的蛋白酶级联反应,是多种凋亡途径的共同下游效应部分。脑缺血/再灌注损伤细胞凋亡机制复杂,涉及多条信号通路,其中PI3K/AKT信号通路发挥着重要的调节作用[5-6]。
中药丹参、三七为临床常用活血药对,二药配伍后相辅相成,广泛应用于心脑血管疾病的治疗。其中丹参主要化学成分包括水溶性的酚酸类,如丹酚酸B、丹参素、迷迭香酸等,脂溶性的二萜类,如丹参酮,隐丹参酮等[7];三七的主要活性成分为三七总皂苷[8]。现代药理研究显示,丹参多酚酸及三七总皂苷可通过减少氧化应激损伤、降低炎症反应、改善微循环障碍等减轻脑缺血/再灌注损伤[9-11]。本文主要通过研究丹参多酚酸配伍三七总皂苷对大鼠脑缺血/再灌注损伤的神经保护作用,探讨二者配伍应用能否对抑制脑缺血/再灌注损伤神经元凋亡起到协同增效作用。
1 材料与方法
1.1 动物健康♂Wistar大鼠60只,SPF级,体质量(270±10)g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2016-0006。
1.2 药品与试剂依达拉奉注射液(Edaravone Injection,EDA),购自南京先声东元制药有限公司,规格5 mL/10 mg,批号:80-170510;丹参多酚酸(Salvia nolic acids, SAL),购自天津天士力之骄药业有限公司,批号:20180901;三七总皂苷(Panax notoginseng saponins, PNS),购自广西梧州制药股份有限公司,批号:18080416;Bcl-2(ab196495)、Bax(ab199677)、cleaved caspase-3(ab49822)、NeuN(ab177487)、β-actin(ab179467)抗体,购自英国Abcam公司;PI3K(17366)、p-AKT(4060)、AKT(4685)抗体,购自美国CST公司。TUNEL细胞凋亡检测试剂盒(C1088),购自上海碧云天生物技术有限公司。
1.3 仪器激光散斑血流仪(英国moor公司);IX73倒置荧光显微镜(日本Olympus公司);Western Blot电泳仪(美国Bio-Rad公司);Trans-Blot转膜仪(美国Invitrogen公司);Amersham imager 600超灵敏多功能成像仪(美国General Electric公司)。
1.4 大鼠脑缺血/再灌注损伤模型的建立采用改良线栓法建立大脑中动脉闭塞/再灌注模型(middle cerebral artery occlusion/reperfusion,MCAO/R),方法如下:将大鼠吸入异氟烷麻醉后,仰卧固定于37 ℃恒温床,使用激光多普勒血流仪监测脑血流;将颈部正中备皮消毒,纵向切开,钝性分离颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA),结扎ECA,暂时夹闭CCA及ICA,显微剪于ECA近心端做V形切口,将硅胶包被的尼龙线栓插入V形切口,缓慢推进,直至插入大脑中动脉,轻遇阻力即停止,观察激光多普勒监测脑血流急骤下降。栓塞1.5 h后将线栓拔出再灌,激光多普勒监测脑血流恢复。假手术组不进行插线栓操作,其余步骤同模型组。参考Longa的5级 4 分法进行神经功能评分,评分≥2分的大鼠为模型制备成功,可用于后续实验。
1.5 分组与给药将Wistar大鼠随机分为6组:假手术组(Sham)、脑缺血/再灌注组(I/R)、依达拉奉组(EDA,6 mg·kg-1)、丹参多酚酸组(SAL,21 mg·kg-1)、三七总皂苷组(PNS,100 mg·kg-1)、丹参多酚酸配伍三七总皂苷组(SAL+PNS,21 mg·kg-1+100 mg·kg-1)。尾静脉注射给药,每日1次,连续给药3 d,Sham组及I/R组给予相同容积生理盐水。
1.6 神经行为学评分取材前对大鼠进行mNSS神经功能评分[12],观察各组大鼠神经功能恢复情况,评分内容主要包括运动测试、感觉测试、平衡测试、反射测试和异常运动5个方面,总分18分,神经功能受损越严重,得分越高。
1.7 局部脑血流检测将大鼠吸入异氟烷麻醉后,置于37 ℃保温床上,切开头部正中皮肤,刮除颅骨骨膜,将前囟暴露。通过激光散斑脑血流仪New single image功能扫描并保存脑血流图像;通过moor LDI Laser Doppler Imager Review V60软件对图像进行血流分析,采用Graphpad Prism5进行数据分析作图。
1.8 HE染色及Nissl染色将大鼠吸入异氟烷麻醉后,仰卧开胸,经心尖灌流生理盐水,再缓慢灌注4%多聚甲醛。将大鼠断头取脑,脑组织用4%多聚甲醛溶液固定过夜,然后将脑组织进行脱水、透明、浸蜡及包埋,做厚度5 μm的冠状切片。将石蜡切片经脱蜡、复水后分别进行常规HE染色及Nissl染色,Olympus显微镜下观察组织形态。
1.9 TUNEL与NeuN免疫荧光双染检测缺血半暗带神经元凋亡取大鼠脑组织,经4%多聚甲醛溶液固定后,蔗糖溶液梯度脱水,将脑组织通过OCT包埋后做连续冠状冰冻切片,厚度20 μm,进行TUNEL与NeuN荧光双染,具体步骤如下:① 将冰冻切片用含0.5% Tirton X-100的PBS溶液通透30 min;② 将冰冻切片置于煮沸的柠檬酸钠溶液中进行抗原修复;③ 滴加正常山羊血清工作液覆盖组织,室温封闭30 min;④ 滴加NeuN(1 ∶400)一抗,4 ℃孵育过夜;⑤ 次日滴加TRITC 标记的荧光二抗(1 ∶200)及TUNEL检测液,37 ℃避光孵育60 min;⑥滴加DAPI溶液染核,并用PBS溶液清洗3遍后,滴加抗荧光淬灭剂封片;⑦使用Olympus倒置荧光显微镜观察缺血半暗带神经元凋亡情况,并计算细胞凋亡率,细胞凋亡率/%=凋亡细胞数量/总细胞数量 ×100%。
1.10 免疫荧光法检测缺血半暗带cleaved caspase-3阳性细胞数取大鼠脑冰冻切片,用含0.5% Tirton X-100的PBS溶液通透30 min后,置于煮沸的柠檬酸钠溶液中抗原修复,滴加正常山羊血清封闭30 min;在切片上滴加一抗,即兔抗cleaved caspase-3(1 ∶200)抗体,放于湿盒内4 ℃孵育过夜;次日于37 ℃下避光孵育FITC标记的荧光二抗(1 ∶500);使用DAPI溶液染核后,滴加抗荧光淬灭封片剂;使用Olympus倒置荧光显微镜下,随机选取5个高倍视野拍照,统计阳性细胞表达数。
1.11 Western blot法检测缺血半暗带Bcl-2/Bax PI3K、p-AKT/AKT蛋白表达提取各组大鼠脑缺血半暗带总蛋白,使用BCA法测蛋白浓度。采用SDS-PAGE凝胶电泳分离蛋白,再将蛋白转移至PVDF膜上,使用5%的脱脂奶粉封闭2 h后,分别加入一抗,4 ℃孵育过夜。次日孵育HRP标记的二抗1 h后,加入显影液。用超灵敏多功能成像仪曝光目的条带,采用ImageJ软件分析各目的蛋白/β-actin的灰度值。

2 结果
2.1 各组大鼠局部脑血流变化通过激光散斑血流仪检测大鼠局部脑血流情况,如Fig 1所示,缺血/再灌注3 d以后,与Sham组比较,I/R组脑血流明显下降(P<0.01);与I/R组比较,EDA组、SAL组、PNS组、SAL+PNS组脑血流明显增加(P<0.05,P<0.01);SAL+PNS组脑血流改善情况优于SAL组、PNS组(P<0.05)。
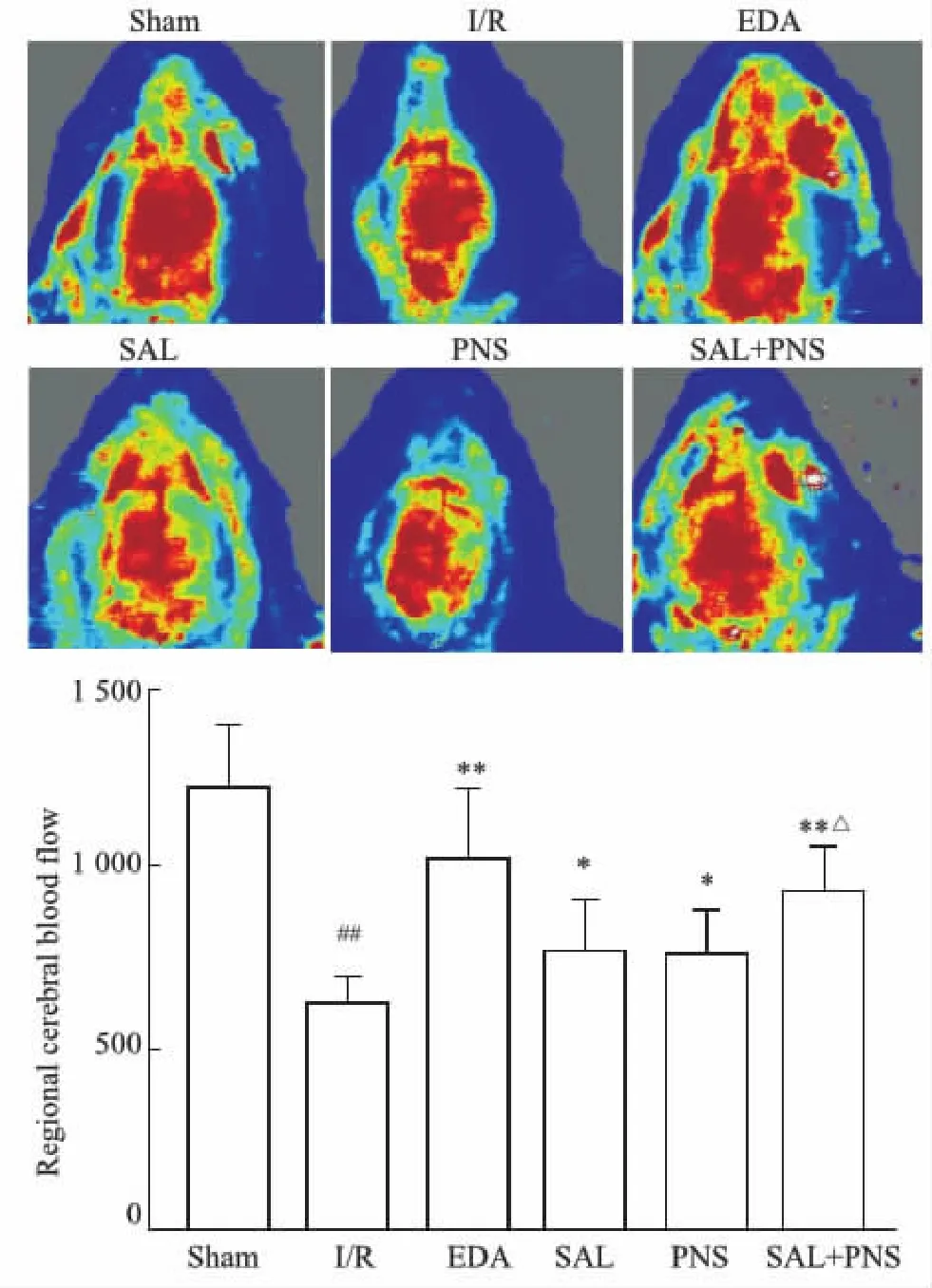
Fig 1 Regional cerebral blood flow in different group of n=10)##P<0.01 vs Sham; *P<0.05, **P<0.01 vs I/R; △P<0.05 vs SAL or PNS
2.2 各组大鼠神经功能评分情况如Fig 2所示,I/R组较Sham组mNSS评分明显升高,神经功能缺损严重,差异具有显著性(P<0.01);与I/R组相比,EDA组、SAL组、PNS组、SAL+PNS组mNSS评分明显下降(P<0.01),且SAL+PNS组mNSS评分低于SAL组、PNS组,差异有统计学意义,神经功能缺损得到改善。
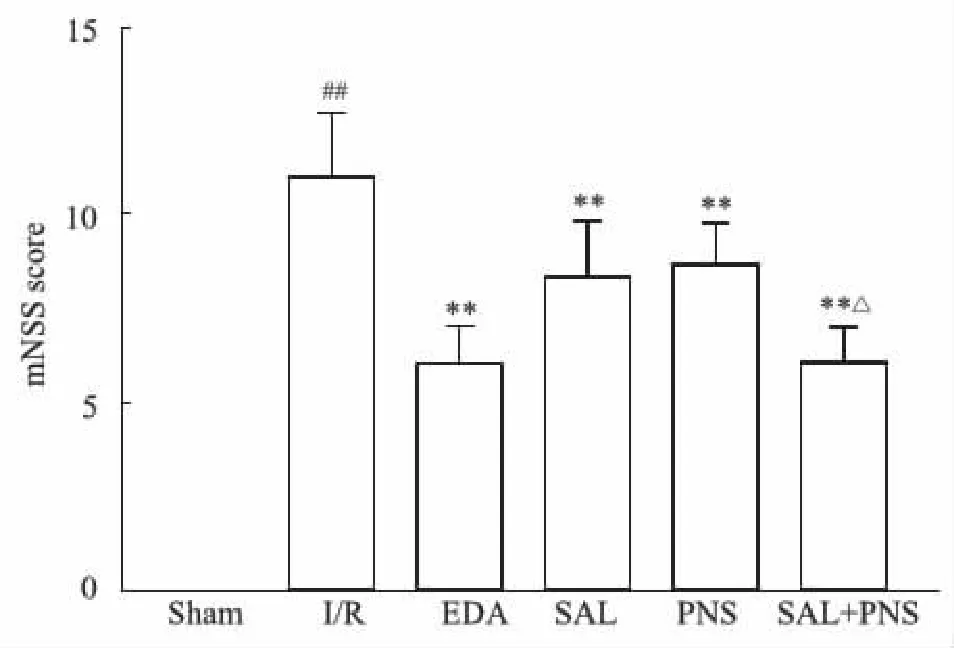
Fig 2 mNSS score of different groups of n=10)##P<0.01 vs Sham; **P<0.01 vs I/R; △P<0.05 vs SAL or PNS
2.3 各组大鼠缺血半暗带组织形态学变化HE染色结果显示(Fig 3),Sham 组大脑皮层组织形态正常,细胞核清晰,染色均匀,细胞间隙致密;I/R组细胞结构破坏,细胞排列不整齐,细胞核固缩,细胞间隙疏松;与I/R组比较,EDA组、SAL组、PNS组、SAL+PNS组形态学明显改善,正常细胞数量较多,结构较为完整,细胞核较为清晰,且SAL+PNS组形态学改善情况优于SAL组、PNS组。
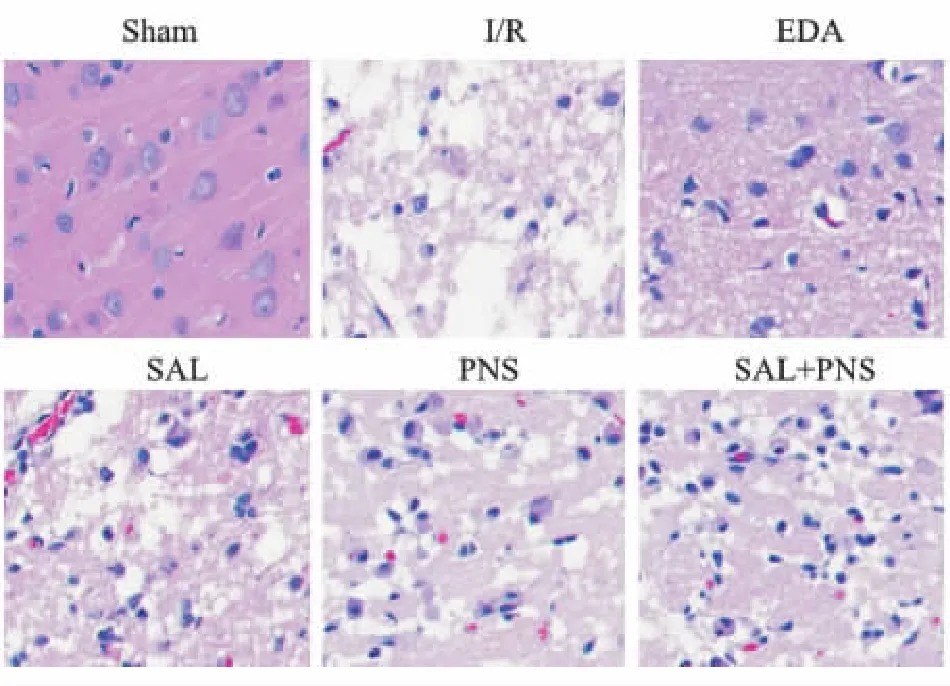
Fig 3 HE staining image of different groups of rats(×400)
2.4 各组大鼠缺血半暗带神经元损伤情况Nissl染色显示(Fig 4),Sham 组神经元形态正常,排列规整,Nissl体数目丰富,着色均匀;I/R组神经元形态异常,呈空泡样变化,排列紊乱,核膜模糊不清,Nissl体数目减少(P<0.01);与I/R组相比,EDA组、SAL组、PNS组、SAL+PNS组神经元形态明显好转,染色较均匀,Nissl体数目增多,差异具有显著性(P<0.05,P<0.01),且SAL+PNS组Nissl体数目多于SAL组、PNS组(P<0.05)。
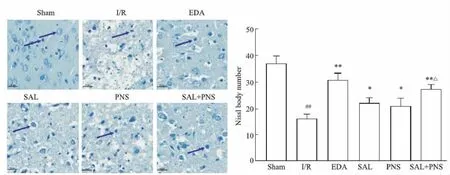
Fig 4 Nissl staining image of different groups of rats(×400). n=5)##P<0.01 vs Sham; *P<0.05, **P<0.01 vs I/R; △P<0.05 vs SAL or PNS
2.5 各组大鼠神经元凋亡情况TUNEL与NeuN荧光双染显示(Fig 5),Sham组大脑皮层几乎无凋亡细胞;I/R组TUNEL/NeuN阳性细胞表达明显增多,神经元凋亡严重(P<0.01);与I/R组相比,SAL组、PNS组、SAL+PNS组 TUNEL/NeuN阳性细胞及神经元凋亡率减低(P<0.05,P<0.01),且SAL+PNS组神经元凋亡率低于SAL组、PNS组(P<0.05)。
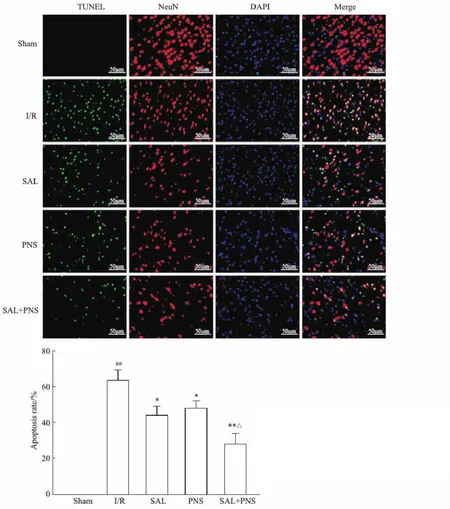
Fig 5 Neuron apoptosis in different groups ##P<0.01 vs Sham; *P<0.05,**P<0.01 vs I/R; △P<0.05 vs SAL or PNS
2.6 各组大鼠Bcl-2/Bax表达的变化如Fig 6所示,与Sham组比较,I/R组大鼠脑缺血半暗带Bcl-2/Bax相对蛋白表达明显降低(P<0.01);与I/R组比较,SAL组、PNS组Bcl-2/Bax表达升高(P<0.05),SAL+PNS组Bcl-2/Bax表达显著升高(P<0.01),差异具有统计学意义;SAL+PNS组Bcl-2/Bax表达显著高于SAL组、PNS组(P<0.01)。
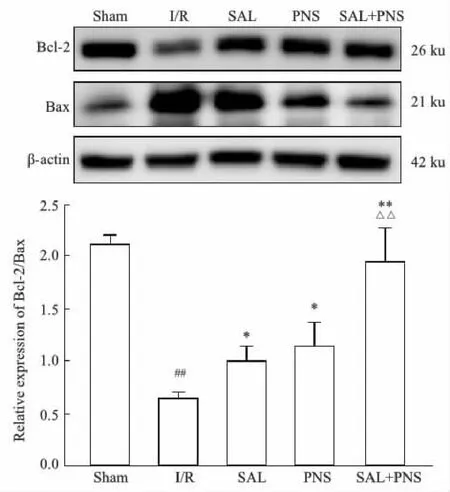
Fig 6 Relative expression of Bcl-2/Bax in different group of rats n=3)##P<0.01 vs Sham; *P<0.05, **P<0.01 vs I/R; △△P<0.01 vs SAL or PNS
2.7 各组大鼠cleaved caspase-3表达的变化如Fig 7所示,与Sham组比较,I/R组cleaved caspase-3阳性细胞数显著升高(P<0.01);与I/R组相比,SAL组、PNS组cleaved caspase-3阳性细胞数降低(P<0.05),SAL+PNS组cleaved caspase-3阳性细胞数显著降低(P<0.01);SAL+PNS组下降程度优于SAL组、PNS组(P<0.01)。
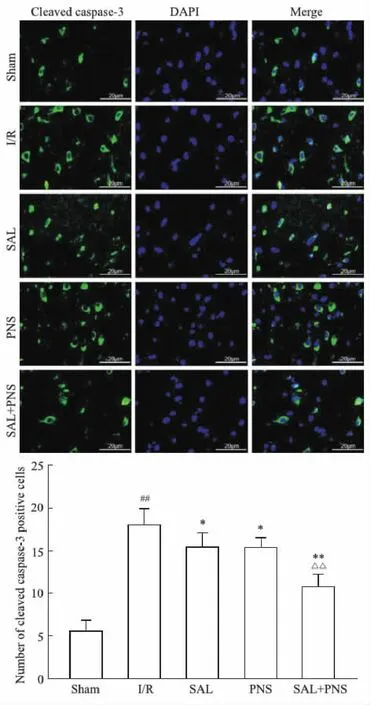
Fig 7 The positive expression of cleaved caspase-3 in different group of rats(×400). n=5)##P<0.01 vs Sham; *P<0.05, **P<0.01 vs I/R; △△P<0.01 vs SAL or PNS
2.8 对各组大鼠PI3K/AKT信号通路的影响如Fig 8所示,与I/R组比较,SAL组、PNS组大鼠脑缺血半暗带PI3K蛋白表达升高(P<0.05),p-AKT/AKT蛋白表达升高(P<0.01);SAL+PNS组PI3K、p-AKT/AKT蛋白表达量均升高(P<0.01),且SAL+PNS组升高程度优于SAL组及PNS组(P<0.05,P<0.01)。
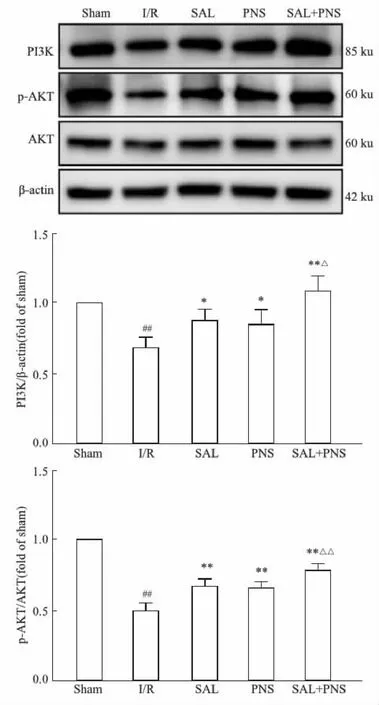
Fig 8 The protein expression of PI3K/AKT signaling pathway in different groups of n=3)##P<0.01 vs Sham; *P<0.05, **P<0.01 vs I/R; △P<0.05, △△P<0.01 vs SAL or PNS
3 讨论
脑中风目前已成为致死率仅次于缺血性心脏病的第二大致死性疾病,且以缺血性脑中风为主。脑缺血后可引发一系列病理反应[13],其中细胞凋亡是脑缺血/再灌注损伤过程中神经元重要的死亡形式。当脑缺血/再灌注发生后,线粒体结构破坏,细胞色素C(cytochrome-C,Cyt-c)释放,促进凋亡酶激活因子(apoptotic protease activating factor-1,Apaf-1)发生同源寡聚化,促进caspase-9与其结合形成凋亡小体,被激活的caspase-9继而激活其他caspase,如caspase-3,从而诱导细胞凋亡。Bax、Bcl-2共属于Bcl-2家族,共同参与调节细胞凋亡。Bcl-2是细胞凋亡抑制因子,可阻止Cyt-c的释放,并促进细胞核谷胱甘肽(L-glutathione, GSH)的积聚,导致核内氧化还原平衡的改变,降低caspase的活性,进而抑制细胞凋亡。Bax不仅可与Bcl-2形成二聚体,进而拮抗Bcl-2的凋亡抑制作用,还能增加线粒体的通透性,促进Cyt-c的释放,激活caspase级联反应,促进细胞凋亡。大脑局灶性缺血后,缺血中心区将发生不可逆转的神经损伤,而缺血半暗带依靠其残余血流量及新生小血管提供的能量可使细胞保持一段时间的活力,血脑屏障仍保持相对完整,故其细胞凋亡在一定程度上是可逆的,因此通过抑制缺血半暗带神经元凋亡,进而发挥神经保护作用可能是减轻脑缺血/再灌注损伤一个重要思路。
中医理论认为,脑中风的主要病理因素为风、火、痰、气、瘀,而气虚血瘀是其重要病机之一。中药具有多组分、多靶点、毒副作用小、疗效稳定等优势,在抗脑缺血治疗中越来越受到人们的重视。丹参最早见于《神农本草经》,具有活血祛瘀的功效,三七具有活血化瘀、补虚强壮之功。课题组前期研究发现[14],丹参、三七有效组分配伍可通过抑制肿瘤坏死因子-α、白介素-1β、白介素-6的释放,调节脑缺血/再灌注后炎症反应;通过调节超氧化物歧化酶、过氧化氢酶、丙二醛的表达而降低缺血/再灌注诱导的氧化应激反应;并可通过调节脑源性神经营养因子、血管内皮生长因子的释放,发挥内源性神经保护作用。
本研究发现,通过应用丹参多酚酸、三七总皂苷及其配伍干预大鼠脑缺血/再灌注损伤,可显著提高大鼠缺血侧脑血流,改善缺血半暗带神经元组织形态学变化,降低神经元凋亡率,上调Bcl-2/Bax蛋白表达,降低cleaved caspase-3蛋白表达,激活PI3K/AKT信号通路,且配伍应用治疗效果明显优于单独应用,对各项指标均有明显的改善。丹参多酚酸及三七总皂苷的脑保护作用机制可能与通过激活PI3K/AKT信号通路抑制神经元凋亡,进而发挥神经保护作用有关。为进一步揭示丹参多酚酸及三七总皂苷配伍对脑缺血/再灌注损伤的神经保护作用,本课题组将继续深入研究其相关治疗机制。
