高尿酸血症病人尿液pH值水平及其影响因素分析
2020-09-29薛晓梅任伟闫飞李长贵刘振贺玉伟
薛晓梅 任伟 闫飞 李长贵 刘振 贺玉伟
[摘要] 目的 明确高尿酸血症病人尿液pH值水平的变化,探讨影响其尿液pH值变化的因素。方法 选取2017年3月—2019年4月在青岛大学附属医院就诊的高尿酸血症病人244例,以年龄、性别相匹配的健康体检者377例作为对照组,比较两组研究对象的人口学资料及就诊当天血生化与血、尿常规指标,Kruskal-Walis H非参数检验比较两组尿液pH值水平,Spearman相关分析及Logistic回归分析探讨影响高尿酸血症病人尿液pH值的相关因素。结果 高尿酸血症病人尿液pH值水平显著低于对照组(Z=-9.195,P<0.01),高尿酸血症病人尿液pH值<5.5者比例显著高于对照组(χ2=45.64,P<0.01),血尿酸水平是尿液pH值<6的独立危险因素(OR=1.40,P<0.001)。结论 高尿酸血症病人尿液pH值水平显著低于健康者,血尿酸水平是其独立危险因素。
[关键词] 高尿酸血症;尿液pH值;尿酸;影响因素分析
[中图分类号] R589.9 [文献标志码] A [文章编号] 2096-5532(2020)05-0576-04
doi:10.11712/jms.2096-5532.2020.56.119 [开放科学(资源服务)标识码(OSID)]
[ABSTRACT] Objective To determine the urine pH level of patients with hyperuricemia and explore its influencing factors. Methods A total of 244 patients with hyperuricemia were selected who attended the Affiliated Hospital of Qingdao University from March 2017 to April 2019, with 377 age- and gender-matched healthy controls on physical examination. Demographic data and results of blood biochemistry, blood routine, and urine routine tests on the day of attending hospital were compared between the two groups. The Kruskal-Wallis H test was used to compare the urine pH level between the two groups. Spearman correlation analysis and logistic regression analysis were used to analyze the factors affecting the urine pH of patients with hyperuricemia. Results The urine pH of hyperuricemia patients was significantly lower than that of healthy controls (Z=-9.195,P<0.01). The patients with hyperuricemia had a significantly higher frequency of urine pH<5.5 than the healthy subjects (χ2=45.64,P<0.01). Blood uric acid level was an independent risk factor for urine pH<6 (OR=1.40,P<0.001). Conclusion The urine pH of patients with hyperuricemia is significantly lower than that of healthy people, and blood uric acid level is the independent risk factor.
[KEY WORDS] hyperuricemia; urine pH value; uric acid; root cause analysis
近年来,随着人民生活水平的提高和生活习惯的改变,高尿酸血症(HUA)的发病率逐年上升,最新的一项流行病学调查显示,中国成年男性HUA的患病率高达38%[1]。HUA与多种疾病密切相关,是痛风、高血压、糖尿病及慢性肾功能不全的独立危险因素[2]。此外,HUA病人常伴发肾结石[3]。HUA病人肾结石的发生与其尿液尿酸水平高、pH值水平低有关,尤其是当尿液pH值<6时,尿酸性肾结石的发生率明显增高。既往对HUA病人尿液的研究发现,HUA病人尿液pH值降低[4],但不同血尿酸(SUA)水平下尿液pH值之间的关系尚不明确。本研究旨在探讨HUA病人不同SUA水平下尿液pH值分布情况,以及影响其尿液pH值相关因素,为HUA的临床干预提供循证医学依据。
1 对象与方法
1.1 研究对象
选择2017年3月—2019年4月就诊于青岛大学附属医院门诊HUA病人244例(HUA组),并选取同期与其年齡、性别相匹配的健康体检者377例作为对照组。入选标准:HUA病人非同日2次检测SUA>420 μmol/L;健康体检者SUA 120~420 μmol/L。排除标准:①合并影响尿液pH值的其他疾病,如糖尿病、肾功能不全;②合并肿瘤病人。
1.2 研究方法
通过我院临床科研大数据平台调取所有研究对象的年龄、性别、身高、体质量、体质量指数(BMI)、血压以及就诊当天尿液常规与血清生化指标、血常规指标等,分析HUA病人与对照组尿液pH值水平及影响HUA病人尿液pH值的相关因素。
1.3 统计学方法
采用SPSS 25.0软件进行数据分析。正态分布计量资料采用±s形式表示,多组均数的比较采用方差分析;偏态分布计量资料采用M(Q25~Q75)表示,数据间比较采用Kruskal-Walis H非参数检验;计数资料数据的组间比较采用χ2检验。采用Spearman相关方法分析尿液pH值与其他指标之间的相关性。采用Logistic回归方法分析HUA病人SUA水平对尿液pH值的相对风险度,其中因变量为尿液pH值是否<6(是=1,否=0),自变量为SUA水平(以60 μmol/L为1个单位)。在对混杂因素进行校正时,SUA水平的赋值同上,其他连续性变量以原始数值的形式纳入分析,使用两独立样本t检验进行单因素分析。以P<0.05为差异有统计学意义,其中多组间相互比较以P<0.017为差异有统计学意义。
2 结 果
2.1 两组一般资料比较
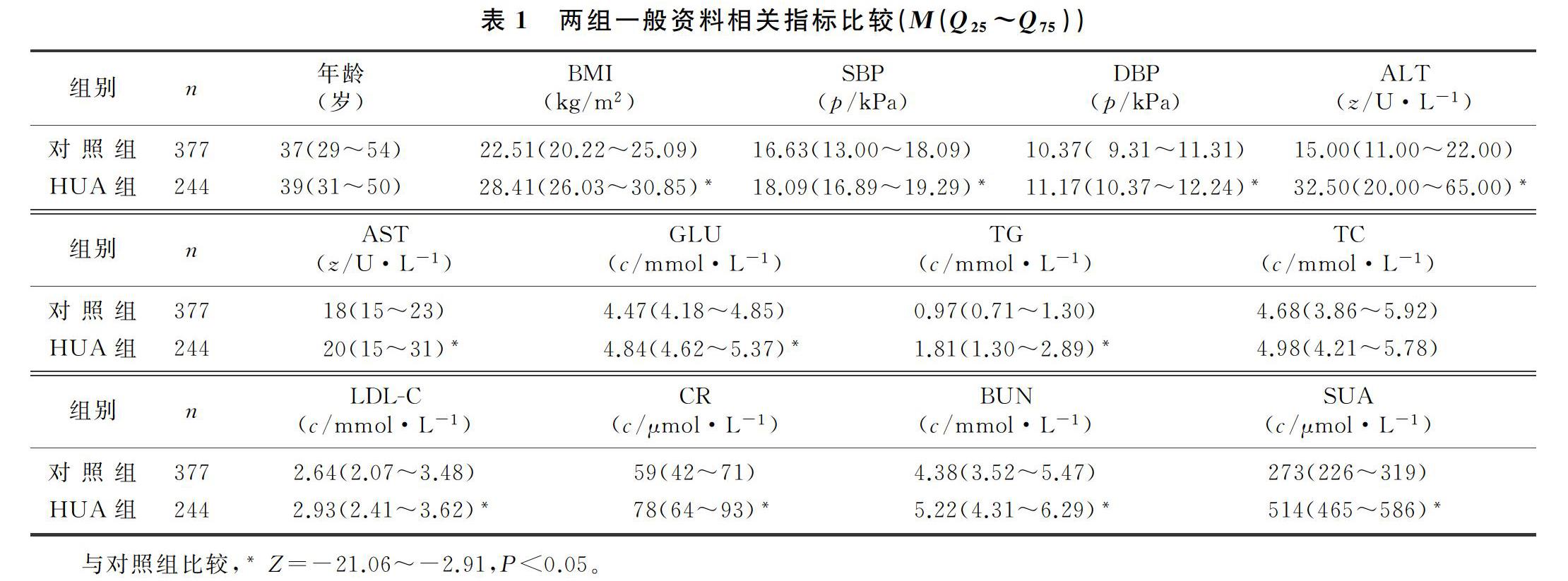
对照组及HUA组的BMI、收缩压(SBP)、舒张压(DBP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、葡萄糖(GLU)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、肌酐(CR)、尿素氮(BUN)及SUA 比较,差异均有统计学意义(Z=-21.06~-2.91,P<0.05),两组年龄、总胆固醇(TC)差异无显著性(P>0.05)。见表1。
2.2 尿液pH值水平與血清生化指标相关性
Spearman相关分析显示,尿液pH值与SUA、TG、GLU、ALT、BMI、CR、BUN等呈负相关(r=-0.428~-0.119,P<0.01)。
2.3 不同SUA水平HUA病人尿液pH值比较
HUA病人尿液pH值水平为5.5(5.0~6.0),显著低于对照组6.0(5.5~6.5),差异有统计学意义(Z=-9.195,P<0.01)。HUA病人尿液pH值<5.5、5.5~6.0、>6.0分别为83(34.0%)、86(35.3%)、75(30.7%)例,而对照组则分别为44(11.7%)、86(22.8%)、247(65.5%)例。HUA病人中尿液pH值<5.5的病人比例显著高于对照组(χ2=45.64,P<0.01)。将HUA病人根据SUA值分为HUA1组(SUA 420~540 μmol/L)140例和HUA2组(SUA>540 μmol/L)104例,对照组、HUA1组与HUA2组尿液pH值分别为6.0(5.5~6.5)、5.5(5.0~6.0)、5.5(5.0~5.5),3组尿液pH值比较差异有显著性(χ2=94.44,P<0.01),其中HUA1组病人尿液pH值显著低于对照组(χ2=35.93,P<0.003),HUA2组显著低于HUA1组(χ2=12.62,P<0.003)。对照组、HUA1组与HUA2组尿液pH值>6.0病人分别为247(65.5%)、53(37.9%)、22(21.1%)例,尿液pH值<5.5的病人分别为44(11.7%)、37(25.7%)及47(45.2%)例。3组病人尿液pH值>6比例差异有显著性(χ2=78.44,P<0.01),HUA1组显著低于对照组(χ2=32.07,P<0.003),HUA2组显著低于HUA1组(χ2=7.82,P<0.017)。3组尿液pH值<5.5比例差异也有显著性(χ2=59.38,P<0.01),其中HUA1组显著高于对照组(χ2=15.39,P<0.003),HUA2组显著高于HUA1组(χ2=10.09,P<0.003)。
2.4 尿液pH值水平危险因素分析
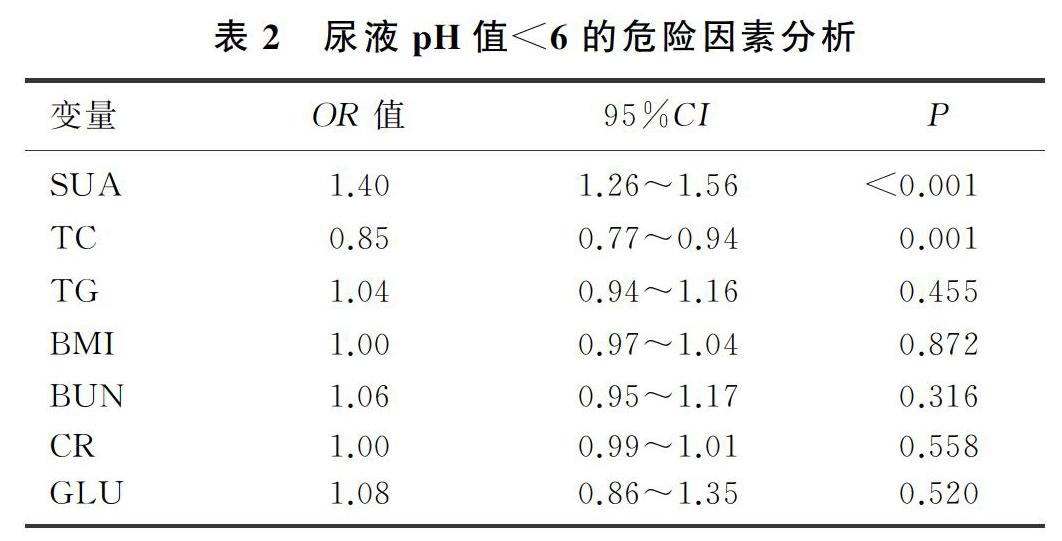
单因素分析显示,影响尿液pH值<6的自变量有TC、BMI、BUN、CR、TG、GLU、SUA。在未对混杂因素校正时,SUA是尿液pH值<6的独立危险因素(OR=1.41,95%CI=1.31~1.52,P<0.01);对上述指标进行校正后,SUA仍是尿液pH值<6的独立危险因素(OR=1.40,95%CI=1.26~1.56,P<0.01)。SUA水平每增加60 μmol/L,尿液pH值<6的风险增加40%。相反,TC是尿液pH值<6的保护因素,其每增加1 mmol/L,尿液pH值<6的风险将减少15%。见表2。
3 讨 论
近年来,中国HUA的发病率呈爆发式增长,20年内增长了近18倍[5],而且HUA病人呈年轻化趋势[6-7]。HUA除引起痛风发作外,还可导致肾脏、心脏、血管、胰腺等全身多个靶器官损害。其中,肾脏损害是HUA最主要的危险因素[4,8]。有调查显示,HUA病人中肾结石的发病率高达30%[9],当SUA水平>780 μmol/L时,肾结石的发病率高达50%,其中约80%为尿酸性肾结石。
尿酸性肾结石的形成与高尿酸尿及低pH值尿有直接关系[10]。当pH值<4.75时,91%以上的尿酸为溶解度低的非离子化尿酸(即游离尿酸),易沉积在肾脏,损害肾实质或形成肾结石;当pH值>6.75时,90%以上的尿酸为溶解度高的离子化尿酸(即尿酸盐),随尿排出体外[11]。本文研究结果显示,HUA病人尿液pH值随着SUA水平的升高呈下降趋势,且当SUA水平高于540 μmol/L时尿液pH值<6.0病人占比近80%,pH值<5.5的病人占比近50%。
尿液pH值的改变与尿中H+浓度的变化密切相关,血液中H+浓度增加(例如酸中毒)或者肾小管分泌到尿液中H+的增多将引起尿液pH值下降。HUA病人尿液pH值降低可能与以下几方面相关。①HUA病人肾小管产NH+4能力降低[12]。正常情况下,近端小管、髓袢升支粗段和远端小管上皮细胞内的谷氨酰胺在谷氨酰胺酶的作用下脱氨,生成NH+4,NH+4既可以通过Na+-H+交换亦可以通过生成NH3进入肾小管腔内,最终缓冲尿液pH值,使其升高。HUA病人肾小管产NH+4能力降低,NH3排泄减少,则尿液pH值降低[13]。②多项研究表明,HUA与代谢综合征之间存在着密切联系,而胰岛素抵抗是代谢综合征的共同病理生理基础[14-17]。HUA作为代谢综合征的组分,其尿液pH值下降很有可能是通过胰岛素抵抗实现的[18]。胰岛素可能通过调控Na+-H+交换,刺激肾小管合成NH3,调节NH3的排泄,影响尿液pH值水平[19]。当发生胰岛素抵抗时体内酸碱平衡[20]和肾小管浓缩稀释功能会受到影响,进而引起尿液pH值的改变[21]。③HUA病人尿液pH值下降可能与其长期的高蛋白以及高嘌呤饮食相关。动物蛋白质摄入量的增加也可能促进尿液酸化,尿液pH值随着含硫酸性氨基酸的摄入和排泄量的增加而降低。
此外,本研究还发现SUA水平是尿液pH值<6.0的独立危险因素。在不伴其他因素的情况下,SUA值每增加60 μmol/L,尿液pH值<6.0的风险增加40%。尤其当SUA水平高于540 μmol/L后,尿液pH值<6.0的病人明显增加,近80%的病人尿液pH值在6.0以下,近50%的病人pH值在5.5以下。当尿液pH值<5.5时尿液呈酸性,尿酸性肾结石形成的可能性明显增加。而尿液pH值在6.2~6.9范围内有助于尿酸盐的溶解和排泄[22],且尿酸性肾结石及钙盐性肾结石的发生率均最低[11]。除此之外,酸性尿本身也会对肾脏产生损伤,尿液pH值降低会促进Pyk2发生自磷酸化进而促进氧自由基生成,导致肾小管间质损伤,引发蛋白尿和肾脏损伤。而碱化尿液则可以减少氧自由基的生成,减轻对肾脏的氧化损伤[23]。2013年《高尿酸血症和痛风治疗的中国专家共识》指出,尿液pH值小于6时应开始碱化尿液[24];2019年发布的《中国高尿酸血症与痛风诊疗指南》进一步提出痛风病人应碱化尿液,尤其是使用促尿酸排泄药物的病人[25]。故对于SUA值>540 μmol/L的病人在降尿酸治疗的同时应联合碱化尿液治疗。
综上所述,HUA病人尿液pH值随着SUA值的升高而降低,SUA值>540 μmol/L的病人应尽早开始碱化尿液从而预防肾结石的生成。而有关影响HUA病人尿液pH值改变的具体过程和机制,以及碱化尿液的具体方案仍有待深入探讨。
[参考文献]
[1] LIU Yan, YAN Li, LU Jun, et al. A pilot study on the epidemiology of hyperuricemia in Chinese adult population based on big data from EMR (Electronic Medical Records), 2014-2018[J]. Minerva Endocrinologica, 2020. doi:10.23736/S0391-1977.20.03131-4.
[2] ALBU A, PARA I, POROJAN M. Uric acid and arterial stiffness[J]. Therapeutics and Clinical Risk Management, 2020,16:39-54.
[3] KIM S, CHANG Y, YUN K E, et al. Development of nephrolithiasis in asymptomatic hyperuricemia:a cohort study[J]. American Journal of Kidney Diseases, 2017,70(2):173-181.
[3] KIM S, CHANG Y, YUN K E, et al. Development of nephrolithiasis in asymptomatic hyperuricemia:a cohort study[J]. American Journal of Kidney Diseases, 2017,70(2):173-181.
[4] LI C C, CHIEN T M, WU W J, et al.Uric acid stones increase the risk of chronic kidney disease[J]. Urolithiasis, 2018,46(6):543-547.
[5] LIU R, HAN C, WU D, et al. Prevalence of hyperuricemia and gout in mainland China from 2000 to 2014: a systematic review and meta-analysis[J]. BioMed Research International, 2015, 2015:1-12.
[6] 毛玉山,周麗诺,李福军,等. 中老年高尿酸血症对血管内皮功能的影响[J]. 中华风湿病学杂志, 2006,10(3):169-171.
[7] LU J, SUN W Y, CUI L L, et al. A cross-sectional study on uric acid levels among Chinese adolescents[J]. Pediatric Nephrology, 2020,35(3):441-446.
[8] MALLAT S G, AL KATTAR S, TANIOS B Y, et al. Hyperuricemia, hypertension, and chronic kidney disease: an emerging association[J]. Curr Hypertens Rep, 2016,18(10):74.
[9] FERRARO P M, CURHAN G C. Serum uric acid and risk of kidney stones[J]. Am J Kidney Dis, 2017,70(2):158-159.
[10] DIBIANCO J M, JARRETT T W, MUFARRI J P. Metabolic syndrome and nephrolithiasis risk: should the medical management of nephrolithiasis include the treatment of metabolic syndrome[J]? Rev Urol, 2015,17(3):117-128.
[11] 李长贵. 实用痛风病学[M]. 北京:人民军医出版社, 2018:39-61.
[12] 张成才. 高尿酸血症与尿酸结石[J]. 中国临床医生, 2009,37(1):18-22.
[13] MAALOUF N M, CAMERON M A, MOE O W, et al. Me-tabolic basis for low urine pH in type 2 diabetes[J]. Clinical Journal of the American Society of Nephrology, 2010,5(7):1277-1281.
[14] ALI N, PERVEEN R, RAHMAN S, et al. Prevalence of hyperuricemia and the relationship between serum uric acid and obesity: a study on Bangladeshi adults[J]. PLoS One, 2018,13(11):e0206850.
[15] LIU P W, CHANG T Y, CHEN J D. Serum uric acid and metabolic syndrome in Taiwanese adults[J]. Metab: Clin Exp, 2010,59(6):802-807.
[16] YANG T, CHU C H, BAI C H, et al. Uric acid level as a risk marker for metabolic syndrome:a Chinese cohort study[J]. Atherosclerosis, 2012,220(2):525-531.
[17] GONG M, WEN S, NGUYEN T, et al. Converging relationships of obesity and hyperuricemia with special reference to metabolic disorders and plausible therapeutic implications[J]. Diabetes, Metabolic Syndrome and Obesity:Targets and The-rapy, 2020,13:943-962.
[18] ASPLIN J R, GOLDFARB D S. Effect of thiazolidinedione therapy on the risk of uric acid stones[J]. Kidney Int, 2019,95(5):1022-1024.
[19] KLISIC J, HU M C, NIEF V, et al. Insulin activates Na(+)/H(+) exchanger 3:biphasic response and glucocorticoid dependence[J]. Am J Physiol Ren Physiol, 2002,283(3):F532-F539.
[20] ABATE N, CHANDALIA M, CABO-CHAN A V Jr, et al. The metabolic syndrome and uric acid nephrolithiasis:novel features of renal manifestation of insulin resistance[J]. Kidney International, 2004,65(2):386-392.
[21] 周勇,應莉,徐佳佳,等. 尿液pH值与2型糖尿病肾病的相关性研究[J]. 中国现代医生, 2018,56(19):132-134,138.
[22] TRINCHIERI A, ESPOSITO N, CASTELNUOVO C. Dissolution of radiolucent renal stones by oral alkalinization with potassium citrate/potassium bicarbonate[J]. Arch Italiano Di Urol Andrologia: Organo Ufficiale[di] Soc Italiana Di Ecografia Urol E Nefrologica, 2009,81(3):188-191.
[23] SOUMA T, ABE M, MORIGUCHI T, et al. Luminal alkalinization attenuates proteinuria-induced oxidative damage in proximal tubular cells[J]. Journal of the American Society of Nephrology: JASN, 2011,22(4):635-648.
[24] 中华医学会内分泌学分会. 高尿酸血症和痛风治疗的中国专家共识[J]. 中华内分泌代谢杂志, 2013,29(11):913-920.
[25] 中华医学会内分泌学分会. 中国高尿酸血症与痛风诊疗指南(2019)[J]. 中华内分泌代谢杂志, 2020,36(1):1-13.
(本文编辑 黄建乡)
