草海桐链格孢叶斑病菌生物学特性及杀菌剂的室内筛选
2020-09-26王义胡美姣李敏高兆银洪小雨张绍刚赵超
王义 胡美姣 李敏 高兆银 洪小雨 张绍刚 赵超


摘 要:西沙群岛草海桐链格孢叶斑病发生普遍,前期笔者鉴定了该病的病原菌为长柄链格孢菌(Alternaria longipes)。为进一步明确该病原菌的生物学特性及其对杀菌剂的敏感性,采用生长速率法对长柄链格孢菌的生物学特性进行了初步研究,并测定了苯醚甲环唑等13种杀菌剂对该病原菌的室内毒力。结果表明:该菌菌落最适生长培养基为马铃薯葡萄糖固体培养基(PDA),其次是马铃薯蔗糖固体培养基(PSA);适宜生长温度范围为25~30 ℃,最适生长温度为28 ℃;适宜生长pH为5.0~7.0,最适pH为6.0;最佳碳源为蔗糖,而果糖不利于菌落生长;最佳氮源为甘氨酸,而尿素不利于菌落生长;光照时间对菌落生长无显著影响。室内毒力测定表明,苯醚甲环唑水分散粒剂的抑菌效果最好,EC50值为0.15 ?g/mL,其次是氟硅唑乳油、己唑醇悬浮剂和戊菌唑乳油,其EC50值分别为0.37、0.44和0.51 ?g/mL,嘧菌酯悬浮剂和多菌灵可湿性粉剂的抑菌效果最差,EC50值均大于3000 ?g/mL。
关键词:草海桐;长柄链格孢;生物学特性;杀菌剂;毒力测定
中图分类号:S763.7 文献标识码:A
Abstract: Alternaria leaf blight of Scaevola taccada is a common and serious disease in Xisha Island. The pathogen of the disease was identified as Alternaria longipes. To further clarify the biological characteristics of the pathogen and its sensitivity to fungicides. Therefore, in this study, the biological characteristics of A. longipes were preliminarily studied by the mycelium growth rate method, and the toxicological test of 13 fungicides such as difenoconazole to this pathogen was determined. The optimum growth medium was potato dextrose agar medium (PDA), followed by potato sugar agar medium (PSA). The suitable growth temperature was 25 to 30 ℃, and the optimum growth temperature was 28 ℃. The suitable pH value was 5.0 to 7.0, and the optimum pH value was 6.0. The optimal carbon source was sucrose, while fructose was not conducive to colony growth. The optimal nitrogen source was glycine, while urea was not conducive to colony growth. Light time had no significant effect on colony growth. Laboratory toxicity test showed that the best inhibition effect was found in difenoconazole water-dispersible granular with EC50 value of 0.15 ?g/mL, followed by flusilazole emulsion, hexazolium suspension agent and penconazole emulsion, with EC50 values of 0.37, 0.44 and 0.51 ?g/mL, respectively, while azoxystrobin suspension agent and carbendazol wettable powder had the worst inhibitory effect, with an EC50 value of more than 3000 ?g/mL.
Keywords: Scaevola taccada; Alternaria longipes; biological characteristics; fungicide; toxicological test
DOI: 10.3969/j.issn.1000-2561.2020.08.018
草海桐(Scaevola taccada)又稱羊角树、小草海桐、水草仔[1],是草海桐科(Goodeniaceae)草海桐属(Scaevola)多年生常绿亚灌木植物[2],广泛分布于热带、亚热带太平洋和印度洋沿岸[3-4],是典型的滨海适生植物。我国主要分布于海南、台湾、福建、广东和广西等南部沿海滩涂地区[5]。草海桐生长迅速,具有极强的抗风、耐盐、耐旱性,具有较高的光合能力和水分利用效率,从而在热带岛屿上表现出良好的适应能力[6-7],常在各个岛屿形成单优群落[8]。因此,草海桐被选作岛屿、岛礁的主要海岸固沙防潮树种[2]和原生绿化观赏植物[9]。国外对草海桐属植物病害的报道最早可追溯到1928年,在澳大利亚珀斯发现了由Puccinia dampierae引起的草海桐叶锈病[10],此后陆续报道了草海桐属植物上的病害,在澳大利亚穆拉和达尔文市分别发现Uromyces sp.和Mycosphaerella scaevolae引起的草海桐叶锈病和叶斑病[11-13],在日本关岛发现Capnodium sp.、Mycosphaerella sp.和M. scaevolae为害草海桐引起叶斑病[11-12],在新喀里多尼亚发现Pseudocercospora scaevolae和Cercospora scaevolae引起草海桐叶斑病[13-15],在美国佛罗里达和夏威夷分别发现黄瓜花叶病毒(Cucumber mosaic virus, CMV)和Zasmidium scaevolicola引起草海桐叶片褪绿环状病斑和叶斑症状[14-15]。然而,中国目前除台湾在2009年报道了草海桐病毒病外[16],尚无草海桐真菌病害的相关报道。
笔者于2018—2019年在西沙群岛进行植物病害调查时,发现一种草海桐叶斑病发生普遍,严重影响草海桐的生长和观赏价值。前期通过常规组织
分离法、致病性测定、形态学和分子生物学的方法,确定草海桐叶斑病的病原为长柄链格孢菌Alternariu longipes (Ellis & Everh.) EW. Mason[17-18]。属半知菌类、丝孢纲、丝孢目、暗色孢科、链格孢属[19]。该菌寄主范围主要包括白术[20]、油棕[21]、马铃薯[22]、非洲菊[23]、紫花苜蓿[24]、菝葜[25]、落花生[26]和烟草[27-29],其中长柄链格孢菌(A. longipes)引起的烟草赤星病在世界各主要烟草种植区广泛发生,造成严重的经济损失[28-30]。本研究拟在草海桐叶斑病病原菌鉴定的基础上,进一步开展该病原菌的生物学特性及防治药剂筛选研究,以期为更好防治该病害和保护海岸生态环境提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 长柄链格孢菌(A. longipes),分离自西沙群岛草海桐病叶,纯化、保存备用。
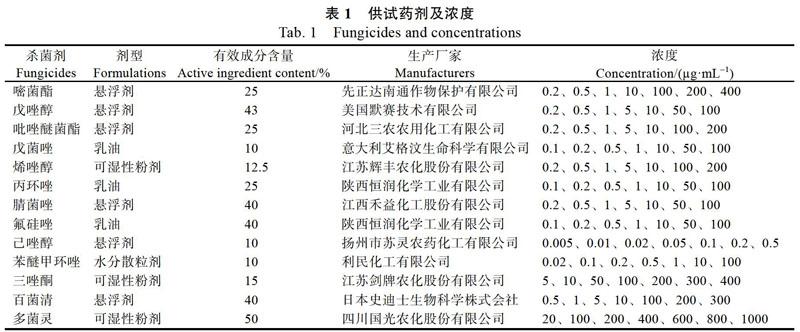
1.1.2 供试药剂 供试杀菌剂的名称、生产厂家及所用浓度如表1所示。
1.1.3 供试培养基 马铃薯葡萄糖固体培养基(PDA)、马铃薯葡萄糖液体培养基(PDB)、查氏固体培养基(Czapek)、马铃薯牛肉膏培养基(PDBA)、马铃薯蔗糖固体培养基(PSA)、燕麦片培养基(OMA)、燕麦粉琼脂培养基(OA)、玉米粉琼脂培养基(CMA),配好培养基于121 ℃湿热灭菌20 min[31]。
1.2 方法
1.2.1 培养基种类对菌落生长的影响 将已活化病原菌用打孔器(Φ=5.0 mm)打孔,分别接种在PDA、Czapek、PDBA、PSA、OMA、OA和CMA 7种不同培养基平板中央。置于28 ℃恒温黑暗培养箱中培养7 d,采用十字交叉法测量菌落直径并观察菌落形态,每个处理重复3次。
1.2.2 培养条件对菌落生长的影响 温度对菌落生长的影响:将病原菌接种于PDA平板中央,分别置于5、10、15、20、25、28、30、35、40 ℃恒温培养箱中黑暗培养[32],每个处理3皿,重复3次,其余方法同1.2.1。
pH对菌落生长的影响:用已灭菌的1.0 mol/L HCl和1.0 mol/L NaOH将灭菌的PDA培养基pH分别调为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0共10个梯度,倒入9.0 cm平板,冷却,将直径5.0 mm的菌饼,接种于不同pH的平板中央,28 ℃下黑暗培养,每个处理3皿,重复3次,其余方法同1.2.1。
碳源对菌落生长的影响:以Czapek固体培养基作为基础培养基,以等质量的可溶性淀粉、乳糖、麦芽糖、果糖、葡萄糖和木糖替代蔗糖做成不同碳源固体培养基,以不加蔗糖的Czapek培养基作为无碳对照[33],于28 ℃恒温黑暗培养,每个处理设置3次重复,其余方法同1.2.1。
氮源对菌落生长的影响:以Czapek固体培养基作为基础培养基,以等质量氮素的硫酸铵、氯化铵、尿素、蛋白胨、酵母粉、丙氨酸、甘氨酸和赖氨酸替代硝酸钠制成不同氮源的固体培养基,以不加硝酸钠的Czapek培养基作为无氮对照。于28 ℃恒温黑暗培养,每个处理设置3次重复,其余方法同1.2.1。
光照对菌落生长的影响:取菌饼接种于PDA平板中央,置于人工气候箱(Climacell 222,单门),5根灯管(18 W/根),培养皿与灯管距离为10 cm,分别采用全光照(7 d)、12 h光照+12 h黑暗交替和全黑暗(7 d)条件下,于28 ℃恒温培养,每处理重复3次,其余方法同1.2.1。
1.2.3 杀菌剂室内毒力测定 研究13种杀菌剂对长柄链格孢菌菌落生长的影响,首先进行药剂浓度粗筛试验,采用含药平板法进行试验[34],每个药剂设置5个浓度梯度(1、10、50、100、200 ?g/mL),接菌饼于平板中央,于28 ℃恒温培养,7 d后测量菌落直径,计算菌丝生长抑制率(如下式),每个处理重复3次。复筛试验依据初筛试验的菌落抑制率,设计了7个合适的复筛浓度(表1),以无菌水作为对照,方法同1.2.1,每个处理重复3次,计算抑制率。以复筛试验设定浓度对数为横坐标,抑制几率值为纵坐标,计算回歸方程和相关系数,并由回归方程计算半最大效应浓度(EC50值)。
菌丝生长抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-0.5)×100%
1.3 数据处理
采用Excel 2013软件进行数据整理分析,求出毒力回归方程、EC50值和相关系数(r),用SPSS 17.0软件进行最小显著差异法(LSD)检验。
2 结果与分析
2.1 不同培养基对菌落生长的影响
结果显示,长柄链格孢菌在7种培养基上均能较好生长,培养7 d后菌落直径都在6.00 cm以上;其中在PDA、PSA、Czapek和OMA上生长较好,菌落直径均在7.00 cm以上,在PDA上生长最好,菌落直径最大,气生菌丝最茂盛,在第7天菌落直径达到8.15 cm;在PDBA上生长最差,菌落直径最小,但气生菌丝较茂盛,菌落直径为6.08 cm;在OMA、OA、CMA培养基上菌落直径较大,但菌丝生长稀疏(表2)。
2.2 不同温度对菌落生长的影响
结果表明,长柄链格孢菌在5~35 ℃的温度范围内都能生长,适宜生长温度为25~30 ℃,28 ℃菌落生长最好,温度高于40 ℃菌落不生长。且不同温度下菌落大小和菌丝密度有较大差异。温度为5 ℃时,菌落在第4天开始生长,7 d后菌落直径仅1.40 cm,菌落白色,菌丝稀疏;温度高于40 ℃时菌落不生长,表明该菌较耐低温,耐高温性较差;在28 ℃时菌落生长最好,菌落直径最大,在第7天菌落直径达8.35 cm,菌落中间墨绿色,边缘灰白色,菌丝生长密集,表明该菌的最适生长温度为28 ℃(表3)。
2.3 不同pH对菌落生长的影响
试验结果发现,长柄链格孢菌能适应较宽的pH值范围,在pH为3.0~12.0之间都能生长,较适宜生长的pH范围为5.0~7.0,pH为6.0时生长最好,培养7 d的菌落直径达最大;酸性条件(pH 3.0~4.0)严重抑制生长,菌落直径较小,不利于该菌生长;碱性条件(pH 8.0~12.0)对菌落生长影响不大,菌落直径保持在6.20 cm左右。表明长柄链格孢菌更适宜在中性和碱性条件下生长,酸性条件不利于其生长(表4)。
2.4 不同碳源对菌落生长的影响
长柄链格孢菌在不同碳源上均能生长,菌落生长大小差异不显著,该菌在含乳糖、淀粉、木糖和蔗糖的培养基上生长都较好,培养7 d的菌落直径均达5.30 cm以上;在蔗糖培养基上生长最好,气生菌丝茂密,菌落直径达5.66 cm;在含果糖和葡萄糖的培养基上菌落直径较小,但气生菌丝茂盛;在无糖培养基上菌落直径(Φ= 5.25 cm)虽然较大,但是菌丝生长稀疏。表明该菌能较好利用乳糖、木糖、蔗糖和淀粉作为碳源,在无碳条件下也能生长,但长势差,菌丝非常稀疏(表5)。
2.5 不同氮源对菌落生长的影响
试验结果表明,长柄链格孢菌在含不同氮源的培养基上均能生长。在含有蛋白胨、硝酸钠、丙氨酸和甘氨酸的培养基上生长较好,气生菌丝旺盛,菌落直径较大,培养7 d的菌落直径为5.32~5.85 cm;在甘氨酸培养基上生长的最好,菌丝茂密,菌落直径最大,达5.85 cm;该菌在无氮培养基上也能生长,但生长较差,气生菌丝较少,菌落直径为3.67 cm;在含尿素培养基上生长最差,培养7 d的菌落直径为2.08 cm,菌落呈棕褐色,气生菌丝少。表明该菌能较好的利用甘氨酸、蛋白胨和硝酸钠作为氮源,能在含尿素培养基和无氮条件下生长,但生长较差,稀疏(表6)。
2.6 不同光照对菌落生长的影响
不同光照对长柄链格孢菌菌落生长无显著影响,培养7 d的菌落直径均在7.10 cm以上,光暗交替菌落直径最大。不同光照条件下,菌落形态有所差异。全光照培养,菌落中央为灰白色,边缘白色、整齐,气生菌丝较厚;12 h光照+12 h黑暗培养,菌落中央灰褐色,边缘白色、整齐,气生菌丝较厚;全黑暗条件培养,菌落中央为墨绿色,边缘白色,气生菌丝最厚,密度最大(表7)。
2.7 不同杀菌剂对菌落生长的影响
试验结果发现,13种杀菌剂中苯醚甲环唑的抑制效果最好,嘧菌酯和多菌灵抑制效果最差。其中 10% 苯醚甲环唑水分散粒剂的抑制效果最好,EC50值为0.15 ?g/mL,其次是40%氟硅唑乳油、10%己唑醇悬浮剂和 10% 戊菌唑乳油,EC50值分别为0.37、0.44和0.51 ?g/mL,再次是12.5%烯唑醇可湿性粉剂、43%戊唑醇悬浮剂、25%丙环唑乳油、25%吡唑醚菌酯悬浮剂和 40% 腈菌唑悬浮剂,EC50值在1.0~3.0 ?g/mL之间,对长柄链格孢菌菌落生长抑制效果较差的是15%三唑酮可湿性粉剂和40%百菌清悬浮剂,EC50值分别为37.80、44.07 ?g/mL,而抑制效果最差的为25%嘧菌酯悬浮剂和50%多菌灵可湿性粉剂,EC50值分别为3928.25、358 096.44 ?g/mL(表8)。
3 讨论与结论
對西沙群岛草海桐链格孢病菌的生物学特性研究表明,该菌的菌落适宜生长温度范围为25~ 30 ℃,最适生长温度为28 ℃;菌落在pH为3.0~12.0之间都能生长,适宜生长pH范围为5.0~7.0,最适生长pH为6.0。这与龙亚琴[35]、黎妍妍等[36]研究的烟草赤星病菌(长柄链格孢菌)的最适温度和pH基本一致。该病原菌在含有乳糖、淀粉、木糖和蔗糖的培养基上菌落生长都较好,在蔗糖上生长最好;在含有蛋白胨、硝酸钠、丙氨酸和甘氨酸的培养基上生长较好,在甘氨酸上生长最好,与部分研究稍有差异。龙亚琴[35]研究认为链格孢病菌在淀粉和酵母膏上生长最好,黎妍妍等[36]研究认为最适氮源为氯化铵。这些研究结果的差异可能是由于病原菌不同分离地点和寄主等原因引起的。光照时间对该菌菌落生长无明显影响。在PDA、Czapek、PDBA、PSA、OMA、OA和CMA 7种培养基上均能较好生长,培养7 d菌落直径均可达到6.0 cm以上,在PDA上生长最好,菌落直径最大,气生菌丝最茂盛,菌落中间墨绿色,边缘灰白色,整齐,背面中央褐色,边缘白色。比较该病菌对温度、pH、培养基质及光照的敏感性时发现,该病菌对温度最为敏感,低于20 ℃或高于30 ℃时病菌生长将受到很大抑制,而西沙群岛年均温27 ℃的温度条件非常有利于该病害的发生和传播。
草海桐长柄链格孢菌室内毒力测定表明,供试的13种杀菌剂对菌落生长均有一定的抑制作用,随着浓度的增加,抑制效果增强,但不同药剂的抑制效果有所差异,其中10%苯醚甲环唑水分散粒剂的抑制效果最好,EC50值为0.15 ?g/mL;其次是40%氟硅唑乳油、10%己唑醇悬浮剂和10%戊菌唑乳油,EC50值分别为0.37、0.44和0.51 ?g/mL;而15%三唑酮可湿性粉剂和40%百菌清悬浮剂对该菌的抑制效果较差,EC50值分别为37.80、44.07 ?g/mL;抑制效果最差的为25%嘧菌酯悬浮剂和50%多菌灵可湿性粉剂,EC50值分别为3 928.25、358 096.44 ?g/mL。本研究结果表明,对长柄链格孢菌抑制效果最好的为苯醚甲环唑,其次是氟硅唑、己唑醇和戊菌唑。研究结果为今后防治长柄链格孢菌提供了理论基础。但是苯醚甲环唑、氟硅唑乳油、己唑醇悬浮剂和戊菌唑乳油均为三唑类杀菌剂,已有研究表明三唑类杀菌剂为有机杂环类化合物,在植物体内抑制病菌的附着胞、吸器的正常发育和阻碍真菌麦角甾醇的生物合成,但作用位点相对单一,存在潜在的高水平抗性风险[37-39]。而且西沙群岛地理位置特殊,大量使用化学杀菌剂对当地生态环境不利,因此,合理使用高效低毒或配合生物农药进行防治是下一步研究的主要方向。
参考文献
粟 米, 何思宁, 李炜曦, 等. 珍稀植物海南草海桐基于ITS序列分析的系统位置研究[J]. 中山大学学报(自然科学版), 2016, 55(1): 16-23.
郭 艳, 夏快飞, 张 美, 等. 滨海适生植物草海桐Actin基因片段的克隆及序列分析[J]. 生物技术世界, 2016(5): 39-40.
任 海, 简曙光, 张倩媚, 等. 中国南海诸岛的植物和植被现状[J]. 生态环境学报, 2017, 26(10): 1639-1648.
Goldstein G, Drake D R, Alpha C, et al. Growth and photosynthetic responses of Scaevola sericea, a Hawaiian coastal shrub, to substrate salinity and salt spray[J]. International Journal of Plant Sciences, 1996, 157(2): 171-179.
陈恒彬. 福建滨海观赏植物的多样性及园林应用[J]. 亚热带植物科学, 2018, 47(4): 345-351.
罗 琦, 刘 慧, 吴桂林, 等. 基于功能性状评价5种植物对热带珊瑚岛环境的适应性[J]. 生态学报, 2018, 38(4): 1256-1263
吴礼彬. 南海西沙群岛生态环境演化过程的碳氮同位素地球化学研究[D]. 合肥: 中国科学技术大学, 2018.
童 毅, 简曙光, 陈 权, 等. 中国西沙群岛植物多样性[J]. 生物多样性, 2013, 21(3): 364-374.
Goss O M. A revised list of diseases of ornamental plants recorded in Western Australia[J]. Journal of the Department of Agriculture, Western Australia, Series 4, 1964, 5(9): 589-603.
MacNish G C. Diseases recorded on native plants, weeds, field and fibre crops in Western Australia[J]. Journal of the Department of Agriculture, Western Australia, Series 4, 1963, 4(6): 401-408.
Sutar N G, Kulkarni A, Arangale K B. Literature review of Scavola taccada[J]. World Journal of Pharmaceutical Research, 2017, 6(11): 251-258.
Daly A, Hennessy C. Mycosphaerella leaf spot of Scaevola taccada[J]. Agnote-Northern Territory of Australia, 2007, I68: 2.
Schlub R L. Index of plant disease in Guam[J]. The College of Natural & Applied Sciences (CNAS), University of Guam, 2017.
Braun U, Mouchacca J, McKenzie E H C. Cercosporoid hyphomycetes from New Caledonia and some other South Pacific islands[J]. New Zealand Journal of Botany, 1999, 37(2): 297-327.
Shivas R G, McTaggart A R, Young A J, et al. Zasmidium scaevolicola[J]. Persoonia. 2010, 24: 132-133.
翁容淑. 由草海桐黄化轮斑病株所分离之胡瓜嵌纹病毒特性之研究[D]. 屏东: 屏东科技大学植物医学系所, 2009.
Wang Yi, Zhao Chao, Hu Meijiao, et al. Identification of the pathogen Alternaria longipes causing Scaevola taccada leaf spot [C]//中国植物病理学会2019年学术年会论文集, 2019: 78
Norse D. Lesion and epidemic development of Alternaria longipes (Ell. & Ev.) Mason on tobacco[J]. Annals of Applied Biology, 2010, 69(2): 105-123.
Simmons E G. Alternaria: an indentification manual[M]. CBS Biodiversity Series 6. CBS Fungal Biodiversity Centre, Utrecht, The Netherlands. 2007.
檀國印. 白术真菌病害的分离鉴定及其根际促生菌的筛选[D]. 北京: 中国林业科学研究院, 2013.
Suwannarach N, Kumla J, Lumyong S. First report of Alternaria leaf blight disease on oil palm caused by Alternaria longipes in Thailand[J]. Phytoparasitica, 2015, 43(1): 57-59.
Shoaib A, Akhtar N, Akhtar S, et al. First report of Alternaria longipes causing leaf spot of potato cultivar Sante in Pakistan[J]. Plant Disease, 2014, 98(12): 1742-1742.
Mirkova E, Konstantinova P. First report of Alternaria leaf spot on gerbera (Gerbera jamesonii H. Bolux ex JD Hook) in Bulgaria[J]. Journal of Phytopathology, 2003, 151(6): 323-328.
Maiti C K, Sen S, Paul A K, et al. First report of leaf blight of Medicago sativa caused by Alternaria longipes in India[J]. Journal of Plant Pathology, 2007, 89(3): S69-S76.
Long Y, Hsiang T, Huang J, et al. First report of leaf spot of Smilax china caused by Alternaria longipes in China[J]. Plant Pathology, 2009, 58(4): 800.
Giri G S, Murugesan K, et al. A first report of Alternaria longipes on groundnut from Tamil Nadu, India[J]. International Arachis Newsletter, 1996(16): 35.
Ramm C. Histological studies of infection by Alternaria longipes on tobacco[J]. Journal of Phytopathology, 1962, 45(4): 391-398.
Ayoub M. Chemical control of brown leaf spot disease of tobacco (DV Cigarette) by Alternaria longipes[J]. Pak Tobacco (Pakistan), 2004: 15-17.
Yang J, Yin Z Q, Kang Z T, et al. Transcriptomic profiling of Alternaria longipes invasion in tobacco reveals pathogenesis regulated by AlHK1, a group III histidine kinase[J]. Scientific Reports, 2017, 7(1): 16083.
Norse D, Wheeler B E J. Perennation of Alternaria longipes and the early stages of its development on tobacco[J]. Annals of Applied Biology, 2008, 67(1): 23-34.
沈 萍, 陈向东. 微生物学实验[M]. 4版. 高等教育出版社, 2007.
于 莉, 李 赤, 李文健, 等. 烟草赤星病菌生物学特性的研究[J]. 吉林农业大学学报, 1994(2): 31-35.
胡美姣, 杨 波, 李 敏, 等. 海南芒果果腐病病原菌鉴定及其生物学特性研究[J]. 热带作物学报, 2013, 34(8): 1564-1569.
暴增海, 马桂珍, 杨文兰, 等. 玉米弯孢霉叶斑病的初侵染来源及几种杀菌剂的室内毒力测定[J]. 吉林农业大学学报, 2002, 24(4): 53-57.
龙亚琴. 金刚藤叶斑病病原学、发生规律及防治技术研究[D]. 武汉: 华中农业大学, 2009.
黎妍妍, 杨 涛, 贾欣欣, 等. 湖北省烟草赤星病菌生物学特性研究[J]. 湖北农业科学, 2018, 57(22): 27-31.
王 丽, 周增强, 侯 珲. 十年来苹果轮纹病菌对戊唑醇的敏感性变化[J]. 中国南方果树, 2019(3): 99-101.
Stehmann C, De Waard M A. Sensitivity of populations of Botrytis cinerea to triazoles, benomyl and vinclozolin[J]. European Journal of Plant Pathology, 1996, 102(2): 171-180.
安久棟, 国立耘, 朱小琼, 等. 长期施药果园中的苹果轮纹病菌对戊唑醇和甲基硫菌灵的敏感性[J]. 植物保护, 2016, 42(2): 187-191.
