混合无机氮源下6株微藻对亚硝态氮、氨氮净化规律初探
2020-09-23苟万里李自英武心华文双喜
苟万里,李自英,武心华,文双喜,杨 智
( 1.贵阳学院 环境与生物工程学院,贵州 贵阳 550005; 2.青岛蔚蓝生物集团股份有限公司,山东 青岛 266000 )
近些年来,集约化水产养殖发展迅速,其高密度、高投饵的养殖方式在水体中累积了大量含氮排泄物和残饵[1],导致养殖水体的富营养化程度严重,尤其是养殖中后期,水体中的氨氮、亚硝态氮、硝态氮含量普遍偏高甚至超标[2],给养殖动物带来潜在危害[3-4]。据研究,亚硝态氮作用于水生动物体内的血红蛋白或铜蓝蛋白、溶氧酶和抗氧化酶,影响水产动物的血液载氧功能和免疫功能,水产动物长期处于亚硝态氮超标的水体会出现“游塘”、“浮头”、“偷死”、“冒底”等现象[5]。氨氮在高pH时以分子氨为主,分子氨影响鱼类正常生理活动,易造成暴发性出血病的流行[6];影响虾类生长和变态,破坏血细胞的超微结构,使鳃上皮细胞溶解、角质层受损,鳃腔内出现空泡化现象等[7]。因此,如何控制池塘水体中的亚硝态氮和氨氮含量使之处于安全范围之内是高密度水产养殖生态环境管理上的重要问题[8-9]。
微藻是池塘养殖中必不可少的低等植物,是水体的初级生产者和优质生物饵料,也能吸收利用各种形式的无机氮而起到净化水体的作用[10]。研究表明,当以氨氮、亚硝态氮或硝态氮为唯一氮源时,各类微藻对相应的无机氮均具有良好的净化能力[11-13]。当培养体系中同时存在氨氮和硝态氮时,大多数微藻尤其是蓝绿藻优先净化氨氮[14-15];在总氮充足的条件下,水体中超过1 μmol/L的氨氮会抑制微藻对硝态氮的净化,且其抑制程度受藻种、光照度、总氮量等因素的影响[16-18]。当水体中同时存在硝态氮和亚硝态氮时,通常认为硝态氮会抑制亚硝态氮的净化[19]。当水体中同时存在氨氮、硝态氮、亚硝态氮时,有关微藻对这3类氮源净化规律的报道不多,目前仅见以养殖鱼、虾的水为培养基的报道[20-22],这种培养基除了含有上述3种无机氮外,还含有一定量的有机氮。目前,尚未见关于微藻在仅以氨氮、硝态氮、亚硝态氮为氮源的水体中生长时对这3种无机氮的净化规律的研究报道。
为进一步研究微藻对3种无机氮源的净化规律,同时考虑到氨氮和亚硝态氮在水产养殖水体中的潜在危害,笔者在实验室条件下,以添加了少量氨氮和亚硝态氮且不含有机氮源的改良F/2培养基培养水产养殖中常见的6种饵料微藻,分析不同微藻培养液中亚硝态氮和氨氮含量的变化趋势,研究微藻在混合无机氮源下净化氨氮和亚硝态氮的优先顺序,以期为利用微藻控制水体亚硝态氮和氨氮含量提供参考依据,同时筛选出能快速净化亚硝态氮和氨氮的候选藻种。
1 材料与方法
1.1 藻种及其培养基
试验所用的栅藻(Scenedesmussp.)、三角褐指藻(Phaeodactylumtricornutum)、小新月菱形藻(Nitzschiaclosterium)、亚心形扁藻(Platymonassubcordiformis)、塔胞藻(Pyramimonassp.)由中国海洋大学藻种库引进,在本试验中的编号依次为KDN7、KDN13、KDN18、KDN20、KDN21。一株由笔者分离的硅藻,根据形态初步鉴定为双眉藻属(Amphorasp.),其编号为KDN17,显微镜下的形态见图1。

图1 双眉藻KDN17的显微照片(×400)
以F/2培养基[23]扩繁各株绿藻,以添加了50 mg/L NaSiO3·9H2O(分析纯)的F/2培养基扩繁各株硅藻。其他试验所用培养基均去掉扩繁用培养基中的维生素,其余成分保持不变,同时添加一定量分析纯级的硫酸铵、亚硝酸钠以提供氨氮和亚硝态氮。所用水均为蒸馏水。
1.2 藻类的扩繁
将上述各藻种的储备培养物转接在新鲜无菌的培养基中,于温度25 ℃、光照度12 000 lx、光照周期14 L∶10 D、早晚各摇瓶1次的条件下培养4~5 d,经检查达到对数生长期后,再转接到新鲜的培养基中,如此反复转接培养2~3次,用生长旺盛并处于对数期的藻液做后续试验。
1.3 混合氮源下微藻的生长及其对氨氮、亚硝态氮的净化
以扩增繁殖用的培养基为基础,向其中加入一定量的(NH4)2SO4和NaNO2,使培养基中的氨氮质量浓度为2.0 mg/L,亚硝态氮质量浓度为1.0 mg/L。取1.2中扩增繁殖至对数期的新鲜藻液30 mL于8000 r/min、4 ℃离心10 min,弃上清液,用新配制的培养基悬浮沉淀,于同样条件下离心,再用30 mL新配制的培养基悬浮沉淀,取悬浮藻液接种入新鲜培养基中。每个藻株做3个平行,每个平行的培养体积为3000 mL,盛于灭菌过的5000 mL带塞锥形瓶中,接种后立即取藻液20 mL,检测初始氨氮、亚硝态氮质量浓度及初始藻细胞密度,之后每日于光照结束时摇匀后取适量藻液(第1~2 d取50 mL藻液,第3~6 d取100 mL藻液),检测其中的氨氮、亚硝态氮质量浓度和藻细胞密度,按下式计算相关数据:
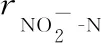
1.4 相关指标的检测方法
氨氮的检测采用靛酚蓝比色法[24];亚硝态氮含量的检测采用盐酸萘乙二胺比色法[25];藻细胞密度采用血球计数板显微直接计数法[26]。
1.5 各指标变化趋势图绘制
采用Origin 8.5绘图,以培养时间为横坐标,以藻细胞密度、氨氮质量浓度、亚硝态氮质量浓度为纵坐标,获得各株微藻的生长曲线以及在培养过程中各藻株培养液中氨氮质量浓度和亚硝态氮质量浓度的变化趋势图。以培养时间为横坐标,以每日的氨氮相对净化率、亚硝态氮相对净化率为横坐标获得各藻株对氨氮、亚硝态氮净化情况的柱形图。
2 结果与分析
2.1 混合无机氮源下各株藻的生长情况及其培养液中氨氮、亚硝态氮质量浓度变化趋势
2.1.1 栅藻KDN7
栅藻KDN7藻细胞密度在第0~3 d先升后降,但变化幅度不大,此阶段的相对生长速率为0.155(迟滞期);第3~5 d细胞密度由4.10×104个/L快速增至3.52×105个/L,相对生长速率为1.075(对数期);第6 d由3.52×105个/L降至2.69×105个/L,相对生长速率为-0.134(衰亡期)。可见,整个培养期该藻经历了一个相对完整的生长周期,细胞生长充分(图2a)。
由亚硝态氮质量浓度趋势线(图2b)可知,亚硝态氮质量浓度先略微上升然后较快下降;第0~2 d,由1.000 mg/L升至1.033 mg/L,相对净化速率为-0.016 mg/(L·d),即每日产生亚硝态氮0.016 mg/L;第2~6 d,由1.033 mg/L降至0.692 mg/L,相对净化速率为0.085 mg/(L·d)。
由氨氮质量浓度的趋势线(图2c)可知,氨氮质量浓度呈先降后升趋势。第0~2 d,由1.999 mg/L降至0.086 mg/L,氨氮相对净化速率为0.957 mg/(L·d);第2~6 d,由0.086 mg/L迅速升至0.980 mg/L,相对净化速率为-1.217 mg/(L·d),即每日产生1.217 mg/L氨氮。

图2 栅藻KDN7培养液中细胞密度(a)、亚硝态氮质量浓度(b)、氨氮质量浓度(c)的变化情况
比较氨氮质量浓度和亚硝态氮质量浓度趋势线可知,在氨氮质量浓度快速下降阶段(即第0~2 d),亚硝态氮质量浓度轻微上升;在亚硝态氮质量浓度较快下降阶段(即第3~6 d),氨氮质量浓度却以较快的速度升高。
2.1.2 三角褐指藻KDN13
三角褐指藻KDN13在接种后即迅速生长,细胞密度在第0~4 d由8.30×104个/L快速增至2.62×106个/L,相对生长速率为0.863(对数期);第4~6 d,细胞密度略下降后又明显增加,相对生长速率为0.193(稳定期)(图3a)。可见整个培养期该藻经历了一个相对完整的生长周期,细胞生长充分。
由亚硝态氮质量浓度趋势线(图3b)可知,第0~3 d,由1.000 mg/L升至1.051 mg/L,相对净化速率为-0.025 mg/(L·d),即平均每日产生亚硝态氮0.025 mg/L;第3~6 d,亚硝态氮质量浓度小幅波动,相对净化速率为0.004 mg/(L·d)。
由氨氮质量浓度趋势线(图3c)可知,氨氮质量浓度呈先快速降低后缓慢升高的趋势;第0~3 d,由2.003 mg/L降至0.013 mg/L,相对净化速率为0.663 mg/(L·d);第3~6 d,由0.013 mg/L缓慢升至0.068 mg/L,相对净化速率为0.018 mg/(L·d)。
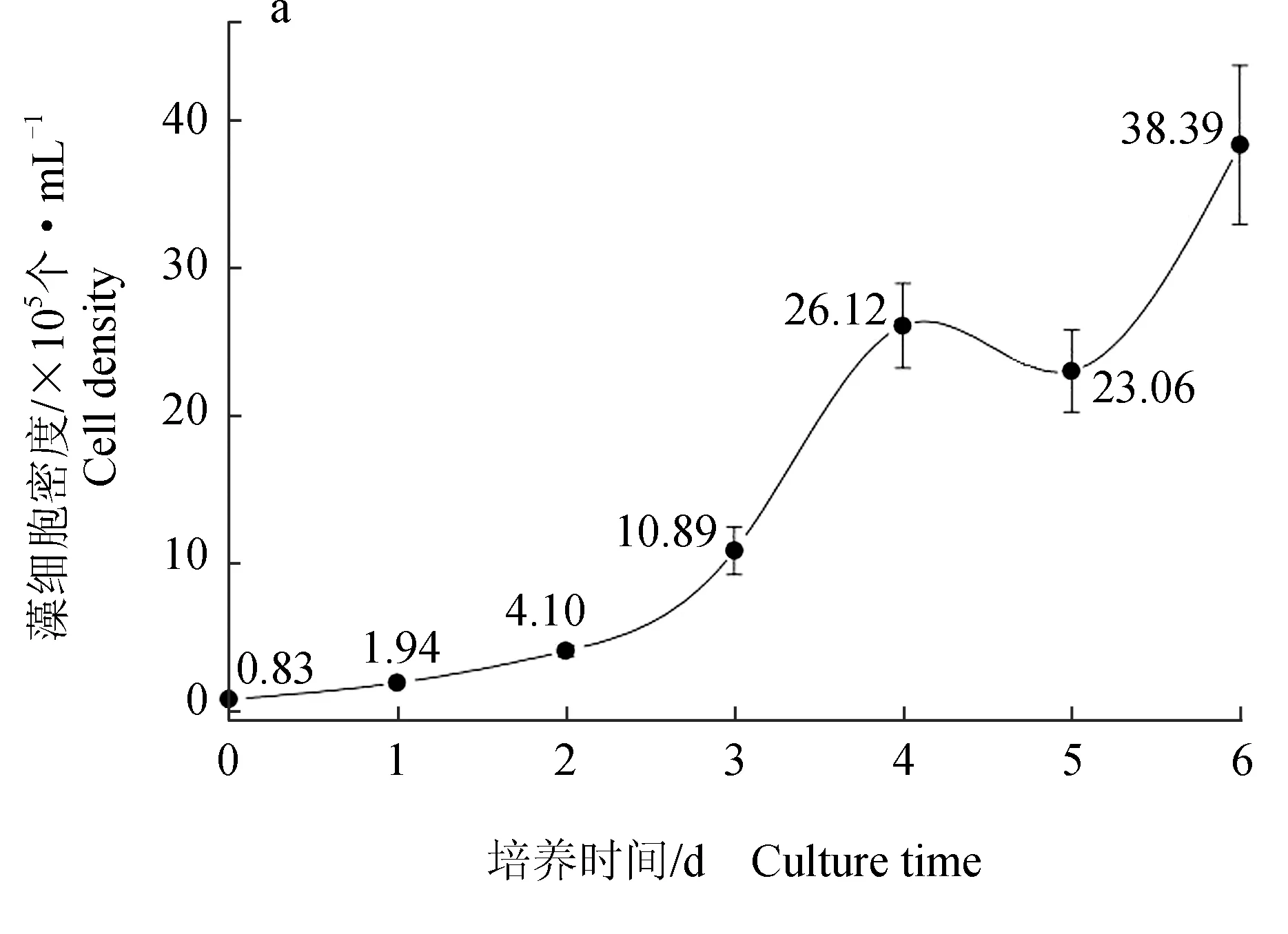
图3 三角褐指藻KDN13培养液中细胞密度(a)、亚硝态氮质量浓度(b)、氨氮质量浓度(c)的变化情况
比较氨氮质量浓度和亚硝态氮质量浓度的趋势线可知,三角褐指藻KDN13在其生长周期的前半段(第0~3 d),氨氮质量浓度快速下降,亚硝态氮质量浓度缓慢上升;在其生长周期的后半段(4~6 d),亚硝态氮浓度小幅波动,氨氮质量浓度则小幅缓慢上升。
2.1.3 双眉藻KDN17
双眉藻KDN17细胞密度在第0~2 d由2.30×104个/L增至7.80×104个/L,相对生长速率为0.28(迟滞期);第2~5 d细胞度密度由7.80×104个/L快速增至4.50×106个/L,相对生长速率为2.028(对数期);培养期最后的生长速率为0.265(稳定期)(图4a)。可见双眉藻在培养期经历了一个相对完整的生长周期,细胞生长充分。
由亚硝态氮和氨氮质量浓度变化情况(图4b~c)可知,第0~2 d,亚硝态氮和氨氮的质量浓度均快速下降,分别由1.002 mg/L和1.999 mg/L降至0.358 mg/L和0.081 mg/L,两者的相对净化速率分别为0.322 mg/(L·d)和0.959 mg/(L·d);第2~6 d,亚硝态氮质量浓度先升至0.388 mg/L后降至0.305 mg/L,而氨氮质量浓度则由0.081 mg/L缓慢降至0.049 mg/L,此阶段两者的相对净化速率分别为0.013 mg/(L·d)和0.008 mg/(L·d)。

图4 双眉藻KDN17培养液中细胞密度(a)、亚硝态氮质量浓度(b)、氨氮质量浓度(c)的变化情况
2.1.4 小新月菱形藻KDN18
小新月菱形藻KDN18细胞密度在第0~4 d由7.60×104个/L迅速增至2.504×106个/L,相对生长速率为0.874(对数期);第4~6 d细胞密度由2.50×106个/L缓慢增加至2.96×106个/L,相对生长速率为0.041(稳定期)(图5a)。
由亚硝态氮质量浓度的趋势线(图5b)可知,接种后第0~1 d,由0.998 mg/L轻微降至0.963 mg/L;第2~6 d由0.963 mg/L缓慢升至1.098 mg/L,相对净化速率为-0.027 mg/(L·d),即每日产生0.027 mg/L的亚硝态氮。
由氨氮质量浓度变化情况(图5c)可知,氨氮质量浓度在第0~3 d由2.001 mg/L快速降至0.086mg/L,相对净化速率为0.958 mg/(L·d);在第2~4 d呈先降后缓慢上升趋势,相对净化速率为-0.009 mg/(L·d),即每日产生氨氮0.009 mg/L。
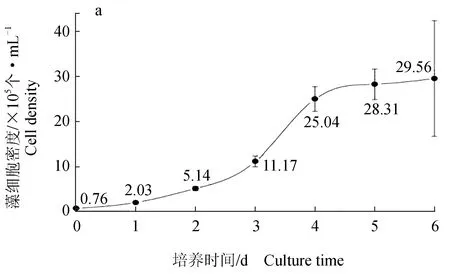
图5 小新月菱形藻KDN18培养液中细胞密度(a)、亚硝态氮质量浓度(b)、氨氮质量浓度(c)的变化情况
在氨氮快速下降的阶段(第0~2 d),亚硝态氮质量浓度先略降后略升;在亚硝态氮质量浓度缓慢上升阶段(第2~6 d),氨氮质量浓度也缓慢上升,但两者上升的幅度均很小。
2.1.5 亚心形扁藻KDN20
亚心形扁藻KDN20细胞密度在第0~1 d略有上升,由1.00×104个/L升至1.60×104个/L,相对生长速率为0.470(迟滞期);第1~5 d细胞密度由1.60×104个/L升至2.50×105个/L,相对生长速率为1.010(对数期);第6 d由2.50×105个/L升至2.56×105个/L,相对生长速率为0.024(稳定期)(图6a)。可见亚心形扁藻KDN20在整个培养阶段经历了一个生长周期,细胞生长充分。
由亚硝态氮质量浓度的趋势线(图6b)可知,亚硝态氮质量浓度在第0~5 d总体呈缓慢下降趋势,但下降幅度很小,此阶段的相对净化速率为0.019 mg/(L·d),第6 d亚硝态氮质量浓度略为升高,相对净化速率为-0.044 mg/(L·d)。
由氨氮质量浓度的趋势线(图6c)可知,氨氮质量浓度在第0~3 d由2.002 mg/L快速降至0.001 mg/L,相对净化速率为0.667 mg/(L·d),之后氨氮质量浓度一直维持在检出最低限以下。
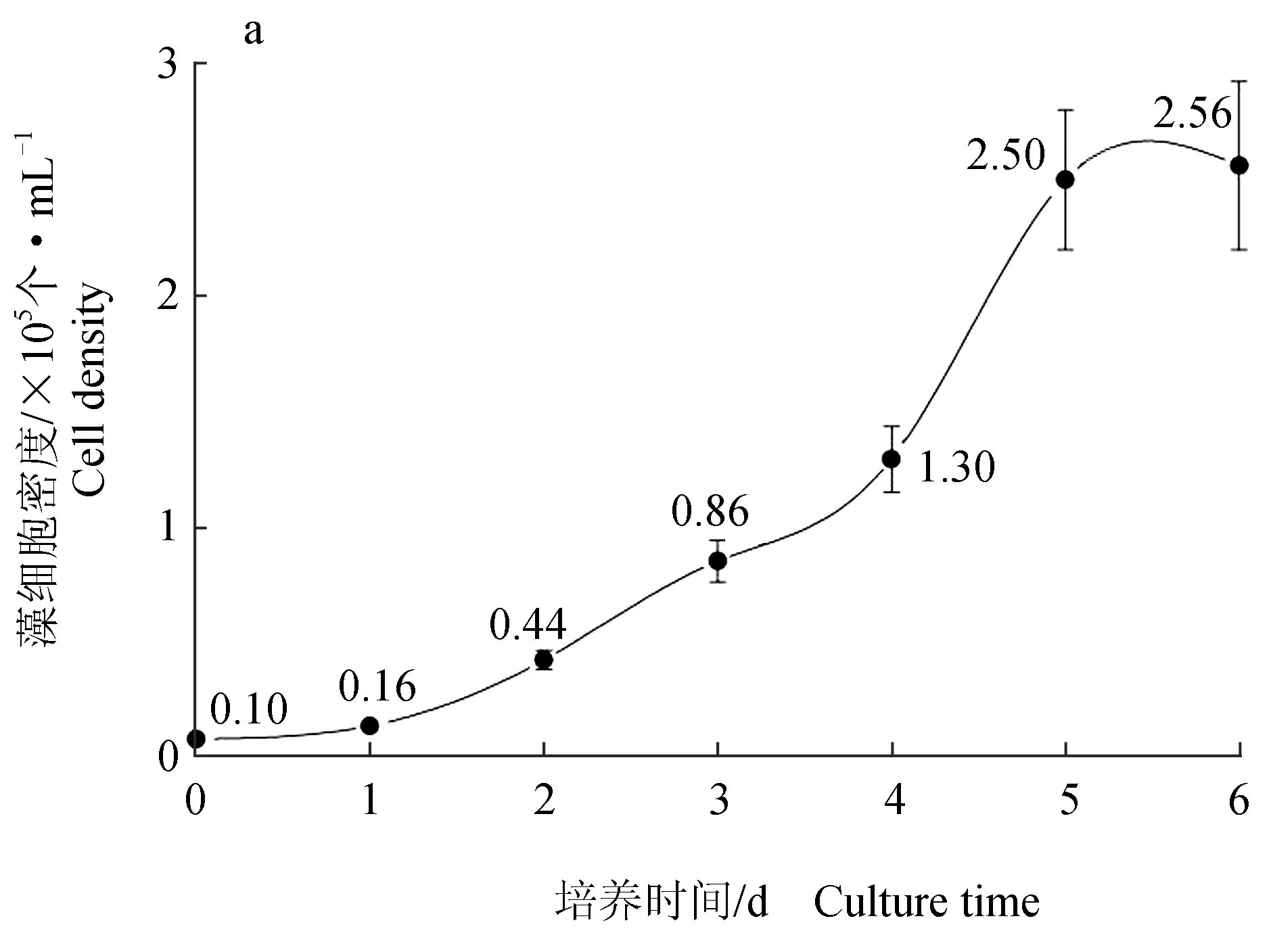
图6 亚心形扁藻KDN20培养液中细胞密度(a)、亚硝态氮质量浓度(b)、氨氮质量浓度(c)的变化情况
整个培养期,无论是氨氮质量浓度快速下降阶段,还是维持稳定阶段,亚硝态氮质量浓度一直小幅度缓慢下降。
2.1.6 塔胞藻KDN21
塔胞藻KDN21细胞密度在第0~1 d略微增加,相对生长速率为0.100(迟滞期);第2~4 d细胞密度由0.30×105个/L快速升至2.80×105个/L,相对生长速率为0.745(对数期),第5~6 d细胞密度明显下降,进入衰亡期(图7a)。可见该藻在6 d的培养期内经历了一个比较完整的生长周期。
由亚硝态氮质量浓度的趋势线(图7b)可知,亚硝态氮质量浓度在0~2 d缓慢下降,相对净化速率为0.01 mg/(L·d);第2~5 d亚硝态氮质量浓度下降较快,相对净化速率为0.065 mg/(L·d);第6 d亚硝态氮质量浓度略有上升,相对净化速率为-0.014 mg/(L·d)。
由氨氮质量浓度的趋势线(图7c)可见,氨氮在第0~2 d快速由1.999 mg/L降至0.001 mg/L,相对净化速率为0.999 mg/(L·d),之后氨氮质量浓度一直低于检出下限。

图7 塔胞藻KDN21培养液中细胞密度(a)、亚硝态氮质量浓度(b)、氨氮质量浓度(c)的变化情况
亚硝态氮和氨氮质量浓度变化存在一定的先后顺序:第0~2 d氨氮几乎被完全净化,而亚硝态氮质量浓度仅下降了0.019 mg/L;第3~6 d氨氮质量浓度均为0.000 mg/L,而亚硝态氮质量浓度总体上呈缓慢下降趋势。
2.2 各微藻对氨氮、亚硝态氮净化情况的比较
所有藻株对氨氮均表现出很好的净化能力(图8),除栅藻KDN7外,所有藻株第3 d时的氨氮相对净化率均达到95%以上且一直保持到试验结束,栅藻KDN7的氨氮相对净化率呈先快速升高后缓慢降低的变化趋势,说明该藻前期能快速净化氨氮,后期却产生了一定量的氨氮;大部分藻株对亚硝态氮的净化能力较弱,相对净化率均未超过35%,有的藻株甚至产生了少量亚硝态氮(相对净化率为负数),只有双眉藻KDN17具有较强的亚硝态氮净化能力,第2 d时即能净化64%的亚硝态氮,最高时对亚硝态氮的净化率接近70%;除双眉藻KDN17外,所有藻种的氨氮相对净化率快速上升阶段(第0~2 d),亚硝态氮相对净化率均很低,说明这些藻在快速净化氨氮时,并不明显净化亚硝态氮;双眉藻KDN17的氨氮相对净化率快速上升时亚硝态氮相对净化率也快速上升(第0~2 d),说明此藻株能同时较快地净化氨氮和亚硝态氮。
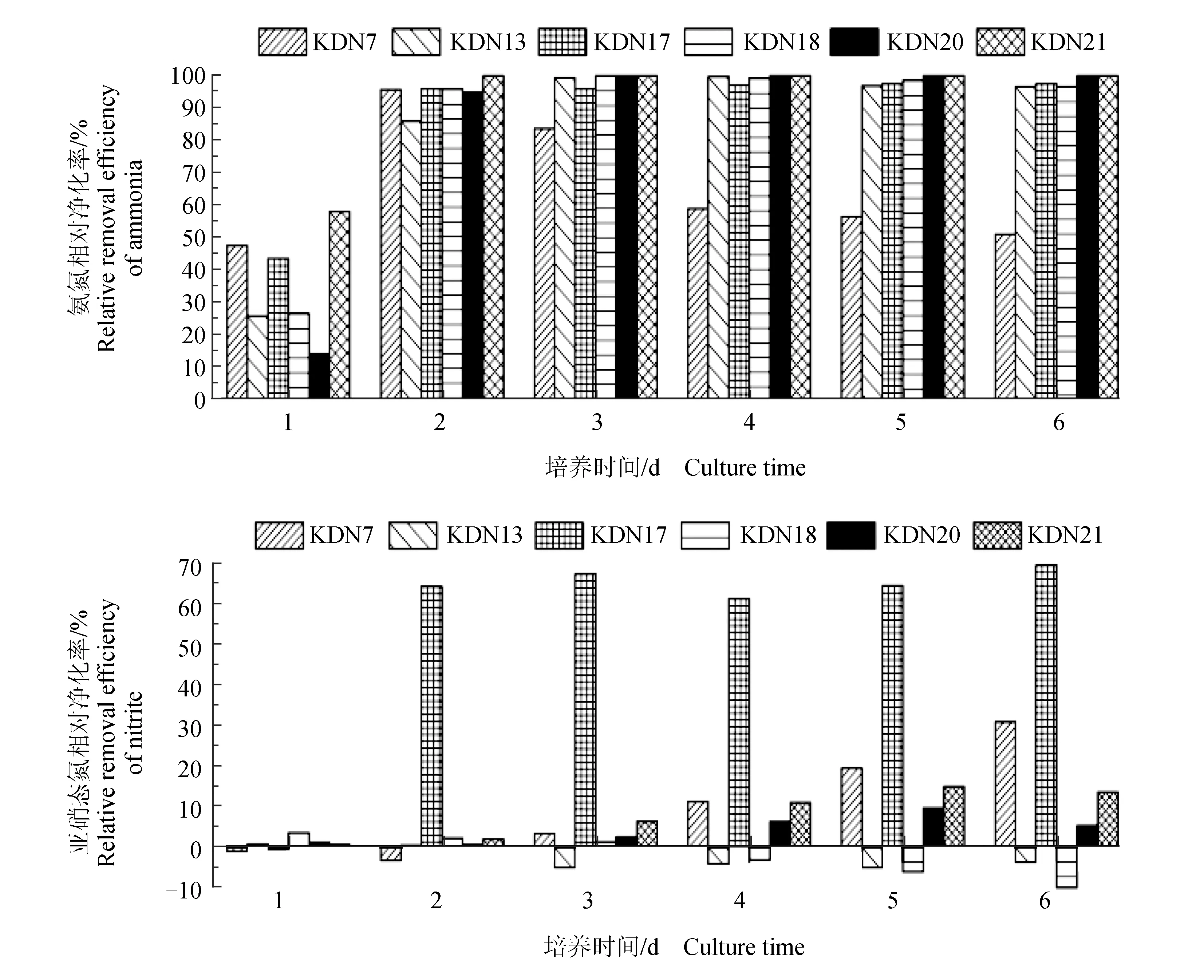
图8 各微藻对氨氮、亚硝态氮的相对净化率
3 讨 论
3.1 混合无机氮源下微藻对氨氮和亚硝态氮的净化规律
所有藻株在整个试验期均生长充分,都经历了一个相对完整的生长周期。在生长周期的初期(培养至第2~3 d),所有藻均能快速净化氨氮(相对净化率均超过95%),尤以栅藻KDN7最快,仅2 d即可将培养基中的氨氮消耗殆尽;大部分藻株对亚硝态氮的净化能力很弱,相对净化速率均未超过0.035 mg/(L·d),只有双眉藻KDN17能以每日净化0.639 mg/L的速率较快地净化亚硝态氮。在生长周期的中后期,绝大多数藻株的氨氮质量浓度保持在极低水平,但栅藻KDN7的氨氮质量浓度出现大幅度上升,日增加1.217 mg/L;各藻株对亚硝态氮的净化能力仍然很弱,大部分微藻在此阶段的相对净化速率均低于0.010 mg/(L·d),相对净化率均未超过35%。上述结果表明,当水体中的氮源仅有3种无机态氮时,在以硝态氮满足藻细胞充分生长的前提下,绝大部分微藻在生长初期均优先净化氨氮;无论处于生长周期的哪个阶段,大部分微藻对亚硝态氮的净化能力都很弱。
3.2 利用微藻控制水产养殖水体亚硝态氮质量浓度的可能性
因施肥、细菌分解残饵和粪便以及水产动物氮代谢,水产养殖水体中无机氮的最初形式主要是氨氮和硝态氮,水体中的氨氮在硝化作用下转变为亚硝态氮和硝态氮,最终导致水体中同时存在氨氮、亚硝态氮和硝态氮[27],这3类无机氮的含量因水体生物群落、投饵量、天气等因素的影响处于不断变化之中[28]。虽然亚硝态氮不稳定,在自然水体中的含量很低,但在高密度水产养殖中,由于硝化细菌活性失调和脱氮作用过程的不平衡均会引起亚硝态氮的过量产生[29-30],给水产动物带来危害。本次试验表明,绝大部分微藻优先净化氨氮,对亚硝态氮的净化能力总是很弱。这一结果提示,当养殖水体的亚硝态氮含量已经超标,若想通过向水体中投入人工培养的藻种降低其含量,须选用那些能同时利用氨氮和亚硝态氮的藻株(如双眉藻KDN17)才可能有效果。
3.3 微藻利用硝态氮过程中积累亚硝态氮或氨氮的可能性
作为一类低等植物,微藻对硝态氮的同化过程类似于植物[31],即在硝酸还原酶和亚硝酸还原酶的先后作用下将NO3-还原为NO2-再还原为NH4+,最后NH4+分别在谷氨酰胺合成酶和谷氨酸合成酶的作用下形成谷氨酰胺和谷氨酸,实现从无机氮到有机氮的同化过程。从这一代谢过程可见,微藻细胞在将硝态氮转化为氨氮的过程中出现亚硝态氮和氨氮的积累是有可能的。
有研究报道[32],某些藻类在利用硝态氮时之所以会出现亚硝态氮积累,是因为硝酸还原酶和亚硝酸还原酶分别在细胞浆和叶绿体内发挥作用,两者的反应过程并非同步进行,而且硝酸还原酶的活性随着培养基中硝态氮含量升高而升高,当硝态氮过多导致产生过多的亚硝态氮,亚硝酸还原酶来不及将亚硝态氮还原为氨时,就会产生亚硝态氮积累。王倩雅等[13]的研究表明,尖状栅藻(S.acuminatus)在初始硝酸钠浓度为18.0、9.0、6.0、3.6 mmol/L的培养液中培养时,前2 d均出现亚硝态氮浓度升高的现象,亚硝态氮浓度最高达到硝态氮浓度的1%。马红芳等[21]在用栅藻LX1处理水产养殖废水(含氨氮5.75 mg/L、亚硝态氮0.63 mg/L、硝态氮20.15 mg/L)时也发现类似情况,接种藻种后培养至第1 d时亚硝态氮质量浓度明显升高,由最初的0.63 mg/L升至1.90 mg/L,之后逐渐下降,培养至约第12 d,水中亚硝态氮含量才开始低于初始值。本研究中,三角褐指藻KDN13和小新月菱形藻KDN18在耗尽氨氮后,藻细胞密度仍呈对数增长,培养液中的亚硝态氮质量浓度不降反升,到试验结束时,两种藻液中亚硝态氮质量浓度比初始值分别增加了3.70%和10.02%,说明两株藻在利用硝态氮维持对数生长的过程中累积了少量亚硝态氮。
另外,本研究中,栅藻KDN7氨氮质量浓度在降至0.086 mg/L之后逐渐上升,至培养结束时升至0.980 mg/L(图2),总上升量为0.894 mg/L,同期亚硝态氮质量浓度由1.033 mg/L降至0.692 mg/L(图2),下降了33.01%。显然在氨氮几乎被耗尽后,栅藻KDN7利用硝态氮和亚硝态氮维持其自身生长的同时,也产生了一定量的氨氮,这提示某些微藻在同化亚硝态氮或硝态氮时可能产生氨氮积累。由于尚未见到类似报道,有必要对此现象做更多研究,以进一步揭示水体无机氮的转换途径。
