基于古法特色炮制前后的地黄饮片及其多糖对衰老模型大鼠的抗氧化作用比较
2020-09-21周艳杜莉杰郑旭亚孙菲菲张振凌
周艳 杜莉杰 郑旭亚 孙菲菲 张振凌
摘 要 目的:比較地黄特色炮制过程中鲜地黄、干地黄、熟地黄及其炮制前后多糖对衰老模型大鼠的抗氧化作用差异,为地黄的加工炮制提供参考。方法:按照古法特色炮制方法制备熟地黄样品,保留加工过程中鲜地黄、干地黄样品,并采用水提醇沉法提取鲜地黄和熟地黄中的粗多糖。将96只大鼠分为空白组(水)、模型组(水)、阳性对照组[维生素C,100 mg/(kg·d)]、鲜地黄组[700 mg/(kg·d)]、干地黄组[135 mg/(kg·d)]、熟地黄组[135 mg/(kg·d)]、鲜地黄多糖组[1 400 mg/(kg·d),以鲜地黄质量计]和熟地黄多糖组[270 mg/(kg·d),以熟地黄质量计],每组12只。除空白组外,其余各组大鼠均于颈背部皮下注射D-半乳糖[125 mg/(kg·d)]复制亚急性衰老模型,并于造模同时灌胃给药,每日给药1次,连续给药56 d。末次给药后,测定大鼠肝、脑、肾、脾、心脏、胸腺指数,并测定其血清和肝、脑、肾组织中总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)活力、过氧化氢酶(CAT)活力、丙二醛(MDA)含量。结果:与空白组比较,模型组大鼠各脏器指数以及血清和脑、肝、肾组织中T-AOC和SOD活力、CAT活力均显著降低(P<0.05或P<0.01),MDA含量均显著升高(P<0.01)。与模型组比较,鲜地黄组大鼠脑、肝、肾指数以及血清和肾组织中SOD活力升高不显著(P>0.05);干地黄组大鼠肾指数以及血清和脑组织中T-AOC,血清和肝、肾组织中SOD活力升高不显著(P>0.05);鲜地黄多糖组大鼠肾指数以及血清和脑组织中T-AOC,血清中SOD活力升高不显著(P>0.05);其余各组大鼠脏器指数,血清和组织中T-AOC、SOD、CAT活力均显著升高(P<0.05或P<0.01);各给药组大鼠血清及脑、肝、肾组织中MDA含量均显著降低(P<0.05或P<0.01)。与鲜地黄组比较,干地黄组大鼠血清中T-AOC显著降低(P<0.01),其余测定指标差异无统计学意义(P>0.05);熟地黄组大鼠肾、脾指数显著升高(P<0.05),肾组织中T-AOC,血清和脑、肾组织中SOD活力,脑、肝组织中CAT活力均显著升高(P<0.05或P<0.01),脑、肝组织中MDA含量显著降低(P<0.01);熟地黄组大鼠脑和肝组织中CAT活力显著高于阳性对照组(P<0.01)。与鲜地黄多糖组比较,熟地黄多糖组大鼠脾、肾指数显著升高(P<0.05或P<0.01),血清和脑、肝、肾组织中T-AOC、SOD活力、CAT活力均显著升高(P<0.05或P<0.01)并且其脑、肝、肾组织中T-AOC和CAT活力均显著高于阳性对照组(P<0.05或P<0.01)。结论:在提高衰老模型大鼠脏器指数以及增强其血清和脑、肝、肾组织中抗氧化酶活力方面,熟地黄优于鲜地黄和干地黄,熟地黄多糖优于鲜地黄多糖。古法特色炮制地黄过程中多糖的改变提高了其抗氧化能力。
关键词 熟地黄;古法特色炮制;地黄多糖;抗氧化能力;大鼠
ABSTRACT OBJECTIVE: To compare the difference in the antioxidant effect of fresh Rehmannia glutinosa, dried R. glutinosa, R. glutinosa preparata during ancient characteristic processing and its polysaccharides before and after processing on aging model rats, and to provide reference for the processing of R. glutinosa. METHODS: The sample of R. glutinosa preparata was prepared according to ancient characteristic method. During the processing, the fresh and dried R. glutinosa samples were retained. Then crude polysaccharide were extracted from fresh R. glutinosa and Rehmanniae radix preparata by water extraction and alcohol precipitation. Totally 96 rats were divided into blank group (water), model group (water), positive control group [vitamine C,100 mg/(kg·d)],fresh R. glutinosa group [700 mg/(kg·d)],dried R. glutinosa group [135 mg/(kg·d)] ,Rehmanniae radix preparata group [135 mg/(kg·d)],fresh R. glutinosa polysaccharide group [1 400 mg/(kg·d), by the weight of fresh R. glutinosa] and Rehmanniae radix preparata polysaccharide group [270 mg/(kg·d), by the weight of Rehmanniae radix preparata], with 12 rats in each group. Except for blank group, other groups were given D-galactose [125 mg/(kg·d)] on neck and back to induce sub-acute aging model. At the same time, they were given relevant medicine intragastrically, once a day, for consecutive 56 days. After last administration, the liver, brain, kidney, spleen, heart and thymus indexes were determined. The total antioxidant capacity (T-AOC), superoxide dismutase (SOD) activity, catalase (CAT) activity and MDA content in serum, liver, brain and kidney were determined. RESULTS: Compared with blank group, organ indexes of rats in the model group were decreased significantly (P<0.05 or P<0.01); T-AOC, SOD activity and CAT activity in serum, brain, liver and kidney tissue were decreased significantly (P<0.01), while MDA content increased significantly (P<0.01). Compared with model group, the organ indexes of brain, liver and kidney, SOD activity in serum and kidney of fresh R. glutinosa group were not significantly increased (P>0.05); kidney index, T-AOC in serum and brain, SOD activity in serum, liver and kidney tissue were not significantly increased in the dried R. glutinosa group (P>0.05); kidney index, T-AOC in serum and cerebral tissue, SOD activity in serum were not significantly increased in fresh R. glutinosa group (P>0.05); other organ indexes, T-AOC, SOD activity and CAT activity in serum and tissues were increased significantly in other groups (P<0.05 or P<0.01), while MDA content in serum and tissues were decreased significantly in all administration groups (P<0.05 or P<0.01). Compared with fresh R. glutinosa group, T-AOC in serum was decreased significantly in dried R. glutinosa group (P<0.01), and there was no significant difference in other indexes (P>0.05); kidney and spleen indexes of rats in Rehmanniae radix preparata group were increased significantly (P<0.05), T-AOC in renal tissue, SOD activity in serum, cerebral tissue and renal tissue, CAT activity in cerebral and liver tissue were increased significantly (P<0.05 or P<0.01), while MDA in cerebral and liver tissue were significantly decreased (P<0.01). CAT in cerebral tissue and liver tissue of rats in Rehmanniae radix preparata group were significantly higher than those in positive control group (P<0.01). Compared with fresh R. glutinosa polysaccharide group, spleen and renal indexes of rats in Rehmanniae radix preparata group were increased significantly (P<0.05 or P<0.01), T-AOC, SOD activity and CAT activity in serum and cerebral, liver, renal tissues were increased significantly (P<0.05 or P<0.01). T-AOC and CAT activity of cerebral, liver and renal tissues in Rehmanniae radix preparata group were all significantly higher than those in positive control group (P<0.05 or P<0.01). CONCLUSIONS: In the aspect of increasing organ index and improving the activity of antioxidant enzymes in serum, cerebral, liver and renal tissues of aging model rats, Rehmanniae radix preparata is superior to fresh R. glutinosa and dried R. glutinosa; R. glutinosa preparata polysaccharide is superior to fresh R. glutinosa polysaccharide. During ancient characteristic processing of R. glutinosa, the change of polysaccharide can improve its anti-oxidation activity.
KEYWORDS Rehmanniae radix preparata; Ancient characteristic processing; Rehmannia glutinosa polysaccharides; Antioxidant ability; Rats
地黄为玄参科植物地黄(Rehmannia glutinosa Libosch.)的新鲜或干燥块根,常用饮片有鲜地黄、生地黄和熟地黄。其中,鲜地黄味甘、苦,性寒,归心、肝、腎经,具有清热生津、凉血、止血功效;生地黄味甘,性寒,归心、肝、肾经,具有清热凉血、养阴生津功效;熟地黄味甘,性微温,归肝、肾经,具有补血滋阴、益精填髓功效,用于肝肾阴虚、须发早白等[1]。由此可知,鲜地黄炮制成熟地黄后其补血益精填髓的功能有所增加。目前,2015年版《中国药典》(一部)以及各省市中药饮片炮制规范收载的熟地黄均是以干地黄为原料,采用清蒸、酒蒸以及酒炖等方法炮制而得。而干地黄目前是按照农副产品进行管理,其加工方法的不统一和贮藏条件的不同易造成其质量参差不齐,从而导致用干地黄加工的熟地黄不能达到传统质量标准的要求。
笔者前期查阅古代文献,发现地黄炮制品名称有“鲜生部分、生干部分、干熟不分”的现象,唐代以前地黄蒸制均是由鲜地黄为原料经反复蒸晒炮制而成[2-3],唐代以后至清代也多次出现以鲜地黄为原料蒸晒熟地黄的记载[4-5],这说明古代熟地黄炮制方法是以鲜地黄为原料多次蒸晒。本实验室前期通过挖掘传统炮制技术,建立了由鲜地黄直接加工成熟地黄的特色炮制一体化工艺[6],并对此工艺炮制的熟地黄的主要有效成分变化和补血药效进行了研究,发现通过该工艺制备的熟地黄不仅达到“色如漆,甘如饴,亮如油”的传统标准,而且其补血、抗衰老作用明显[7]。另有研究表明,熟地黄可以提高大鼠的抗氧化能力[8],在加工炮制过程中其抗衰老作用有所增强[9]。在炮制过程中,地黄中多种成分含量均有所降低[10],但多糖含量却升高[11]且伴随着结构[12-13]改变,而地黄多糖具有提高机体免疫力[14]、抗肿瘤[15]、抗疲劳[16]、抗氧化[17]等方面的作用,因此笔者推测熟地黄抗氧化作用可能与其多糖含量的升高有关。另有研究认为,提高机体的抗氧化酶活性可以延缓衰老[18]。鉴于此,本研究在前期研究基础上,对以鲜地黄为原料的特色炮制熟地黄饮片及其多糖在大鼠体内的抗氧化作用进行考察,并考察地黄炮制过程中多糖变化对其抗氧化作用的影响,为地黄炮制研究提供实验依据。
1 材料
1.1 仪器
PT-3502G型酶标仪(北京普天新桥技术有限公司);KQ-500DV型数控超声波清洗器(昆山市超声仪器有限公司);JX-FSTPRP-48型自动样品快速研磨仪(上海净信实业发展有限公司);ZD-F/2型冷冻干燥机(南京载智自动化设备有限公司);TG16-WS型高速台式离心机(湖南湘仪实验室仪器开发有限公司);BSA224S-CW型电子天平[赛多利斯科学仪器(北京)有限公司]。
1.2 药品与试剂
鲜地黄药材于2018年12月购于河南省焦作市武陟县,经河南中医药大学药学院董诚明教授鉴定为玄参科植物地黄(R. glutinosa Libosch.)的块根。D-半乳糖(上海源叶生物科技有限公司,批号:S11050);维生素C片(华中药业股份有限公司,批号:20190308,规格:100 mg/片);总抗氧化能力(T-AOC)试剂盒(血清试剂盒批号:CK-E31087,脏器试剂盒批号:ml022376)、超氧化物歧化酶(SOD)试剂盒(血清试剂盒批号:CK-E34817,脏器试剂盒批号:ml059817)、过氧化氢酶(CAT)试剂盒(血清试剂盒批号:CK-E35798,脏器试剂盒批号:ml037079);丙二醛(MDA)试剂盒(血清试剂盒批号:CK-E30239,脏器试剂盒批号:ml022446)均由上海酶联生物科技有限公司提供;0.9%氯化钠注射液(河南科伦药业有限公司,批号:C119060201-1,规格:250 mL ∶ 2.25 g);无水乙醇(天津市富宇精细化工有限公司,批号:20190115,分析纯);其余试剂均为分析纯,试验用水为蒸馏水。
1.3 动物
健康Wistar大鼠96只,SPF级,雌雄各半,8周龄,雌性大鼠体质量为(220±10) g、雄性大鼠为(320±10) g,购自河南朋悦实验动物繁育有限公司,生产合格证号:SCXK(鲁)2019-0003,使用合格证号:SYXK(豫)2015- 0005。大鼠在温度(25±2) ℃、相对湿度(50±10)%的环境下适应性饲养1周后进行实验,实验操作严格按照《实验动物管理条例》和有关动物研究指导原则的要求及规则进行。
2 方法
2.1 药液的制备
2.1.1 鲜地黄样品溶液的制备 取鲜地黄210 g,加210 mL水打汁,8层纱布过滤,收集汁液;药渣用水洗2次、每次200 mL,收集洗脱液,与汁液合并。将合并液浓缩至600 mL,用离心管按每管30 mL分管后,置于-80 ℃冰箱中保存。临用前分批取出,室温融化,每30 mL浓缩液用水稀释至150 mL,制备成70 mg/mL的溶液(以鲜地黄原药材量计算)。
2.1.2 干地黄样品溶液的制备 取特色炮制过程中鲜地黄经第1次蒸晒、炮制程度相当于干地黄的样品(简称为“干地黄”)135 g(每5.2 kg鲜地黄可得到1 kg干地黄),加8倍量水(mL/g,下同)浸泡30 min,再煎煮30 min,过滤;药渣再加倍8倍量水煎煮20 min,过滤,并合并滤液。将合并液浓缩至500 mL,用离心管按每管30 mL分管后,置于-80 ℃冰箱中保存。临用前分批取出,室温融化,每30 mL浓缩液用水稀释至600 mL,制备成13.5 mg/mL的溶液(以干地黄原药材量计,相当于含鲜地黄药材70 mg/mL)。
2.1.3 熟地黄样品溶液的制备 按照前期研究优选的熟地黄特色炮制方法[6]制备熟地黄样品(简称“熟地黄”)。取蒸晒5次达到炮制终点的熟地黄,按“2.1.2”项下方法制备成含熟地黄原药材13.5 mg/mL的溶液(相当于含鲜地黄药材70 mg/mL)。
2.1.4 鲜地黄多糖样品溶液的制备 取鲜地黄300 g,剪成粒度为2~4 mm的碎末,加30倍量水,在50 ℃下超声(功率:500 W,频率:40 kHz)60 min,过滤,浓缩至400 mL,加无水乙醇调溶液的醇体积分数为80%,静置24 h,过滤,收集濾液;沉淀用无水乙醇洗涤后,用水溶解,采用Sevag法[19]除蛋白,得鲜地黄多糖溶液(多糖得率为7.5%,总多糖含量为3%)。将溶液浓缩至300 mL,用离心管按每管28 mL分管后,置于-80 ℃冰箱中保存。临用时分批取出,室温融化,每管加水稀释至200 mL,制备成140 mg/mL的溶液(以鲜地黄原药材量计)。
2.1.5 熟地黄多糖样品溶液的制备 取特色炮制终点的熟地黄300 g,按照“2.1.4”项下方法制备熟地黄多糖样品溶液(多糖得率为23.5%,总多糖含量为14%)。将溶液浓缩至600 mL,用离心管按每管27 mL分管后,置于-80 ℃冰箱中保存。临用时每管加水稀释至500 mL,制备成27 mg/mL的溶液(以熟地黄原药材量计)。
2.1.6 阳性对照溶液的制备 取维生素C片,研磨成细粉,加水配制成10 mg/mL的溶液,临用时现配。
2.2 动物分组与给药
取大鼠96只随机分为8组,即空白组、模型组、阳性对照组、鲜地黄组、干地黄组、熟地黄组、鲜地黄多糖组和熟地黄多糖组,每组12只(雌雄各半)。除空白组注射等量生理盐水外,其余各组大鼠均于颈背部皮下注射D-半乳糖[125 mg/(kg·d)]复制亚急性衰老模型[20]。于造模同时,空白组和模型组大鼠灌胃水,阳性对照组大鼠灌胃维生素C水溶液[100 mg/(kg·d),依据临床用量,按人和大鼠间体表面积折算而得,并通过前期预实验确定剂量],鲜地黄组大鼠灌胃鲜地黄样品溶液[700 mg/(kg·d),根据临床上鲜地黄最大用量30 g计算,并按人和大鼠间体表面积折算后确定剂量],干地黄组大鼠灌胃干地黄样品溶液[135 mg/(kg·d)],熟地黄组大鼠灌胃熟地黄样品溶液[135 mg/(kg·d)],鲜地黄多糖组大鼠灌胃鲜地黄多糖样品溶液[1 400 mg/(kg·d),以鲜地黄药材计],熟地黄多糖组大鼠灌胃熟地黄多糖样品溶液[270 mg/(kg·d),以熟地黄药材计](干地黄组、熟地黄组、鲜地黄多糖组和熟地黄多糖组的给药剂量均是根据鲜地黄组的用量,按照各样品相对鲜地黄的得率折算后得到)。每天给药1次,连续给药56 d。给药期间,每周测定1次大鼠体质量,随体质量变化调整其造模及灌胃给药量。因鲜地黄组和鲜地黄多糖组各有1只雄性大鼠死亡,故每组最终选择10只大鼠进行结果分析(雌雄各半)。
2.3 样品采集及处理
末次给药后,所有大鼠禁食不禁水12 h,称体质量后摘眼球取血,将血样在4 ℃条件下以3 000 r/min离心10 min制备血清,分装后置于-80 ℃冰箱中保存,待测。取血后断颈处死大鼠,置于冰袋上迅速解剖,取出肝、脑、肾、脾、心脏、胸腺等脏器,用棉签吸去浮血,用冰冷生理盐水清洗后再以滤纸吸干,并称定各脏器质量。然后将肝、脑、肾组织置于液氮中速冻后,置于-80 ℃冰箱中保存。
2.4 指标检测
2.4.1 脏器指数的测定 根据大鼠脏器质量和体质量计算各脏器(肝、脑、肾、脾、心脏、胸腺)指数:脏器指数(mg/g)=脏器(肝、脑、肾、脾、心脏、胸腺)质量(mg)/体质量(g)。
2.4.2 抗氧化指标的测定 分别取冷冻的血清和肝、脑、肾组织样品适量,在冰上解冻,精密称取组织样品0.05 g,加适量冰生理盐水匀浆,再加入生理盐水制备成10%的组织匀浆液,在4 ℃条件下以4 000 r/min离心10 min,取上清液。分别按照相应试剂盒说明书操作,检测血清和肝、脑、肾组织中T-AOC、SOD活力、CAT活力和MDA含量。
2.5 统计学方法
采用SPSS Statistics 25软件进行统计分析。试验数据用x±s表示,多组间比较采用单因素方差分析,组间两两比较采用t检验。P<0.05表示差异具有统计学意义。
3 结果
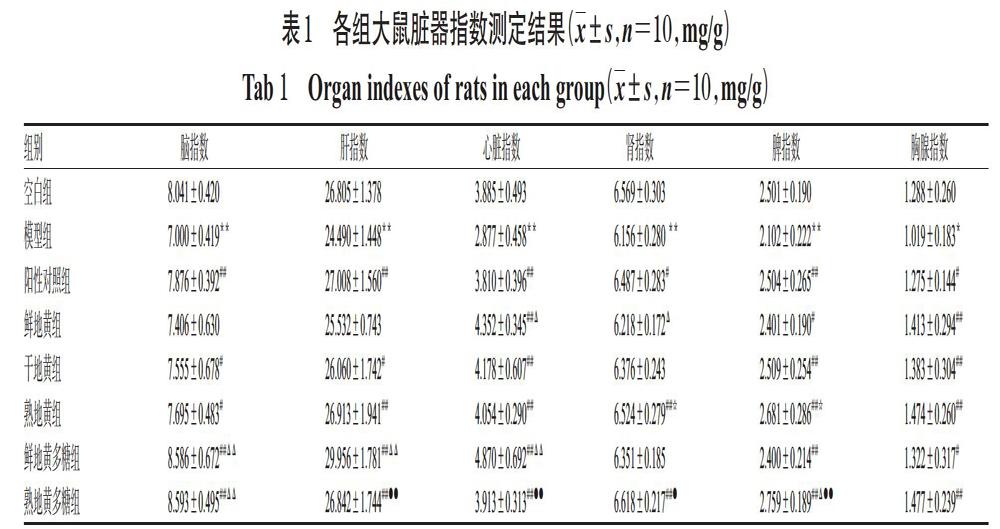
3.1 脏器指数测定结果
与空白组比较,模型组大鼠脑、肝、心脏、肾、脾、胸腺指数均显著降低(P<0.05或P<0.01)。与模型组比较,除鲜地黄组大鼠脑、肝、肾指数和干地黄组、鲜地黄多糖组大鼠肾器指数升高不显著外(P>0.05),各组大鼠其余脏器指数均显著升高(P<0.05或P<0.01)。鲜地黄组与干地黄组比较以及干地黄组与熟地黄组比较,大鼠各脏器指数差异均无统计学意义(P>0.05);熟地黄组大鼠肾、脾指数较鲜地黄组显著升高(P<0.05),并且熟地黄组大鼠各脏器指数与阳性对照组比差异均无统计学意义(P>0.05)。与鲜地黄多糖组比较,熟地黄多糖组大鼠肝、心脏指数显著降低(P<0.01),但肾、脾指数显著升高(P<0.05或P<0.01),并且其脾指数显著高于阳性对照组(P<0.05)。各组大鼠脏器指数测定结果见表1。
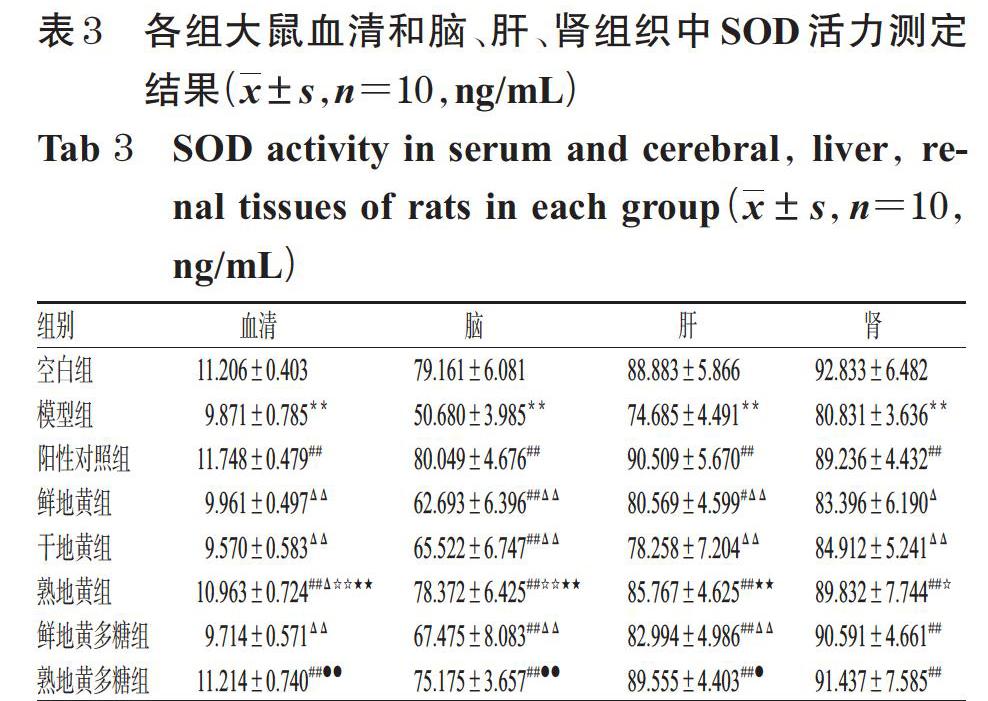
3.2 大鼠血清和脑、肝、肾组织中T-AOC测定结果
与空白组比较,模型组大鼠血清和脑、肝、肾组织中T-AOC均显著降低(P<0.01)。与模型组比较,仅干地黄组和鲜地黄多糖组大鼠血清和脑组织中T-AOC升高不显著(P>0.05),其余各组大鼠血清和脑、肝、肾组织中T-AOC均显著升高(P<0.05或P<0.01)。与鲜地黄组比较,干地黄组大鼠血清中T-AOC显著降低(P<0.01),熟地黄组大鼠肾组织中T-AOC显著升高(P<0.05);熟地黄组大鼠肾组织中T-AOC显著高于干地黄组(P<0.01),且与阳性对照组比较差异无统计学意义(P>0.05)。与鲜地黄多糖组比较,熟地黄多糖组大鼠血清和脑、肝、肾组织中T-AOC均显著升高(P<0.05或P<0.01),且其脑、肝、肾组织中T-AOC显著高于阳性对照组(P<0.05或P<0.01)。各组大鼠血清和脑、肝、肾组织中T-AOC测定结果见表2。
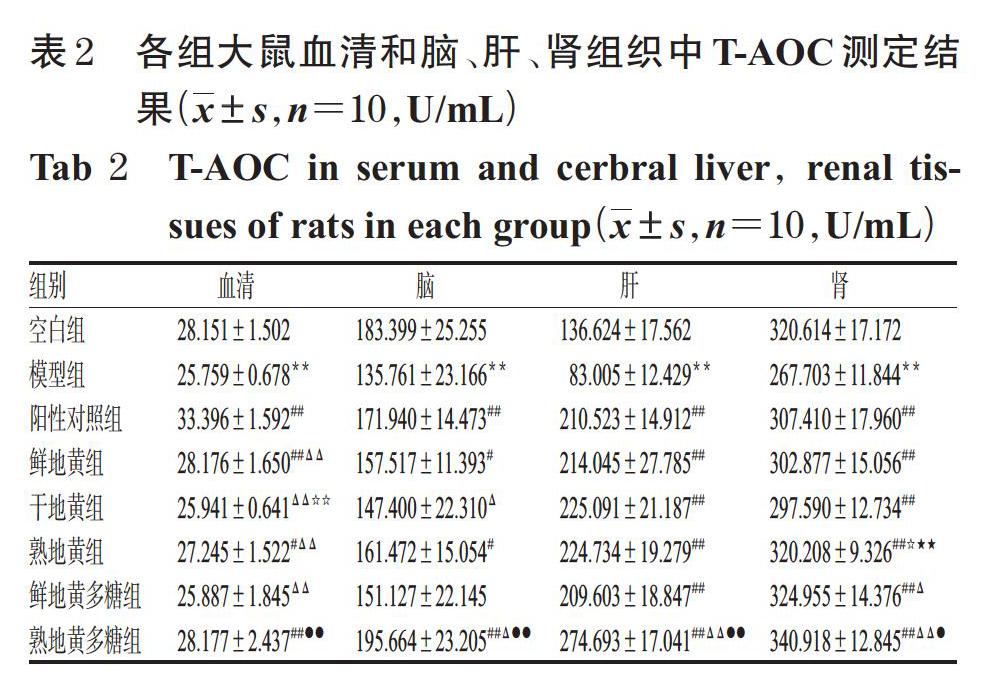
3.3 大鼠血清和脑、肝、肾组织中SOD活力测定结果
与空白组比较,模型组大鼠血清和脑、肝、肾组织中SOD活力均显著降低(P<0.01)。与模型组比较,鲜地黄组大鼠血清和肾组织中SOD活力以及干地黄组血清和肝、肾组织中SOD活力升高不显著(P>0.05)外,其余各组大鼠血清和脑、肝、肾组织中SOD活力均显著升高(P<0.05或P<0.01)。与鲜地黄组比较,干地黄组大鼠血清和各组织中SOD活力差异均无统计学意义(P>0.05);熟地黄组大鼠血清和脑、肾组织中SOD活力顯著升高(P<0.05或P<0.01),且其血清和脑、肝组织中SOD活力显著高于干地黄组(P<0.01),血清中SOD活力显著高于阳性对照组(P<0.05)。与鲜地黄多糖组比较,熟地黄多糖组大鼠血清和脑、肝组织中SOD活力显著升高(P<0.05或P<0.01),且其血清和脑、肝、肾组织中SOD活力与阳性对照组比差异均无统计学意义(P>0.05)。各组大鼠血清和脑、肝、肾组织中SOD活力测定结果见表3。
3.4 大鼠血清和脑、肝、肾组织中CAT活力测定结果
与空白组比较,模型组大鼠血清和脑、肝、肾组织中CAT活力均显著降低(P<0.01)。与模型组比较,各组大鼠血清和脑、肝、肾组织中CAT活力均显著升高(P<0.05或P<0.01)。与鲜地黄组比较,干地黄组大鼠血清和脑、肝、肾组织中CAT活力差异均无统计学意义(P>0.05);熟地黄组大鼠脑、肝组织中CAT活力显著升高(P<0.01),且其脑、肝组织中CAT活力显著高于干地黄组和阳性对照组(P<0.01)。与鲜地黄多糖组比较,熟地黄多糖组大鼠血清和脑、肝、肾组织中CAT活力均显著升高(P<0.05或P<0.01),且其脑、肝、肾组织中CAT活力显著高于阳性对照组(P<0.01)。各组大鼠血清及脑、肝、肾组织中CAT活力测定结果见表4。
3.5 大鼠血清和脑、肝、肾组织中MDA含量测定结果
与空白组比较,模型组大鼠血清和脑、肝、肾组织中MDA含量均显著升高(P<0.01)。与模型组比较,各组大鼠血清和脑、肝、肾组织中MDA含量均显著降低(P<0.05或P<0.01)。与鲜地黄组比较,干地黄组大鼠血清和脑、肝、肾组织中MDA含量差异均无统计学意义(P>0.05);熟地黄组大鼠脑、肝、肾组织中MDA含量显著降低(P<0.05或P<0.01),且其肝、肾组织中MDA含量显著低于干地黄组(P<0.05或P<0.01),其脑组织中MDA含量显著低于阳性对照组(P<0.01)。与鲜地黄多糖组比较,熟地黄多糖组大鼠肝组织中MDA含量显著升高(P<0.01),且显著高于阳性对照组(P<0.01)。各组大鼠血清和脑、肝、肾组织中MDA含量测定结果见表5。
4 讨论
组织器官的质量变化,特别是脑、胸腺、脾、肝、肾等重要器官的质量变化,是反映动物机体衰老程度的重要指标[21]。肝和肾是机体重要的代谢器官,肝、肾指数降低在一定程度上反映了动物代谢能力的降低;脾在机体免疫中发挥着重要作用,体液免疫和细胞免疫均和脾有关,脾萎缩会降低动物的免疫功能[22]。心脏指数与免疫复合体及细胞免疫功能相关,而细胞免疫功能对动脉粥样硬化等心血管疾病的发病率有一定的影响[23]。本研究中熟地黄在升高模型大鼠肾、脾指数方面优于鲜地黄,熟地黄多糖在升高模型大鼠肾、脾指数方面优于鲜地黄多糖,这提示将鲜地黄采用特色炮制方法直接蒸晒成的熟地黄在延缓大鼠脏器退化、提高机体免疫力、促进新陈代谢方面优于鲜地黄,并且与炮制前后多糖的变化有一定关系。此外,鲜地黄和鲜地黄多糖均可显著提高模型大鼠心脏指数,并且鲜地黄的作用优于熟地黄多糖,这提示鲜地黄对心脏相关的免疫疾病的影响优于熟地黄,并和鲜地黄多糖相关。
生物体在代谢过程中会产生自由基,过多的自由基会使机体处于氧化应激状态,导致机体产生有害物质而损伤生物体组织和器官;且随着年龄的增长,抗氧化酶活性降低,清除自由基能力下降,自由基堆积造成MDA含量升高,最终导致人体衰老[18]。因此,提高机体的抗氧化酶活性可以延缓衰老。在本研究中,与鲜地黄组比较,干地黄组大鼠仅血清中T-AOC显著降低,其余测定指标变化不显著;与鲜地黄组比较,熟地黄组大鼠肾组织中T-AOC以及血清和脑、肾组织中SOD活力和脑、肝组织中CAT活力均显著升高,并且熟地黄组大鼠脑、肝组织中CAT活力显著优于阳性对照组。这提示熟地黄在提高血清和脏器抗氧化酶活性方面优于鲜地黄,以鲜地黄为原料多次蒸晒特色炮制熟地黄过程可以提高其抗氧化、抗衰老药效。而熟地黄多糖组与鲜地黄多糖组比较,大鼠血清和脑、肝、肾组织中T-AOC、SOD活力、CAT活力均不同程度升高,且其脑、肝、肾组织中T-AOC、CAT活力均显著高于阳性对照组,提示熟地黄多糖相比鲜地黄多糖具有更强的抗氧化能力,这为熟地黄临床抗衰老功效提供了实验依据。
综上所述,特色炮制熟地黄的抗氧化能力优于鲜地黄和蒸晒1次的干地黄,熟地黄多糖抗氧化能力优于鲜地黄多糖,且上述比较结果在多个指标上具有一致性,表明在古法特色炮制地黄过程中,其多糖发生了改变,并且这种改变与地黄炮制后抗氧化、抗衰老作用有一定的关联。后续有必要进一步对地黄炮制前后多糖结构的单糖比和糖苷键的构型变化进行研究,以深入探索地黄炮制后药性改变、抗衰作用增强的机制,并指导中医恰当应用地黄炮制品,从而保证和提高其临床疗效。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:124-125.
[ 2 ] 孙思邈.备急千金要方[M].北京:人民卫生出版社,1955:485.
[ 3 ] 孙思邈.千金翼方[M].北京:人民卫生出版社,1955:61.
[ 4 ] 吴仪络.本草从新[M].上海:上海科学技术出版社,1982:63-64.
[ 5 ] 凌奂.本草害利[M].北京:中医古籍出版社,1982:97.
[ 6 ] 于文娜,张振凌,张颖,等.地黄炮制过程中异毛蕊花糖苷含量的动态变化[J].中国实验方剂学杂志,2017,23(18):22-26.
[ 7 ] 赵丹,张振凌,王胜超,等.不同方法炮制的熟地黄的补血作用比较[J].中国实验方剂学杂志,2017,23(19):46-49.
[ 8 ] WAGNER WM,OUYANG Q,SEKERI-PATARYAS K, et al. Basic biology and clinical impact of immunosenescence[J]. Exp Gerontol,2002,37(2):183-189.
[ 9 ] 常富业,李云,孙莹,等.熟地黄抗衰、养生与美容作用探要[J].中华中医药学刊,2012,30(2):283-285.
[10] 刘彦飞,赵宇,武卫红,等.地黄的化学成分及其在加工炮制过程中的变化[J].国外医药:植物药分册,2007,22(3):102-108.
[11] 张留记,王建霞,屠万倩,等.生地黄与熟地黄中5个苷类成分和总多糖的含量比较[J].天然产物研究与开发,2019,31(4):566-571.
[12] TOMODA M,MIYAMOTO H,SHIMZU N,et al. Characterization of two polysaccharides having activity on the reticuloendothelial system from the root of Rehmannia glutinosa[J]. Chem Pharm Bull,1994,42(3):625-629.
[13] 杨云,苗明三,王浴铭.怀地黄多糖化学研究[J].时珍国医国药,1999,10(8):9-10.
[14] HUANG Y,JIANG C,HU Y,et al. Immunoenhancement effect of rehmannia glutinosa polysaccharide on lymphocyte proliferation and dendritic cell[J]. Carbohydrate Polymers,2013,96(2):516-521.
[15] XU L,KWAK M,ZHANG W,et al. Rehmannia glutinosa polysaccharide induces toll-like receptor dependent spleen dendritic cell maturation and anti-cancer immunity[J]. Oncoimmunology,2017. DOI:10.1080/2162402X.2017. 1325981.
[16] TAN W,YU K Q,LIU YY,et al. Anti-fatigue activity of polysaccharides extract from Radix Rehmanniae Preparata[J]. Int J Biol Macromol,2012,50(1):59-62.
[17] 付昊,龍虎,蔡自建,等.熟地黄多糖的体内抗氧化活性研究[J].食品研究与开发,2019,40(4):57-61.
[18] HARMAN D. About “origin and evolution of the free radical theory of aging:a brief personal history,1954- 2009”[J]. Biogerontology,2009,10(6):773-781.
[19] SEVAG MG,LACKMAN DB,SMOLENS J. The isolation of the components of streptococcal nucleoproteins in serologically active form[J]. J Biol Chem,1938,124(1):425-436.
[20] 徐叔云,卞如濂.药理实验方法学[M].北京:人民卫生出版社,2006:1464-1466.
[21] 刘涛,王灿晖,杨进,等.改良三甲散抗脑衰老作用的实验研究[J].中国老年学杂志,2001,21(4):308-309.
[22] 沙爱龙,吴瑛,盛海燕,等.昆仑雪菊黄酮对衰老模型小鼠脑及脏器指数的影响[J].动物医学进展,2013,34(7):66-68.
[23] 王茨,迟伟群,姜晓峰.自身抗体及炎症因子与动脉粥样硬化相关性的研究进展[J].中国实验诊断学,2020,24(6):1052-1056.
(收稿日期:2020-04-24 修回日期:2020-07-21)
(编辑:林 静)
