晋北散养边鸡群ALV-p27携带率及ALV-A/B与ALV-J亚群的ELISA检测
2020-09-14刘一飞王志宇魏清宇叶红心李培峰
马 馨,刘一飞,王志宇,魏清宇,叶红心,李培峰
(1.山西农业大学(山西省农业科学院)动物科学学院,山西太原030032;2.山西农业大学(山西省农业科学院)动物医学学院,山西太原030032)
禽白血病(Avian leukosis,AL)是由禽白血病病毒(Avian leukosis Virus,ALV)和肉瘤病毒群病毒(Avian Sarcoma Virus,ASV)引起的禽类多种肿瘤性疾病的统称,在自然条件下以淋巴白血病最为常见,其他诸如红细胞白血病、成髓细胞白血病、髓细胞瘤、纤维瘤等发生频率较低。ALV可经垂直和水平传播方式在禽类中传播,可引起鸡只罹患良性或恶性肿瘤,导致鸡群产蛋率、肉品质、种蛋受精率和孵化率等生产、繁殖性能下降,同时造成严重的生长和免疫抑制,进而继发感染其他细菌性与病毒性疾病[1-2]。依据ALV囊膜糖蛋白的抗原性差异、不同或相同亚群病毒的干扰实验、在不同遗传型鸡胚成纤维细胞的宿主范围和基因组结构性差异等特性,将其分类为11个亚群,即A~K亚群。其中,A、B、C、D、J和K亚群均属于外源性白血病病毒,而E、F、G、H和I亚群则属于内源性白血病病毒[3]。目前,我国禽类的ALV感染主要以J亚群为主,同时也有ALV-A/B的局部流行[4-5]。J亚群是由外源性ALV和内源性ALV重组而成,主要引起鸡的传染性致骨髓细胞瘤疾病或成髓性白血病[6],而A、B亚群则主要诱发鸡的淋巴细胞白血病[7]。在国务院颁布的《我国中长期动物疫病防治规划(2010—2020年)》中,把禽白血病列为必须净化的疫病之一。得益于我国禽白血病检疫和净化措施的严格执行,国内白羽肉鸡和蛋用型鸡的ALV携带率得到有效控制。尤其近几年,鲜有典型病例的暴发,成为我国首个不使用疫苗仅通过种源净化而被有效防控的禽类传染病。然而,在我国某些固有的地方品种鸡群中,禽白血病还不时有散发流行,尤其在农户混养、散养鸡群中仍可能存在外源ALV感染的隐患。因此,在重视集约化养鸡场白血病净化的同时,仍须对农户散养鸡群开展ALV检测和净化。
为此,山西省农业科学院畜牧研究所边鸡课题组对2018—2019年于晋北地区农户散养边鸡群中采集到的92份蛋清和血清样品进行了ALV-p27抗原、ALV-A/B及ALV-J抗体的ELISA检测,旨在为该区域散养边鸡群ALV的防控和净化提供参考依据。
1 材料和方法
1.1 样品采集
2018—2019年于山西晋北地区农户散养边鸡群中采集20周龄商品代蛋鸡开产初期种蛋蛋清12份,1周龄育雏期商品代蛋鸡血液样本80份。
1.2 主要试剂
ALV-p27抗原、ALV-A/B及ALV-J抗体检测试剂盒均购自美国IDEXX公司。DMEM细胞培养液、胎牛血清(FBS)及胰酶消化液(0.25% )均购自北京索莱宝生物科技有限公司。鸡胚成纤维细胞系(DF-1)由山西农业大学动物生理学实验室惠赠。
1.3 ALV抗原与ALV-A/B、ALV-J抗体检测
1.3.1 种蛋ALV-p27抗原检测 从种蛋中吸取蛋清0.5 mL,-20℃反复冻融3次,恢复至室温后静置离心,吸取50μL蛋清液加入ELISA反应板中,按照试剂盒操作说明检测ALV-p27抗原。
1.3.2 血清ALV-p27抗原检测 肝素钠采血管采集的鸡血凝固后以4 000 r/min离心10 min,将血清分离,于-20℃保存备用。检测时取50μL血清加至ELISA反应板中,按照试剂盒操作说明检测ALV-p27抗原。
1.3.3 ALV-A/B与ALV-J抗体检测 用稀释液将血清样品稀释为1∶500,参照ALV-A/B和ALV-J抗体检测试剂盒操作对ALV-A/B和ALV-J抗体进行检测。
1.3.4 DF-1细胞培养液ALV-p27抗原检测 将ALV-p27抗原ELISA检测阳性的蛋清和阳性血清对应抗凝血样品接种于单层DF-1细胞,同时设无ALV-p27抗原的DF-1阴性对照。37℃5% CO2孵育2 h,更换含3% FBS、1% 氨苄青霉素的DMEM持续培养7 d,培养结束后反复冻融3次,取细胞培养液经ELISA检测ALV-p27抗原。
2 结果与分析
2.1 ALV-p27抗原检测结果
从表1可以看出,受试的蛋鸡蛋清和血清中ALV-p27抗原阳性率为9.78% 。ALV-A/B和ALV-J抗体阳性率分别为20.00% 和6.25% ,ALV-A/B和ALV-J亚群间共感染阳性率为0。结果表明,受试的蛋鸡群存在外源性禽白血病病毒感染,不存在ALV-A/B和ALV-J 2种或3种亚群共感染情况。
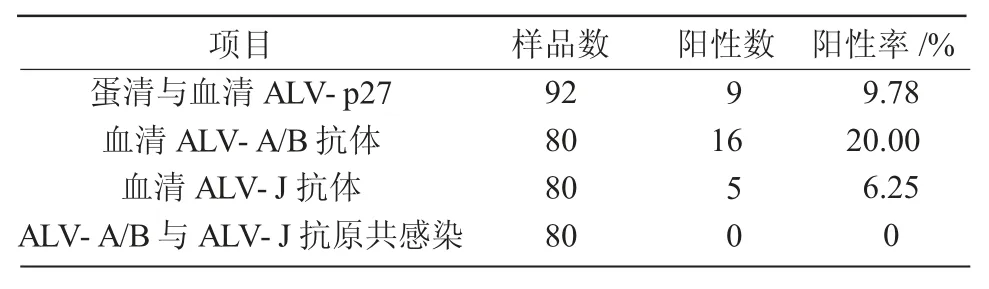
表1 ALV-p27抗原和ALV-A/B、ALV-J抗体检测
2.2 DF-1细胞培养物ALV-p27抗原检测
将DF-1细胞培养7 d后的上清液用ELISA试剂盒检测ALV-p27抗原。结果显示,9份受试样品的细胞培养液中均呈ALV-p27抗原阳性,确定此9份样品来源的边鸡个体均感染外源性ALV。
3 结论与讨论
目前,有关ALV及其亚群的检测方法通常包括酶联免疫吸附试验(ELISA)、间接免疫荧光检测法(IFA)、病毒中和试验(NT)、琼脂扩散试验(AGP)、免疫组化(IHC)、PCR、RT-PCR、环介导等温扩增技术(LAMP)、斑点分子杂交技术等[8-12]。为最大程度保证检测的准确性,可同时结合血清学检测和分子生物学检测2种方法对ALV病原进行检测。本试验内容仅作为该鸡场白血病净化前期临床调查,故只采用ELISA作为检测手段。此外,有研究表明,应用ELISA对接种ALV的SPF鸡肝脏、血清、骨髓组织的阳性检出率均为100% ,而对泄殖腔棉拭子的阳性检出率为70% ,提示可能由于泄殖腔棉拭子的病毒采集量太低,以至于出现假阴性现象,临床检测中应尽可能选择血清作为检测样本[13]。
本试验表明,供试边鸡群的ALV携带率为9.78% ;而张桂枝等[14]检测的三黄鸡泄殖腔棉拭子和蛋清ALV-p27阳性率分别为8.15% ~24.28% 和5.09% ~14.44% ;葛成等[15]检测的太行鸡、海兰褐、坝上长尾鸡蛋清的ALV-p27携带率分别为8.38% ~21.35% 、1.12% ~1.43% 、10.91% 。本研究边鸡群ALV-A/B抗体阳性率为20.00% ,张桂枝等[14,16]检测的三黄鸡血清ALV-A/B抗体阳性率为6.25% ~33.70% ,绿壳蛋鸡为30.43% ,青脚麻鸡为18.48% ,固始鸡为28.26% 。本研究边鸡群ALV-J抗体阳性率为6.25% ,张桂枝等[14,16]检测的三黄鸡血清ALV-J抗体阳性率为2.17% ~22.83% ,绿壳蛋鸡为16.85% ,青脚麻鸡为6.52% ,固始鸡为17.39% 。由于本试验受试样本数量相对较少,与上述研究中蛋鸡ALV的检出率不具有统计学横向比较意义,仅作为该蛋鸡场ALV的净化参考。钱晨[17]研究了不同品种鸡ALV-A/B和ALV-J的感染情况,发现ALV-A/B、ALV-J感染率最高的依次为黄羽肉鸡、麻鸡,且这2种肉用或肉蛋兼用型鸡的ALV-J显著高于蛋用型鸡。需要指出的是,通常情况下,鸡染色体基因组中存在的内源性ALV-E cDNA在一定条件下会表达出完整的病毒粒子或仅表达p27抗原蛋白,从而导致基于ALV-p27抗原的ELISA检测阳性率增高[18]。但是,本试验结果中却出现了ALV-A/B抗体阳性数远高于ALV-p27抗原阳性数的现象。通常认为,先天性感染的内源性ALV不会激发免疫系统产生抗体[12],但也有研究表明,通过大肠杆菌表达的ALV-E gp85蛋白(膜表面蛋白SU)免疫鸡后,部分鸡血清中稳定产生了与ALV-A/B发生交叉反应的抗体,可用ALV-A/B抗体ELISA试剂盒检出[19]。据此,笔者推测本试验中ALV-A/B抗体阳性数高于ALV-p27抗原阳性数,可能是因内源性ALV-E产生了与外源性ALV相应的抗体交叉反应所致。该鸡场边鸡群中是否存在ALV-E的完整传染性粒子,是否存在gp85(ALV主要抗原表位)的表达,还需在SPF鸡胚来源的15B1 CEF细胞上进行病毒的传代分离及细胞培养上清液和基因组中gp85基因的PCR扩增予以佐证。
本研究表明,晋北农户散养边鸡群感染的ALV亚群包括外源性ALV-A/B、ALV-J,未发现2种亚群病毒共感染个体存在。前期可依据ALV-p27抗原和ALV-J抗体检测阳性结果淘汰ALV阳性带毒鸡。建议将ALV-A/B抗体检测阳性鸡血接种DF-1细胞进行病毒传代分离、ELISA检测后再行淘汰对应ALV-A/B阳性带毒鸡。
