miR-497-5p靶向调控CCNE1基因抑制胰腺癌细胞增殖
2020-09-11姜达伟许浏王伟林
姜达伟,许浏,王伟林
0 引言
胰腺癌(Pancreatic cancer,PaCa)是恶性程度极高的实体肿瘤,以早期诊断困难、进展迅速、易转移和化学耐药性为主要临床特征[1]。虽然近年来PaCa的治疗取得了较大进步,包括手术切除、化疗和放疗,但PaCa患者术后5年总体生存率仍低于5%[2]。微小RNA(microRNA,miR)是一类长度极短的非编码RNA分子,通过直接结合靶基因的3'-非翻译区(3'-untranslated region,3’-UTR)而在转录后调节靶基因表达,表现为诱导mRNA降解或抑制mRNA翻译[3]。有研究表明,miR在PaCa的发生和进展中具有关键调控作用[4]。研究发现,miR-497-5p在血管肉瘤中表达下调,并且靶向调控KCa3.1离子通道抑制肿瘤细胞的增殖与侵袭[5]。骨肉瘤组织和细胞中同样发现miR-497-5p表达下调,且过表达miR-497-5p靶向调控ADP-核糖基化因子样蛋白2(ADP ribosylation factor-like protein 2,ARL2)抑制肿瘤细胞的增殖并诱导凋亡[6]。此外,Chai等[7]发现miR-497-5p在黑色素瘤组织中表达下调,过表达miR-497-5p抑制A375细胞增殖、迁移和侵袭,并诱导凋亡。目前,miR-497-5p在PaCa中的作用及其分子机制尚未明确。本研究拟对比进行探讨,为该肿瘤的治疗提供新的见解及思路。
1 资料与方法
1.1 临床样本收集
收集2008年3月—2013年3月嘉兴学院附属医院肝胆胰外科通过手术或穿刺方式获取的34例PaCa癌组织及其相应的癌旁正常组织(癌细胞边缘≥3 cm),其中男22例,女12例,平均年龄51.72±5.96岁,29例导管腺癌,5例腺鳞癌。患者术前均无放化疗记录。所有组织均由本院两位病理学专家以双盲方式进行检查核对,立即放置于液氮中进行快速冷冻并储存于-80℃备用。该研究已获嘉兴学院附属第一医院伦理委员会批准,所有患者均签署书面知情同意书。术后随访时间为5年,生存期为手术至死亡时间或手术至最后记录点时间。
1.2 仪器与试剂
Prism 7900HT/FAST型荧光定量PCR仪(Applied Biosystems,美国),酶标仪(Thermo Fisher Scientific,美国),FACSCalibur流式细胞仪(Beckman,美国),E-Gel Imager凝胶成像系统(Invitrogen,美国),LSM710倒置光学显微镜(Zeiss,德国),荧光素酶测试仪(Invitrogen,美国)。反转录试剂(Qiagen,德国),荧光定量试剂盒(Takara,日本),细胞培养基、血清及lipofectamine 2000转染试剂(Thermo Fisher Scientific,美国),Annexin V-FITC/PI凋亡试剂盒(BD,美国),抗CCNE1抗体(Santa Cruz Biotechnology,美国),miR-497-5p模拟物及模拟物阴性对照(RiboBio,中国广州),双荧光素酶报告基因试剂盒(Promega,美国),Capan-2和PANC-1细胞(ATCC,美国)。
1.3 细胞转染
miR-497-5p模拟物及模拟物阴性对照的序列分别是5’-CAGCAGCACACUGUGGUUUGUAAACCACAGUGUGCUGCUGUU-3’和5’-UUCUCCGAACGUGUCACGUTT-3’。将Capan-2和PANC-1细胞接种至6孔板中,细胞融合度约80%后更换无血清培养基。使用lipofectamine 2000进行转染,分别加入100 pmol miR-497-5p模拟物及模拟物阴性对照,培养6 h后更换含血清培养基,继续培养48 h后收集细胞并检测转染效率。
1.4 CCK-8实验检测细胞增殖
将转染后的Capan-2和PANC-1细胞接种至96孔板中,37℃、5%CO2的条件下分别培养0、12、24、48及72 h,加入20 μl CCK-8溶液,继续培养 2 h。利用酶标仪在450 nm的波长下检测每孔光密度值。
1.5 流式细胞术检测细胞周期变化
将转染后的Capan-2和PANC-1细胞接种至6孔板中,37℃、5%CO2的条件下培养48 h后收集细胞,并将细胞密度调至1×106个/毫升。取1 ml单细胞悬浮液放至75%乙醇中4℃固定过夜。冷PBS洗涤细胞三次,37℃恒温水浴中用RNase A处理细胞30 min,并在4℃暗室中用碘化丙啶染色20 min。流式细胞仪检测各期细胞比例。
1.6 实时荧光定量PCR实验
TRIzol试剂抽提细胞和组织的总RNA,并进行反转录反应。miR-497-5p反转录反应条件:37℃ 60 min,95℃ 5 min及4℃ 30 min。miR-497-5p实时荧光定量PCR反应条件为:95℃ 15 min,94℃ 15 s,55℃ 30 s,72℃ 30 s,共40个循环。miR-497-5p正义引物:5’-CCTTCAGCAGCACACTGTGG-3’;反义引物:5’-CAGTGCAGGGTCCGAGGTAT-3’;以U6为内参,U6正义引物:5’-CTCGCTTCGGCAGCACA-3’;反义引物:5’-AACGCTTCACGAATTTGCGT-3’。CCNE1反转录反应条件:37℃ 15 min,85℃ 5 s及4℃30 min。CCNE1实时荧光定量PCR反应条件为:98℃ 20 min,98℃ 10 s,60℃ 30 s,72℃ 30 s,共40个循环。CCNE1正义引物:5’-GGAAGAGGAAGGCAAACGTG-3’;反义引物:5’-GCAATAATCCGAGGCTTGCA-3’;以GAPDH为内参,正义引物:5’-TCGTGGAAGGACTCATGACC-3’;反义引物:5’-ATGATGTTCTGGAGAGCCCC-3’。采用2-ΔΔCt法计算PaCa细胞和组织中miR-497-5p和CCNE1 mRNA的相对表达水平。
1.7 双荧光素酶报告基因实验
采用MiRcode 11(http://www.mircode.org)分析miR-497-5p与CCNE1 3'-UTR之间的结合位点。将人CCNE1 mRNA 3’-UTR(包括miR-497-5p的互补结合位点)克隆至pmirGLO双荧光素酶报告质粒的萤火虫基因的下游,构建CCNE1-野生型(WT)报告质粒。同时将突变的结合位点插入萤火虫基因的下游产生CCNE1-突变体(MUT)报告质粒。将Capan-2和PANC-1细胞接种至6孔板,共转染0.5 μg CCNE1-WT或CCNE1-MUT报告质粒和50 pmol miR-497-5p模拟物或模拟物阴性对照。转染48 h后,采用双荧光素酶报告分析系统检测萤火虫和海肾荧光素酶活性,并以海肾荧光素酶活性为参照。
1.8 蛋白质印迹法
采用RIPA裂解液在4℃下提取总蛋白。通过12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳胶分离总蛋白,将蛋白质印迹转移至PVDF膜,37℃、5%脱脂奶粉封闭2 h,膜与抗CCNE1抗体(1:500稀释)4℃共孵育过夜。TBST缓冲液洗涤3次后,将膜与辣根过氧化物酶缀合(HRP)的二抗(1:2 000稀释)37℃共孵育1 h。曝光胶片并检测阳性条带。
1.9 统计学方法
采用SPSS19.0软件进行统计学分析。计量资料以平均值±标准差形式表示,计数资料以率的形式表示。采用配对t检验分析miR-497-5p与CCNE1 mRNA在癌组织和癌旁组织中的表达差异。卡方检验分析miR-497-5p的表达与临床病理特征的关系。Kaplan-Meier生存分析法分析miR-497-5p的表达与预后的关系。CCK-8实验结果采用单因素方差分析,其余结果采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-497-5p在PaCa中的表达水平及临床意义
PCR实验结果显示,在癌组织中miR-497-5p表达显著低于癌旁组织(P<0.001),见图1A。T3+T4期患者癌组织中miR-497-5p的表达水平显著低于T1+T2期患者(P<0.001),见图1B。以miR-497-5p在癌组织表达水平的中位数(0.21)为临界值,将34例PaCa患者划分为低表达miR-497-5p组和高表达miR-497-5p组,每组17例。低表达miR-497-5p与较高的T分期相关(P=0.003),而与年龄、性别、肿瘤大小、分化程度、临床分级、淋巴结转移、血管侵犯及CA19-9水平无相关性,见表1。
2.2 miR-497-5p的表达与PaCa患者预后的关系
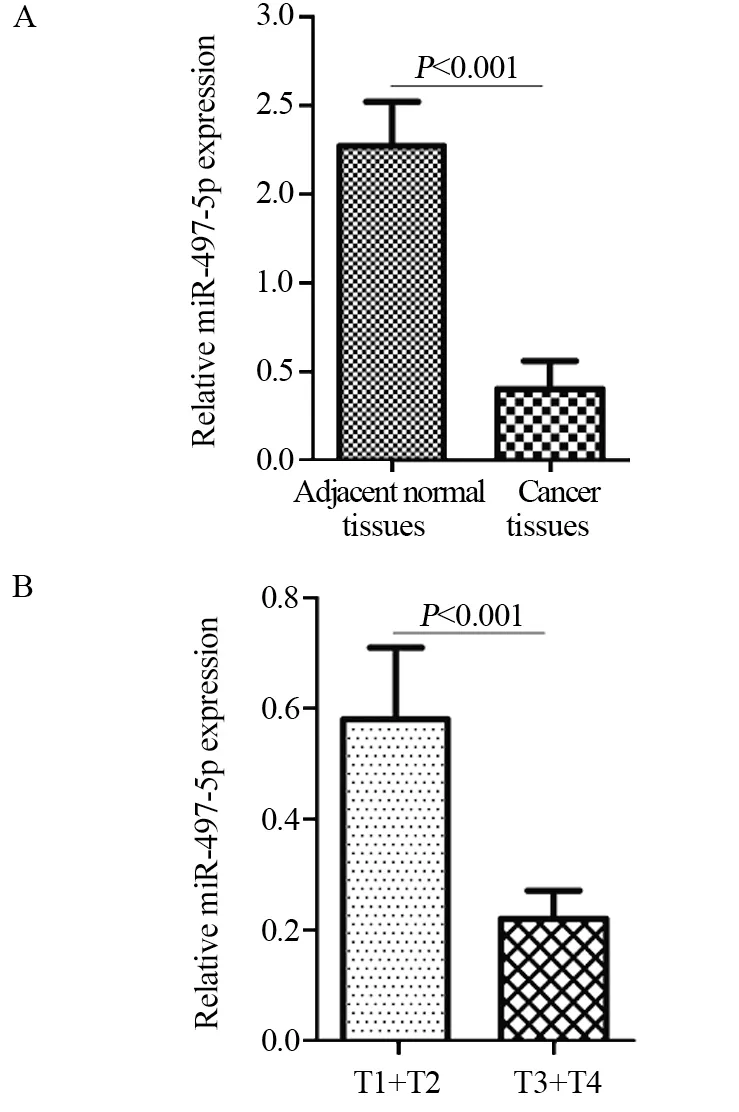
图1 实时荧光定量PCR实验分析miR-497-5p在癌与癌旁正常组织(A)及不同T分期癌组织(B)中的表达Figure 1 miR-497-5p expression in cancer tissues,adjacent normal tissues(A) and different T stages cancer tissues(B)detected by real-time quantitative PCR
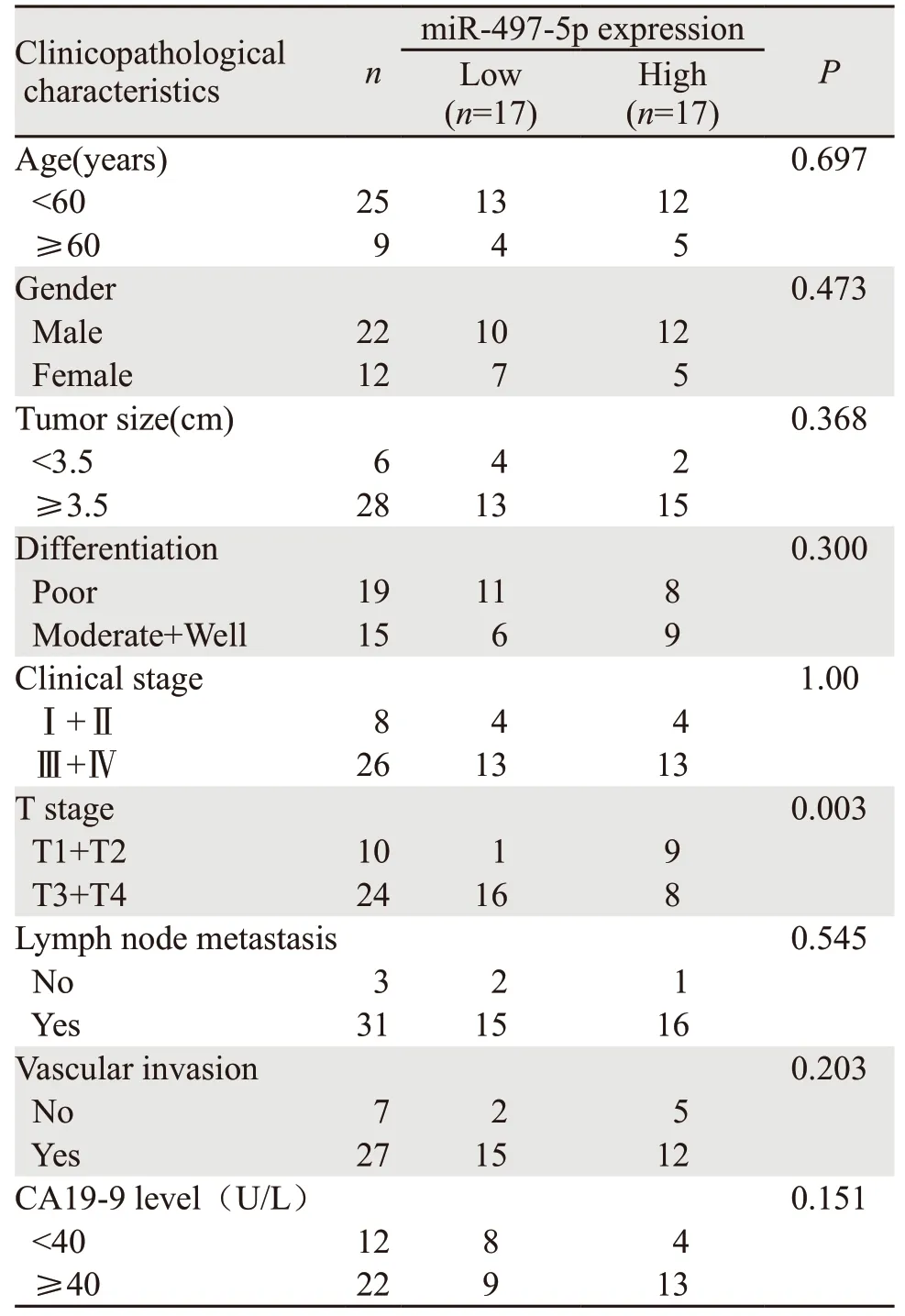
表1 miR-497-5p的表达与胰腺癌患者临床病理特征之间的关系Table 1 Relation between miR-497-5p expression and clinicopathological characteristics of pancreatic cancer(PaCa) patients
低表达miR-497-5p组与高表达miR-497-5p组的中位生存时间分别为31月和47月。低表达miR-497-5p组中15例患者死亡,2例患者存活,生存率为11.76%(2/17);高表达miR-497-5p组中12例患者死亡,5例患者存活,生存率为29.41%(5/17)。低表达miR-497-5p组患者5年总体生存率显著低于高表达miR-497-5p组患者(P=0.036),见图2。

图2 Kaplan-Meier法分析miR-497-5p的表达与PaCa患者预后的关系Figure 2 Relation between miR-497-5p expression and prognosis of PaCa patients detected by Kaplan-Meier method
2.3 过表达miR-497-5p对PaCa细胞增殖的影响
与模拟物阴性对照相比,转染miR-497-5p模拟物可显著提高Capan-2和PANC-1细胞中miR-497-5p的表达水平(均P<0.001),见图3A。与模拟物阴性对照组细胞相比,Capan-2和PANC-1细胞转染miR-497-5p模拟物12、24、48及72 h后细胞的增殖能力显著降低,见图3B~C。与模拟物阴性对照相比,Capan-2和PANC-1细胞转染miR-497-5p模拟物后G0/G1期比例增加,S期比例减少,见图4。
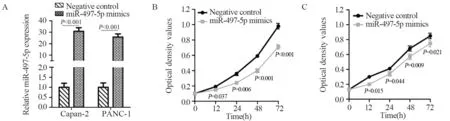
图3 miR-497-5p模拟物促进miR-497-5p的表达(A)并抑制Capan-2(B)和PANC-1(C)细胞的增殖Figure 3 miR-497-5p mimics promoted miR-497-5p expression(A) and inhibited proliferation of Capan-2(B) and PANC-1(C) cells
2.4 miR-497-5p对靶基因CCNE1的直接调控作用
生物信息学分析显示,CCNE1 mRNA 3'-UTR中5’-UGCUGCU-3’序列与miR-497-5p中3’-ACGACGA-5’序列互补结合,见图5A。CCNE1 mRNA在PaCa癌组织的表达水平显著高于癌旁正常组织(P<0.001),且癌组织中CCNE1 mRNA与miR-497-5p表达呈负相关(P<0.001),见图5B~C。与模拟物阴性对照相比,miR-497-5p模拟物显著抑制CCNE1-WT报告质粒转染的Capan-2和PANC-1细胞中的相对荧光素酶活性(P<0.001),见图6A~B。此外,与模拟物阴性对照相比,转染miR-497-5p模拟物后Capan-2和PANC-1细胞中CCNE1蛋白的表达水平显著降低(P<0.001),见图6C。
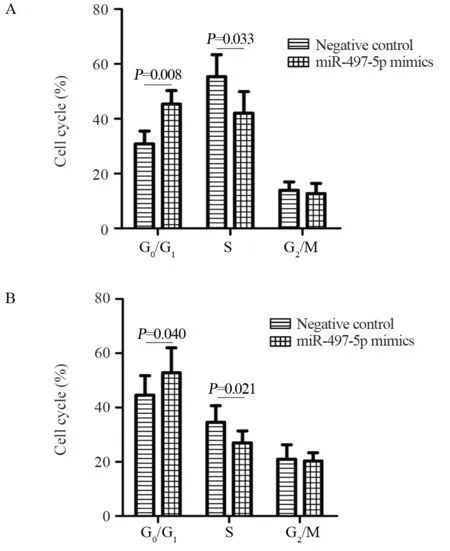
图4 miR-497-5p模拟物对Capan-2(A)和PANC-1(B)细胞周期的影响Figure 4 Effect of miR-497-5p mimics on cell cycle of Capan-2(A) and PANC-1(B) cells
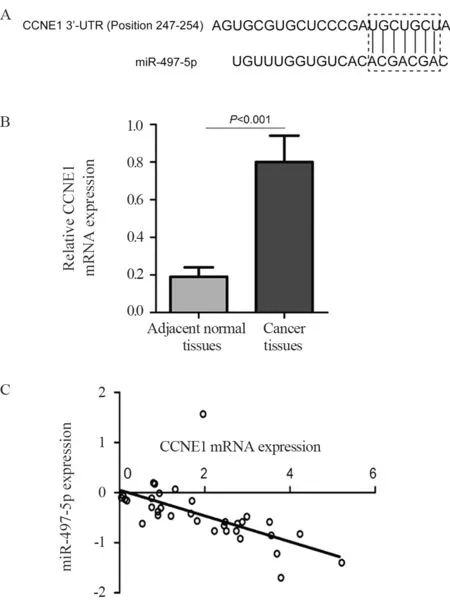
图5 生物信息学分析miR-497-5p对CCNE1的调控作用Figure 5 Effect of miR-497-5P on CCNE1 bioinformatics analysis
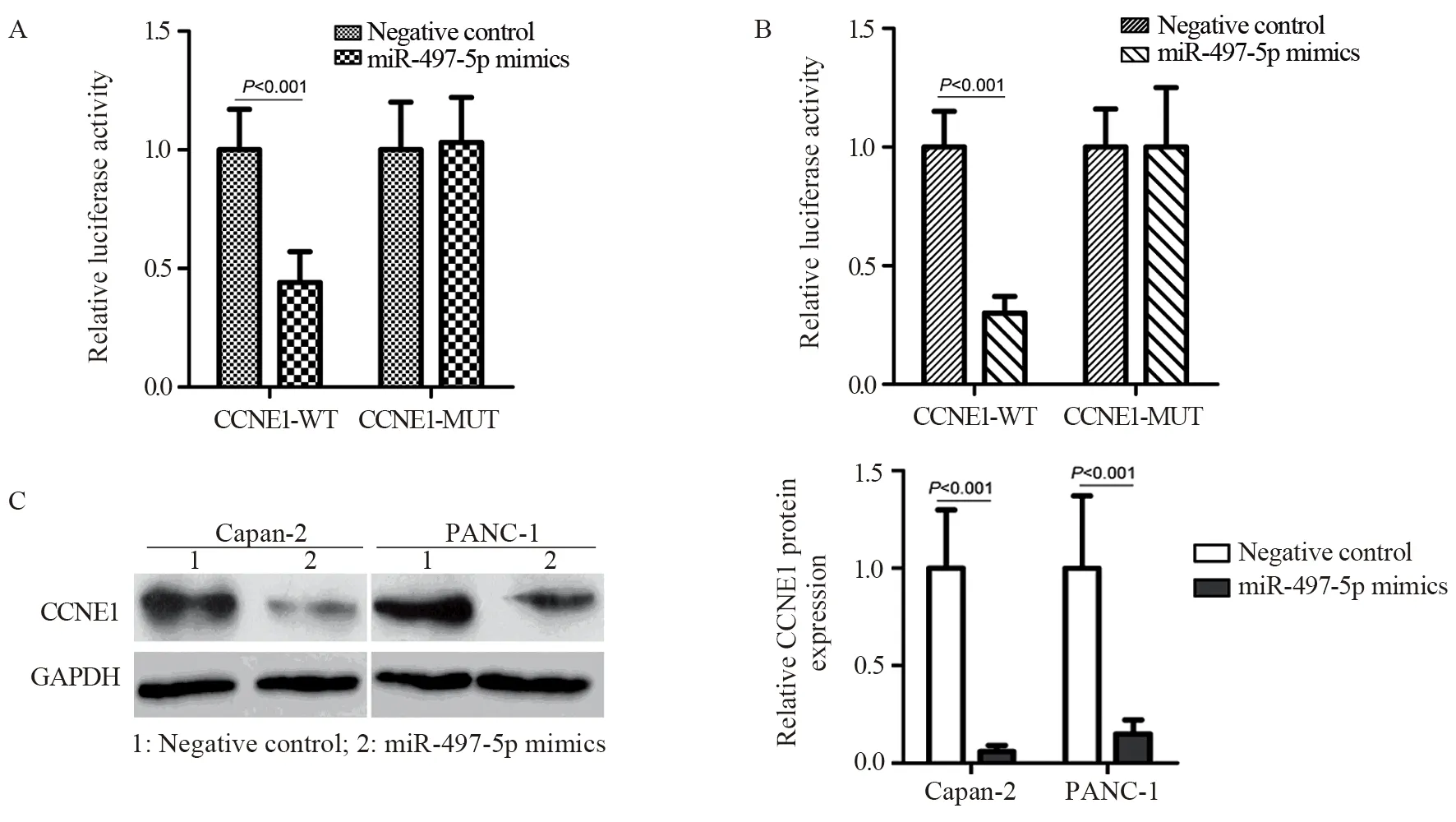
图6 miR-497-5p对CCNE1基因的调控作用分析Figure 6 Analysis of the regulatory effect of miR-497-5p on CCNE1 gene
3 讨论
研究表明,miR参与细胞多种病理与生理过程,包括增殖、凋亡、分化、转移和内分泌稳态等[8]。miR异常表达与人类多种疾病的进展相关,如肿瘤、不育症、精神性疾病、代谢疾病及高血压病等[9-10]。目前,研究者已通过高通量芯片在PaCa中筛选出大批差异表达的miR,部分miR作为致癌因子促进PaCa生长与转移,而另一部分miR作为肿瘤抑制因子降低PaCa生长及转移[11-12]。例如,Lv等[13]报道miR-661在PaCa中表达上调并促进肿瘤细胞增殖,miR-661可能是PaCa预后相关的一种新的标志物。Ta等[14]证实miR-1290在PaCa中发挥致癌因子作用,miR-1290可能是一种新的PaCa诊断和治疗靶标。Zhu等[15]发现miR-101在PaCa中表达下降,过表达miR-101可以抑制肿瘤细胞增殖与侵袭,而干扰miR-101可以降低增殖与侵袭。此外,miR-494通过抑制肿瘤细胞上皮-间质转化、迁移与侵袭在PaCa中起肿瘤抑制因子的作用[16]。然而,目前仍有很大一部分miR在PaCa中的作用和机制尚不清楚。因此,深入研究这部分miR将进一步阐明PaCa发生发展的分子机制,并将为其治疗提供新的靶点。
miR-497-5p定位于人染色体17p13.1区域,属于miR-15/16/195/424/497超家族成员之一。据报道,miR-497-5p在血管肉瘤、结直肠癌及非小细胞肺癌的发生和发展中起重要调控作用[17]。然而,miR-103在PaCa中的生物学功能仍不清楚。本研究发现,miR-497-5p在PaCa癌组织的表达水平显著低于癌旁正常组织,这与miR-497-5p在其他肿瘤中的表达特征一致[17],表明miR-497-5p在PaCa中表达下调。低表达miR-497-5p患者5年总体生存率显著低于高表达miR-497-5p患者,提示低表达miR-497-5p与PaCa不良预后相关。T3+T4期癌组织中miR-497-5p的表达水平显著低于T1+T2期癌组织,且低表达miR-497-5p与较高的T分期相关,提示miR-497-5p可能影响PaCa细胞增殖。PaCa进展是肿瘤细胞增殖与转移的过程,也是肿瘤相关死亡的主要原因。本研究结果证实,过表达miR-497-5p能显著抑制PaCa细胞增殖,该效应主要通过增加细胞周期中G0/G1期比例,并降低S期比例而实现。该研究结果与miR-497-5p在其他肿瘤中的作用一致[5-7],表明miR-497-5p具有一定的抗细胞增殖特性。
本研究发现,CCNE1 mRNA 3'-UTR可与miR-497-5p互补结合,提示CCNE1可能是miR-497-5p的靶基因。CCNE1属于细胞周期蛋白基因家族,具有致癌因子作用,高表达CCNE1与卵巢癌、膀胱癌及乳腺癌预后不良有关[18]。CCNE1可作为CDK激酶的调节剂,与CDK2的调节亚基形成复合物并磷酸化成视网膜细胞瘤基因(RB)转录共抑制因子而促进细胞增殖并加速G1/S转换。CCNE1蛋白在G1/S转换期积累,随着细胞进入S期而降解。目前,研究者已在多种肿瘤中观察到CCNE1基因高表达,且过表达CCNE1导致染色体不稳定并促进肿瘤发生[19]。然而,PaCa中miR-497-5p对CCNE1的调控作用仍不清楚。本研究还发现,CCNE1 mRNA在PaCa癌组织中的表达水平显著高于癌旁正常组织,且与miR-497-5p表达呈负相关。过表达miR-497-5p显著抑制PaCa细胞中CCNE1的蛋白表达水平。此外,miR-497-5p中3’-ACGACGA-5’序列可直接与CCNE1 mRNA 3'-UTR中5’-UGCUGCU-3’序列互补结合而抑制CCNE1蛋白表达。该结果表明,CCNE1是miR-497-5p的靶基因,miR-497-5p通过下调CCNE1基因表达而抑制PaCa增殖。然而,值得注意的是,有报道发现miR-497-5p还可以调控其他靶基因,如信号转导蛋白SMAD3,ARL2和端粒酶亚单位(hTERT)等[9-11]。miR-497-5p是否也通过下调这些靶基因而抑制PaCa细胞的增殖有待进一步研究。
综上所述,miR-497-5p在PaCa中表达下调,低表达miR-497-5p与较高的T分期及不良预后相关。过表达miR-497-5p通过改变细胞周期而抑制PaCa细胞增殖。CCNE1是miR-497-5p的靶基因,miR-497-5p靶向调控CCNE1基因表达抑制胰腺癌细胞的增殖。miR-497-5p可能是一种新的PaCa治疗靶标。
