miR-200c改善转化生长因子-β1诱导的肾小管上皮细胞纤维化的机制
2020-09-01王争裴小华赵卫红
王争,裴小华,赵卫红
(南京医科大学第一附属医院老年肾科,江苏省老年医学重点实验室,南京 210029)
近年来,慢性肾脏病(chronic kidney disease,CKD)的患病率逐年增高,已成为一个重大的公共卫生问题[1]。其中,肾小管间质纤维化是CKD进展至终末期肾病的关键过程。微小RNA(miRNA,miR)是一类内源性短链(21~25个核苷酸)非编码RNA,可以在转录后水平负向调控mRNA,抑制转录,广泛参与肾脏的生理和病理过程[2]。既往研究发现,miRNA参与了自噬的调节过程,在肿瘤、衰老、纤维化等发生发展过程中发挥重要作用。微管相关蛋白-轻链3(microtubule-associated protein 1 light chain 3,LC3)是自噬的标记蛋白,在自噬过程中LC3-Ⅰ可募集磷脂酰乙胺醇形成LC3-Ⅱ,LC3-Ⅱ/LC3-Ⅰ比值的大小可反映自噬小体的合成情况。在miRNA家族中,miR-200c定位于染色体12p13.31上,其在多种器官纤维化中均有参与,但作用机制仍不清楚。另外,Smad蛋白是转化生长因子-β1(transforming growth factor-β1,TGF-β1)诱导纤维化作用的关键细胞内效应分子,其中Smad2和Smad3具有较高的同源性,在许多细胞中都可以被TGF-β1激活;钙黏蛋白(E-cadherin,E-cad)减少或缺失是上皮-间充质转化(epithelial-mesenchymal transition,EMT)的标志性变化;同时α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的重新表达或表达水平增加说明上皮细胞形态学发生了转化。本研究以TGF-β1刺激人肾近曲小管上皮细胞HK2,体外构建纤维化细胞模型,探索miR-200c对小管细胞中自噬变化的调节,为延缓肾小管间质纤维化提供新的理论依据。
1 材料与方法
1.1 实验材料
人肾脏近曲小管上皮细胞HK-2(ATCC,美国),DMEM/F12培养基、胎牛血清(Gibco,美国),TGF-β1(Peprotech,美国),兔抗LC3(LC3Ⅱ/Ⅰ)、P62、E-cad、Smad2、Smad3、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体(CST,美国),兔抗α-SMA多克隆抗体(三鹰生物技术有限公司,中国武汉),miR-200c引物、U6引物、micrON miRNA mimic、riboFECT CP转染试剂(锐博生物科技有限公司,中国广州)。
1.2 方法
1.2.1 细胞培养 HK2细胞采用DMEM/F12培养基 + 10%胎牛血清,在5% CO2、37℃完全饱和湿度的培养箱中培养,待细胞达80%~90%融合时用0.25%胰酶消化,以1∶3比例传代,选择对数生长期细胞用于实验。
1.2.2 细胞形态学变化 分别在倒置显微镜下观察不同浓度(0、5、10、15、20、30 ng/ml)TGF-β1刺激48 h后的HK2细胞形态变化,并拍照采集图片。
1.2.3 CCK8检测细胞活性 HK2细胞消化后以每孔5 000个细胞接种至96孔板中,每个浓度设置5个复孔,待细胞贴壁后于含有10%胎牛血清的培养基中加入不同浓度TGF-β1刺激HK2细胞48 h,然后每孔加入10 μl CCK8试剂,于5% CO2、37℃培养箱中孵育2 h,在450 nm处检测各孔吸光度A(A450nm)。
1.2.4 细胞转染及分组 选择致细胞增殖最快的TGF-β1浓度(c)制作纤维化模型。将约4×105个细胞接种于6孔板中,于培养箱内培养,细胞密度达到30%~50%融合时换无血清、无双抗培养液以备转染。按照转染试剂说明书操作,转染浓度40 nmol/L。分组:(1)细胞转染40 nmol/L无意义序列RNA(NC组);(2)细胞转染40 nmol/L无意义序列RNA后浓度为c的TGF-β1处理细胞48 h(NC + T组);(3)细胞转染40 nmol/L miR-200c mimics(M组);(4)细胞转染40 nmol/L miR-200c mimics后浓度为c的TGF-β1处理细胞48 h(M + T组)。
1.2.5 qRT-PCR检测转染效率 细胞处理完后,用TRIzol试剂提取总RNA,按照Bulge-LoopTMmiRNA qRT-PCR Starter Kit试剂盒说明书逆转录合成cDNA,qRT-PCR定量检测。U6作为内参基因,2-ΔΔCT法计算miR-200c相对表达量,以表达量升高30倍为转染有效。
1.2.6 Western blotting检测蛋白表达 消化收集各组细胞,预冷PBS清洗3遍后,根据细胞量加入适量RIPA裂解液和蛋白酶抑制剂,冰上裂解30 min,12 000转/min,4℃离心20 min。BCA法测定蛋白浓度。取5~30 μg总蛋白进行凝胶电泳(SDS-PAGE),然后转移蛋白至0.22 μm的PVDF膜上,5%脱脂牛奶(TBST配制)室温封闭1 h。加入1∶1 000稀释的抗体Smad2、Smad3、E-cadherin、α-SMA、LC3、P62等4℃孵育过夜,洗膜(10 min×3次)后,加入1∶10 000的二抗4℃ 2 h,再次洗膜(10 min×3次)后,显影。
1.3 统计学处理
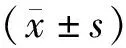
2 结 果
2.1 不同浓度TGF-β1对HK2细胞形态的影响
不同浓度(0、5、10、15、20、30 ng/ml)的TGF-β1分别诱导HK-2细胞48 h后,随着TGF-β1浓度的增加HK-2细胞形态由正常的卵圆形铺路石状,逐渐呈成纤维细胞形态,即出现细胞长梭形改变。5 ng/ml时细胞形态逐渐变化,10及15 ng/ml时细胞纤维化形态明显,30 ng/ml时细胞开始调亡(图1)。
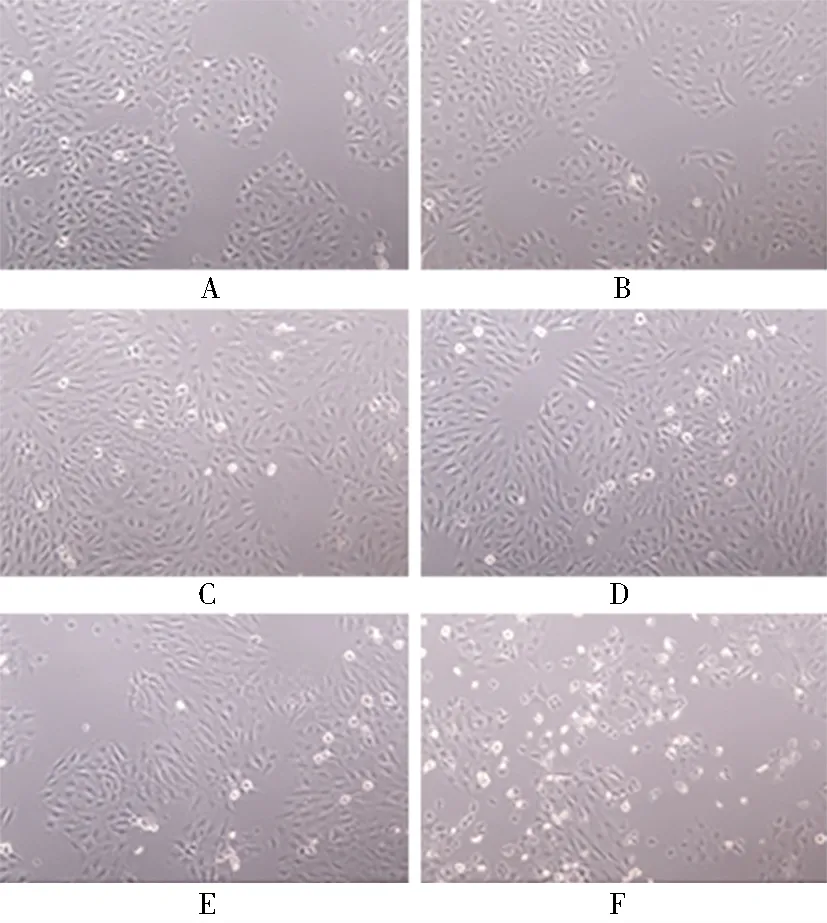
图1 不同浓度TGF-β1刺激HK2细胞48 h后形态变化
2.2 不同浓度TGF-β1对HK2细胞活性的影响
CCK-8结果显示,不同浓度(0、5、10、15、20、30 ng/ml)TGF-β1分别诱导HK-2细胞48 h后A450nm分别为1.59±0.02、1.68±0.02、1.85±0.03、1.70±0.03、1.29±0.00、1.21±0.00。TGF-β1在10 ng/ml浓度时,细胞增殖最明显,与其他浓度组相比较差异有统计学意义(P<0.05),结合10、15 ng/ml时细胞的形态改变,选择10 ng/ml作为刺激浓度。
2.3 转染效率检测
qRT-PCR结果显示,转染了miR-200c mimics的细胞(M组)中miR-200c的表达量是NC组的(212.42±12.25)倍(t=24.41,P=0.000),说明转染有效。
2.4 4组HK2细胞纤维化水平比较
Western blotting结果显示,与NC组比较,NC + T组加入10 ng/ml的TGF-β1刺激HK2细胞48 h后,Smad2、Smad3和α-SMA蛋白表达量增加,E-cadherin蛋白表达量降低(P<0.05)。与NC + T组比较,M + T组Smad2、Smad3和α-SMA蛋白表达量减少,E-cad蛋白表达量增加(P<0.05),提示miR-200c表达增加抑制了纤维化(图2)。
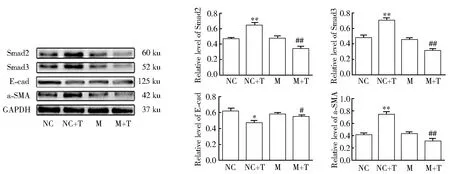
图2 转染miR-200c mimics后细胞纤维化标志物的表达
2.5 4组HK2细胞自噬水平比较
进一步通过Western blotting分析发现,M组较NC组的LC3-Ⅱ/LC3-Ⅰ表达水平增加,P62表达水平降低,提示自噬活性增加。M + T组较NC + T组的LC3-Ⅱ/LC3-Ⅰ表达水平增加,P62表达水平降低,提示miR-200c缓解纤维化可能与增加自噬水平有关(图3)。
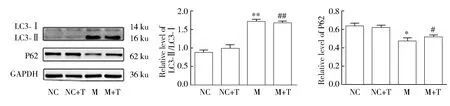
图3 转染miR-200c mimics后自噬相关蛋白的表达
3 讨 论
肾小管间质纤维化是各种慢性肾病的共同点,主要表现为细胞外基质大量沉积、炎症细胞的浸润、成纤维细胞的活化与激活、EMT等,其中EMT是导致肾脏发生纤维化的重要因素[3]。TGF-β1作为TGF-β超家族的一员,是经典的致纤维化因子。本课题组前期多项研究也显示,肾小管上皮细胞在TGF-β1诱导下发生纤维化,磷酸化的Smad 2/3(p-Smad 2/3)蛋白水平表达量增加,E-cad在mRNA和蛋白水平表达量降低,α-SMA在mRNA和蛋白水平表达量增加[4-6]。TGF-β1可将位于细胞胞质中的Smad 2和Smad 3磷酸化后转移至细胞核中调控下游基因的转录,介导EMT的发生[7]。此过程中,上皮细胞标志物E-cad的表达减少,间质细胞标志物α-SMA表达增加。
miR-200c是miR-200家族的成员之一,参与肿瘤的发生、转移与侵袭,以及纤维化的发生发展。近年来研究miR-200c调控纤维化的机制主要分为两个方面,其一是参与EMT的过程,miR-200c可以靶向调控EMT转录因子ZEBs,抑制其表达水平[8];另一方面,miR-200c与TGF-β/Smad信号通路之间的相互调控是纤维化发生发展的重要机制[9]。研究发现miR-200c的表达水平在特发性肺纤维化患者肺组织中下降[10],在大鼠实验性肺纤维化组织中表达亦下调,高表达miR-200c后可抑制TGF-β1诱导的EMT,从而逆转肺纤维化[11]。Blahna等[12]研究发现在TGF-β的诱导下,位于miR-200c启动子序列上的Smad结合位点与Smad3结合,可以抑制miR-200c的表达。EMT是指上皮细胞之间连接消失,细胞骨架重组,向间充质细胞转变,产生成纤维细胞,最终导致组织器官纤维化的过程。TGF-β1是公认的致纤维化因子,主要以TGF-β1/smad信号传导途径介导EMT。miR-200c具有抗纤维化作用。本研究结果显示,在TGF-β1诱导的肾脏纤维化模型中,转染miR-200c mimics后,与NC+T组比较,Smad 2、Smad 3、α-SMA表达水平降低,E-cadherin表达水平增加,表明miR-200c可以抑制TGF-β1诱导的肾小管上皮细胞纤维化。
自噬(autophagy)是在饥饿、缺氧或应激等状态下,细胞内受损的细胞器或多余蛋白质被溶酶体降解的过程[13]。LC3和P62是监测自噬的重要标志物。Livingston等[14]使用CAG-RFP-GFR-LC3自噬报告转基因小鼠动态监测单侧输尿管梗阻(unilateral ureteral obstruction,UUO)模型小鼠体内自噬形成和成熟情况,结果显示UUO早期即可出现自噬体形成,中后期自噬保持高水平活化状态。新近的研究表明,miRNA在自噬过程中发挥重要的调节作用。Xu等[15]发现miR-326可以靶向作用于PTBP1促进自噬,来缓解硅引起的肺脏纤维化。还有研究证明,在小鼠矽肺模型中过表达miR-449a,可增加小鼠体内的自噬活性[16]。然而,miR-200c和自噬的调节在肾纤维化中的作用机制仍不清楚。本研究中,正常HK2细胞转染miR-200c mimics后,自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ表达明显增加,P62表达降低,即miR-200c过表达促进了细胞自噬的发生。同时,M + T组较NC + T组的细胞自噬水平增加,且Smad 2、Smad 3、α-SMA表达水平降低,E-cadherin表达水平增加,提示miR-200c过表达可能通过增加自噬水平使纤维化得到缓解。
综上所述,miR-200c可以促进细胞自噬的发生,并且可能通过激活自噬部分缓解TGF-β1诱导的肾小管上皮细胞纤维化。此实验探究了自噬与肾小管间质纤维化之间的相互作用,对寻找肾脏纤维化潜在的治疗靶点、发展新的预防措施和临床诊疗方法意义重大。
