基于聚(2-甲基-2-唑啉)和聚丙烯酸的混合刷在毛细管电泳在线富集溶菌酶中的应用
2020-08-26王雨晨MUHAMMADAtif陈丽娟王延梅
张 淼, 王雨晨, MUHAMMAD Atif, 陈丽娟, 王延梅*
(1. 中国科学技术大学高分子科学与工程系, 安徽 合肥 230026;2. 皖西学院材料与化工学院, 安徽 六安 237012)
溶菌酶又称胞壁质酶,是一种广泛存在于生物体内的碱性蛋白质。溶菌酶不仅可以水解细菌细胞壁中的肽聚糖,导致细胞壁破裂,菌体溶解,而且能够与病毒蛋白直接结合使病毒失活,具有抗菌、抗病毒、消炎等功效而广泛应用于食品、医药等行业[1,2]。此外,溶菌酶常被用作模型蛋白,用于研究蛋白质的构象、酶动力学及其与分子免疫间的关系等[3]。目前,常用的溶菌酶检测方法有分光光度法[4]、酶联免疫吸附法(ELISA)[5]、高效液相色谱法(HPLC)[6]和毛细管电泳法(CE)[7]等。CE由于分析速度快、分离效率高、试剂消耗量少等优点,广泛用于蛋白质的分离分析中[8-10]。紫外检测器(UV)是CE常用的检测方式,但是由于毛细管进样体积小和检测光程短等,使CE-UV的检测灵敏度受到限制[11]。提高检测灵敏度的常用方法有:采用高灵敏度的检测器[12]、使用离线富集技术和在线富集技术[13,14]等。激光诱导荧光检测器具有较高的检测灵敏度,但是对待测物繁琐的衍生过程和高昂的成本限制了其广泛应用。离线富集技术需要对目标分析物进行过滤、萃取、吸附等前处理以提高检测灵敏度,该方法试剂消耗量大、操作过程繁琐。在线富集技术则是通过调节目标分析物所处状态以及仪器参数使分析物得到高倍富集,从而达到提高检测灵敏度的目的,具有操作简便、价格低廉等优点。目前常用的毛细管电泳在线富集技术主要包括样品堆积、动态pH界面、吹扫、瞬间等速电泳等[14],此外,利用具有刺激响应性的混合刷涂层毛细管实现蛋白质的在线富集是提高检测灵敏度的一种新思路[15,16]。
混合刷是由两种及两种以上的聚合物链接枝在基底上形成的刷状表面[17]。由刺激响应性聚合物和具有抗蛋白质吸附性能的聚合物组成的混合刷在调控蛋白质吸附方面有广泛的研究[18,19]。聚丙烯酸(PAA)是一种常见的刺激响应性聚合物,将PAA和具有抗蛋白质吸附性能的聚合物接枝到基底表面形成混合刷,随着外界环境(pH和离子强度(I))的改变,PAA链构象发生变化,导致混合刷中两种聚合物交替暴露在外面,涂层呈现出不同的性质,从而调节涂层与蛋白质之间的相互作用。Delcroix等[20-22]制备了由PAA与具有抗蛋白质吸附性能的聚乙二醇(PEO)组成的混合刷,在pH 7 (I=10-5mol/L)条件下,PAA链带负电荷且呈伸展状态,可吸附大量的溶菌酶;在pH 3 (I=10-1mol/L)时,PAA链不带电荷且处于塌缩状态,之前吸附的溶菌酶得以释放,同时暴露在外表面的PEO可以阻抗蛋白质进一步吸附。与单组分PAA刷相比,PEO的加入使混合刷对溶菌酶的脱附率大大提高。Gong等[23]通过聚多巴胺(PDA)依次将聚(2-甲基-2-唑啉)(PMOXA)及PAA接枝在玻璃/硅表面形成PMOXA/PAA混合刷,当PAA接枝密度为PMOXA的一半时,混合刷可以达到与单组分PAA刷相同数量级的溶菌酶吸附量(898.4 ng/cm2),而脱附率接近单组分PMOXA刷的脱附率(91.3%),实现了对溶菌酶的可逆吸附。Hou等[15]利用上述方法制备了PMOXA/PAA混合刷涂层毛细管,用于毛细管电泳在线富集溶菌酶。结果表明,当PAA链长为PMOXA链长的1.56倍时,其检测信号强度是普通电泳法检测信号的26倍。然而,该涂层毛细管的制备过程繁琐,所用时间较长。
研究表明,甲基丙烯酸缩水甘油酯(GMA)的环氧基团与基底表面的官能团(-OH、-NH2)在加热时可发生反应,形成稳定的共价键涂层[24-26],同时,GMA之间的自交联反应可使涂层的稳定性进一步增强。我们之前的研究表明[27,28], GMA可以分别通过自由基共聚和可逆加成-断裂链转移(RAFT)聚合与PMOXA和PAA形成共聚物,即聚(2-甲基-2-唑啉)-r-甲基丙烯酸缩水甘油酯(PMOXA-r-GMA)和聚丙烯酸-b-聚甲基丙烯酸缩水甘油酯(PAA-b-PGMA)。将PMOXA-r-GMA和PAA-b-PGMA的混合溶液旋涂在硅片上,经过加热即可制备出基于PMOXA和PAA的刺激响应性混合刷,实现对溶菌酶的可控吸附和释放。基于以上研究,本文通过一步加热法制备了PMOXA-r-GMA/PAA-b-PGMA涂层毛细管,并将其用于毛细管电泳在线富集溶菌酶,为毛细管电泳检测痕量蛋白质提供了一种简单的方法。
1 实验部分
1.1 仪器、试剂与材料
VG ESCALAB MK Ⅱ型X射线光电子能谱仪(英国VG Scientific Instruments公司); Olympus BX81光学显微镜(日本Olympus公司);熔融石英毛细管(内径50 μm,外径365 μm,总长40 cm,有效长度30 cm,河北永年锐沣色谱器件有限公司); P/ACE MDQ毛细管电泳仪(美国Beckman公司)。
GMA(纯度97%)购自上海阿拉丁公司,使用前用碱性氧化铝除去其中的阻聚剂;MOXA(纯度98%)购自Sigma公司,使用前用氢化钙干燥,然后常压蒸馏;N,N-二甲基甲酰胺(DMF,分析纯)、丙烯酸(AA,化学纯)、甲基丙烯酸(MAA,化学纯)、乙腈(分析纯)均购自国药集团化学试剂有限公司,使用前减压蒸馏;溶菌酶(Mr约14.3 kDa,等电点约为11.1)购自Biosharp公司;三氟甲磺酸甲酯(MeOTf,纯度≥98%)、异硫氰酸荧光素(FITC)购自Sigma公司;偶氮二异丁腈(AIBN)购自天津市光复精细化工研究所,使用前重结晶;三乙胺(TEA)、盐酸、氯化钠、磷酸、二水合磷酸二氢钠、氢氧化钠、苯甲醇均为分析纯,购自国药集团化学试剂有限公司;实验用水为去离子水,购自合肥蓝蓝水业。
1.2 溶液的配制
将二水合磷酸二氢钠溶于水,用氢氧化钠、磷酸和氯化钠调节pH和I分别配制成pH 7磷酸盐缓冲液(I=10-5mol/L)和pH 3磷酸盐缓冲液(I=10-1mol/L)。
1.3 聚合物的制备[27,28]
以MeOTf为引发剂、MOXA为单体、MAA和TEA为终止剂,通过阳离子开环聚合(CROP)得到双键封端的聚(2-甲基-2-唑啉)(PMOXA-MA)。然后通过GMA与PMOXA-MA的自由基无规共聚,得到梳状的PMOXA-r-GMA(简称PMG)。通过氢的核磁共振谱(1H-NMR)得到PMOXA的聚合度为24 (数均相对分子质量为2 140(含端基)),理论链长为9.09 nm, PMG中PMOXA-MA与GMA的摩尔比为1.00∶1.78。
以AIBN为引发剂、十二烷基三硫代碳酸酯为链转移剂、AA为单体、DMF为溶剂,通过RAFT聚合合成出聚合度(由1H-NMR得到)分别为21、48和81的PAA(对应的数均相对分子质量分别为1 512、3 456和5 832),相应的理论链长分别为5.28、12.07和20.37 nm。然后以不同链长的PAA为链转移剂,分别与GMA通过RAFT聚合合成PAA-b-PGMA(简称PAG)。根据PAG中PAA的聚合度,将PAG分别命名为PAG21、PAG48和PAG81,通过1H-NMR得到相应的PAG的数均相对分子质量分别为1 963、3 918和6 290。
1.4 涂层毛细管的制备及其表面组成
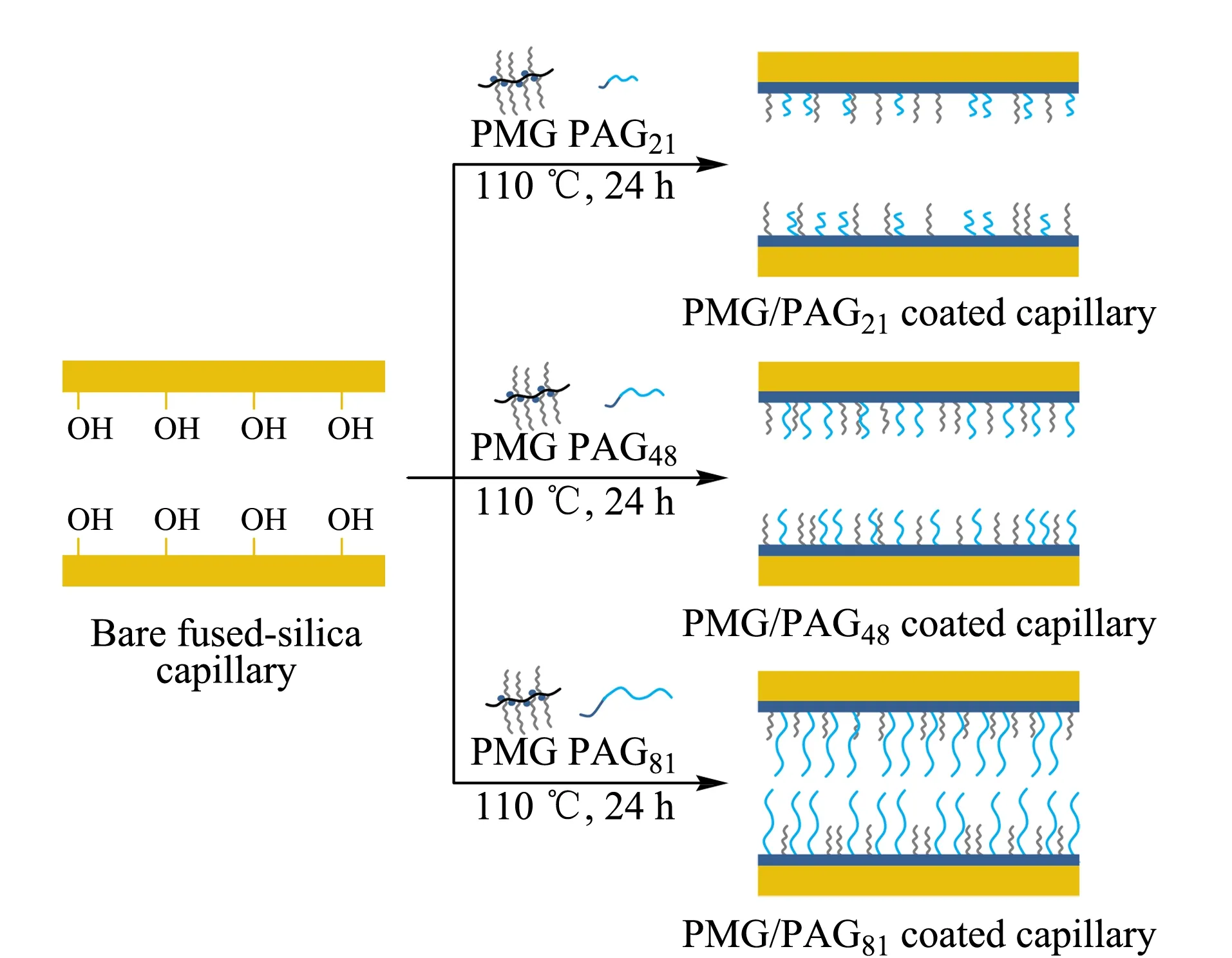
图 1 PMG/PAG涂层毛细管的制备过程Fig. 1 Preparation of PMG/PAG coated capillary
采用一步加热法利用毛细管内壁硅羟基与GMA中环氧基团之间的化学反应,将PMG和PAG共价键合在毛细管内壁,制备PMG/PAG涂层毛细管,具体制备过程如图1所示。首先对毛细管进行前处理,即用1 mol/L的盐酸溶液冲洗毛细管15 min,去离子水冲洗5 min,再用1 mol/L氢氧化钠溶液冲洗毛细管15 min,去离子水冲洗5 min,空气吹干。将PMG和PAG以1∶1(质量比)溶解在水中制备质量浓度为20 g/L的涂层液,之后将涂层液注入经过前处理的毛细管中,用硅橡胶密封毛细管两端,于110 ℃条件下反应24 h。反应结束后用去离子水冲洗毛细管,空气吹干,得到PMG/PAG涂层管。根据涂层液中PAA的聚合度,将PMG/PAG涂层毛细管分别命名为PMG/PAG21涂层毛细管、PMG/PAG48涂层毛细管和PMG/PAG81涂层毛细管。为了与PMG/PAG涂层毛细管比较,用同样的方法分别制备了PMG涂层毛细管和PAG涂层毛细管,即将质量浓度为20 g/L的PMG或PAG涂层液分别注入经过前处理的毛细管中,毛细管两端密封后于110 ℃下反应24 h,最后用去离子水冲洗以除去残余溶液,空气吹干,得到PMG涂层毛细管或PAG涂层毛细管。根据涂层液中PAA的聚合度,将PAG涂层毛细管分别命名为PAG21涂层毛细管、PAG48涂层毛细管和PAG81涂层毛细管。
为了便于用X射线光电子能谱(XPS)分析毛细管涂层的表面组成,用上述同样的过程对毛细管原材料进行了修饰。
1.5 毛细管电渗流(EOF)和ζ电势的测定
根据Williams和Vigh[29]提出的方法,在温度为25 ℃、波长为214 nm的条件下,以苯甲醇为标记物(0.2 g/L),分别测量裸管及聚合物涂层毛细管在pH 7和pH 3条件下的EOF值(μeof)(公式(1)~(3)[29])。
(1)
Leo=[(tN3-tN2)-(tN2-tN1)]νm
(2)
(3)
其中,Lt、Ld分别为毛细管的总长度和有效长度,tN1、tN2、tN3分别为苯甲醇先后3个峰的迁移时间,Vprog为实验电压,tinj和td分别为进样时间和滞后时间(仪器一般设定为1 s),tmigr为电泳时间(1 min),tramp-up为仪器设定值(0.17 min),tramp-down数值非常小,忽略不计。
毛细管内表面的ζ电势通过公式(4)[30]得到。
(4)
其中,ε0是真空介电常数(8.85×10-12F/m),η是水的黏度(0.89 mPa·s),εr是水的介电常数(78.36 F/m)。
1.6 异硫氰酸荧光素标记溶菌酶(FITC-溶菌酶)吸附/脱附实验
为了更直观地研究溶菌酶在毛细管中的吸附/脱附行为,我们在25 ℃下做了FITC-溶菌酶在毛细管中的吸附/脱附实验,具体过程如下:首先用pH 7磷酸盐缓冲液润洗裸管和涂层毛细管30 min,之后向毛细管中注入FITC-溶菌酶(1 g/L,磷酸盐缓冲液,pH 7) 50 min,然后用pH 7磷酸盐缓冲液冲洗毛细管10 min以除去未吸附的蛋白质,空气吹干后截取一段毛细管。剩余的毛细管用pH 3磷酸盐缓冲液冲洗30 min,空气吹干后再截取一段毛细管。最后使用单面刀片将截取的两段毛细管的外涂层(约5 mm长)刮除干净,置于Olympus BX81光学显微镜下拍摄。用Image J软件测量拍摄照片的荧光强度。
1.7 毛细管电泳在线富集溶菌酶
毛细管电泳实验均在温度为25 ℃、检测波长为214 nm的条件下进行。将溶菌酶溶于pH 7磷酸盐缓冲液中配制质量浓度为0.5 g/L的溶菌酶储备液,用pH 7磷酸盐缓冲液稀释储备液得到相应浓度的溶菌酶溶液。毛细管电泳在线富集溶菌酶过程如下:首先用pH 7磷酸盐缓冲液冲洗裸管或涂层毛细管5 min,在20 kV电压下预电泳2 min,随后于3.45 kPa压力下注入溶菌酶溶液5 s,之后用pH 7磷酸盐缓冲液冲洗1 min,然后向毛细管中于3.45 kPa压力下注入pH 3磷酸盐缓冲液5 s,最后施加20 kV电压进行分离。同时,用普通电泳法检测溶菌酶作为对照:用pH 3磷酸盐缓冲液润洗裸管5 min,在20 kV电压下预电泳2 min,之后于3.45 kPa压力下注入溶菌酶溶液5 s,最后施加20 kV电压进行分离。使用32 Karat软件(美国Beckman公司)采集在线富集法和普通电泳法的谱图数据,并分别对两种方法得到的溶菌酶信号峰进行积分计算,从而得到各自的峰面积,然后根据公式(5)[31]得到在线富集法的溶菌酶信号检测灵敏度增强因子(SEF)。
(5)
其中,A1为用涂层毛细管或裸管通过在线富集法得到的峰面积,A0为用裸管通过普通电泳法得到的峰面积,n为稀释因子(实验中使用的是同一浓度的溶菌酶溶液,因此n为1)。
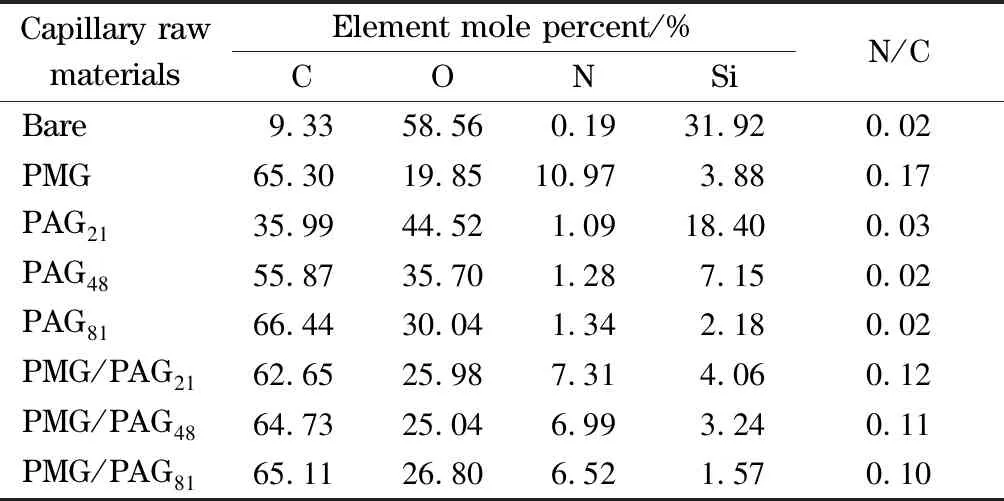
表 1 未修饰的毛细管原材料和涂层毛细管原材料的表面元素组成
2 结果与讨论
2.1 毛细管涂层的表征
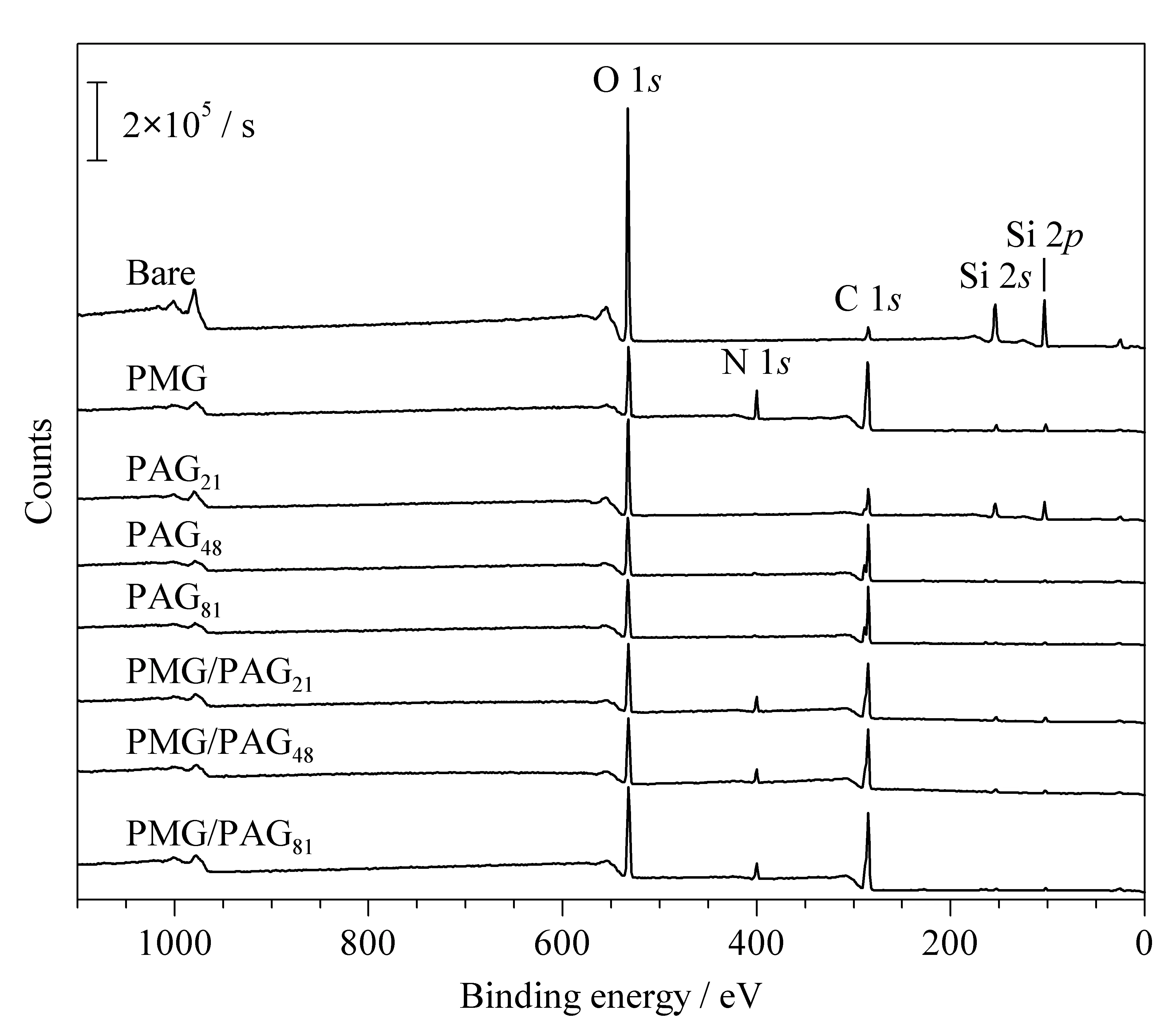
图 2 未修饰的毛细管原材料和涂层毛细管原材料的XPS谱图Fig. 2 XPS spectra of wide scan for bare and coated capillary raw materials
为便于分析涂层的表面组成,我们通过一步加热法制备了PMG、PAG和PMG/PAG涂层毛细管原材料,图2是未修饰的毛细管原材料和各涂层毛细管原材料的XPS谱图,相应的表面元素组成见表1。结合能为532、400、285和103 eV的信号峰分别对应O 1s、N 1s、C 1s和Si 2p,未修饰的毛细管原材料Si元素含量为31.92%,经过PMG修饰后Si元素含量显著降低(3.88%),同时C和N元素含量显著增加,N与C元素的摩尔比(N/C)由0.02增加至0.17,表明PMG成功地接枝在毛细管原材料表面。与未修饰的毛细管原材料相比,PAG涂层毛细管原材料表面Si信号减弱,而C信号增强,表明PAG成功地接枝在毛细管原材料表面,其中少量的N信号可能是实验过程中污染所致。毛细管原材料经PMG/PAG修饰后,Si和O元素含量减少,N和C元素含量增加,同时N/C(0.10~0.12)在PMG涂层毛细管原材料(0.17)与PAG涂层毛细管原材料(0.02~0.03)之间,表明PMG和PAG同时接枝在毛细管原材料表面。与PMG涂层毛细管原材料和PAG涂层毛细管原材料相比,PMG/PAG涂层毛细管原材料的Si信号减弱,表明PMG/PAG接枝效果更好,结果与文献[28]一致。随着PAA的理论链长由5.28 nm增加至20.37 nm, PMG/PAG涂层中N/C由0.12下降至0.10,这是PMG/PAG涂层中羧基含量增加所致。
为进一步对毛细管涂层进行表征,我们测定了裸管和各涂层毛细管分别在pH 3和pH 7条件下的EOF。裸管在pH 3和pH 7条件下的EOF值分别为3.3×10-9m2/(V·s)和4.6×10-8m2/(V·s),即EOF值随着pH值的增加而增加,说明随着pH值的增加,熔融硅毛细管内壁的硅羟基解离度增加,使EOF表现出强烈的pH值依赖性。与裸管相比,PMG涂层毛细管在pH 3和pH 7条件下EOF值分别下降至3.4×10-10m2/(V·s)和2.5×10-8m2/(V·s),表明电渗流得到了抑制,证明中性聚合物PMG成功地接枝在毛细管内表面。和裸管相比,PAG涂层毛细管在pH 3时EOF值降低,而且随PAA链长的增加而下降(PAG21、PAG48和PAG81涂层毛细管的EOF值分别为1.2×10-9m2/(V·s)、1.0×10-9m2/(V·s)和6.5×10-10m2/(V·s));在pH 7时EOF值增加,而且随PAA链长的增加而增加(PAG21、PAG48和PAG81涂层毛细管的EOF值分别为5.2×10-8m2/(V·s)、5.8×10-8m2/(V·s)和6.0×10-8m2/(V·s));上述结果说明随着pH值的增加,PAG涂层毛细管中PAA羧基的解离度增加,EOF值增大,而且随着PAA链长的增加,EOF值的变化更大,进一步表明PAG成功地接枝在毛细管内表面。PMG/PAG涂层毛细管在pH 3条件下EOF值明显小于裸管的EOF值(PMG/PAG21、PMG/PAG48、PMG/PAG81涂层毛细管分别为4.8×10-10m2/(V·s)、4.1×10-10m2/(V·s)和3.1×10-10m2/(V·s)),在pH 7条件下EOF值处于PMG涂层毛细管和PAG涂层毛细管之间(PMG/PAG21、PMG/PAG48、PMG/PAG81涂层毛细管分别为3.5×10-8m2/(V·s)、3.9×10-8m2/(V·s)和4.4×10-8m2/(V·s)),表明毛细管内表面同时存在PMG和PAG。
以上结果表明通过一步加热法在毛细管原材料和毛细管内表面可成功制备PMG、PAG和PMG/PAG涂层。与我们之前通过PDA制备PMOXA/PAA混合刷涂层毛细管的三步法[15]相比,该方法只需一步,同时制备时间由之前的35 h缩短为24 h,制备方法省时且简单易行。
2.2 毛细管的ζ电势
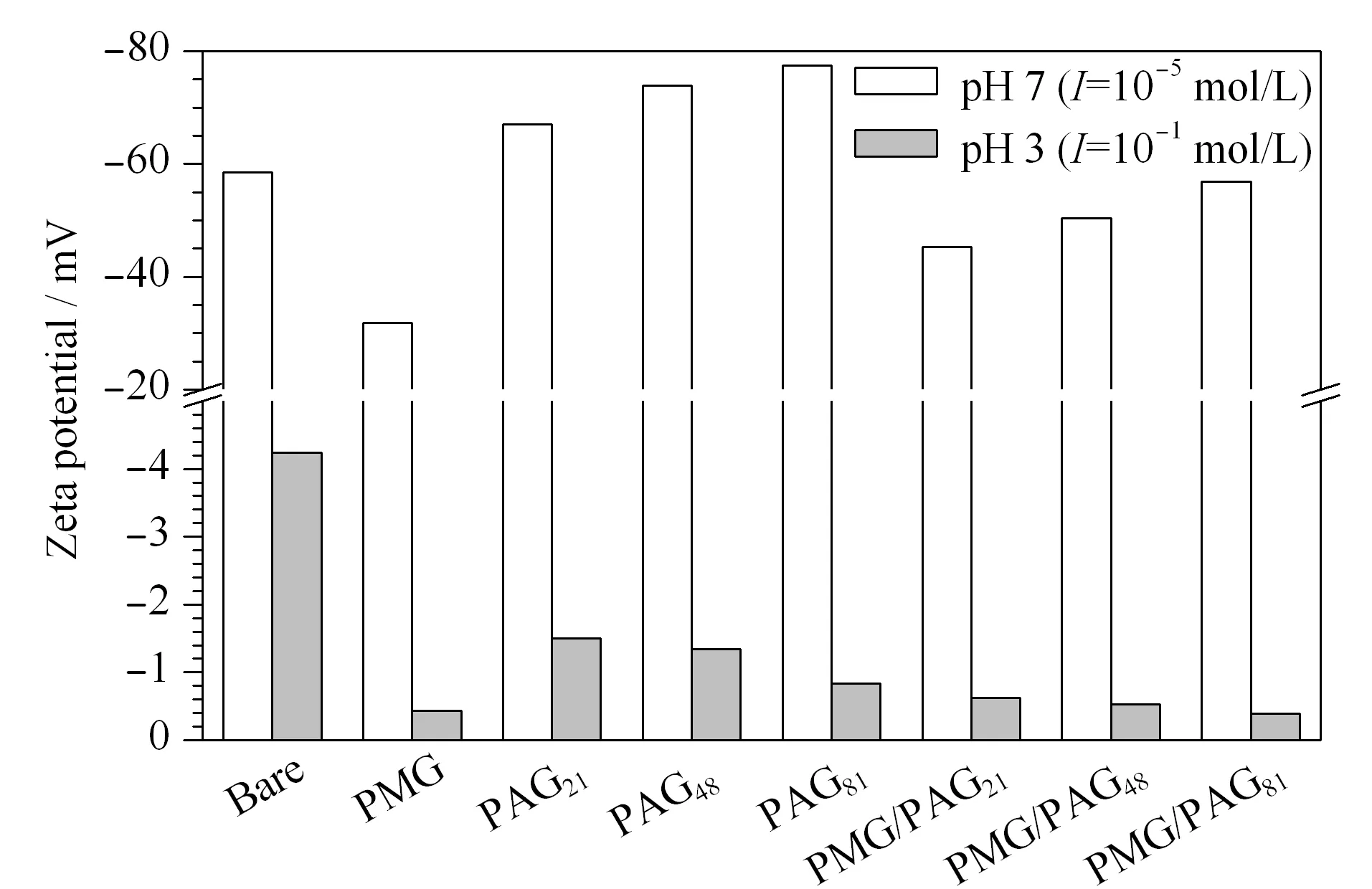
图 3 裸管和涂层毛细管在pH 7和pH 3条件下的ζ电势Fig. 3 Zeta potential values of bare and coated capillaries at pH 7 and pH 3
裸管和聚合物涂层毛细管在pH 7 (I=10-5mol/L)和pH 3 (I=10-1mol/L)条件下的ζ电势见图3。由图3可知,裸管在pH 7和pH 3条件下ζ电势均为负值且前者ζ电势的绝对值更大,表明在两种条件下裸管内表面均带负电荷,而且裸管内壁上硅羟基的解离程度随着pH值的增加而增大,所带电荷量随之增加。PMG涂层毛细管在pH 3条件下几乎不带电荷,然而在pH 7条件下表面带负电荷,这可能是溶液中氢氧根离子吸附在PMOXA聚合物链上所致[32]。PAG涂层毛细管在pH 7条件下ζ电势的绝对值明显高于pH 3下ζ电势的绝对值,这是由于随着pH值的增加,PAA中羧基的解离程度增大,导致所带负电荷量增加;同时,在pH 7下,随着PAA链长增加,PAG涂层毛细管内表面羧基含量增加,所带负电荷增多,ζ电势的绝对值增大。PMG/PAG涂层毛细管与PAG涂层毛细管具有相同的规律,即ζ电势的绝对值随着pH值的增加以及PAA链长的增加而增大;此外,在pH 7条件下,PMG/PAG涂层毛细管所带负电荷比相同PAA链长的PAG涂层毛细管少,这是由于PMG的部分屏蔽所致。由此可见,PMG/PAG涂层毛细管内壁所带电荷量可通过环境的pH和I进行调节,这为调控毛细管与蛋白质之间吸附作用的强弱提供了可能。
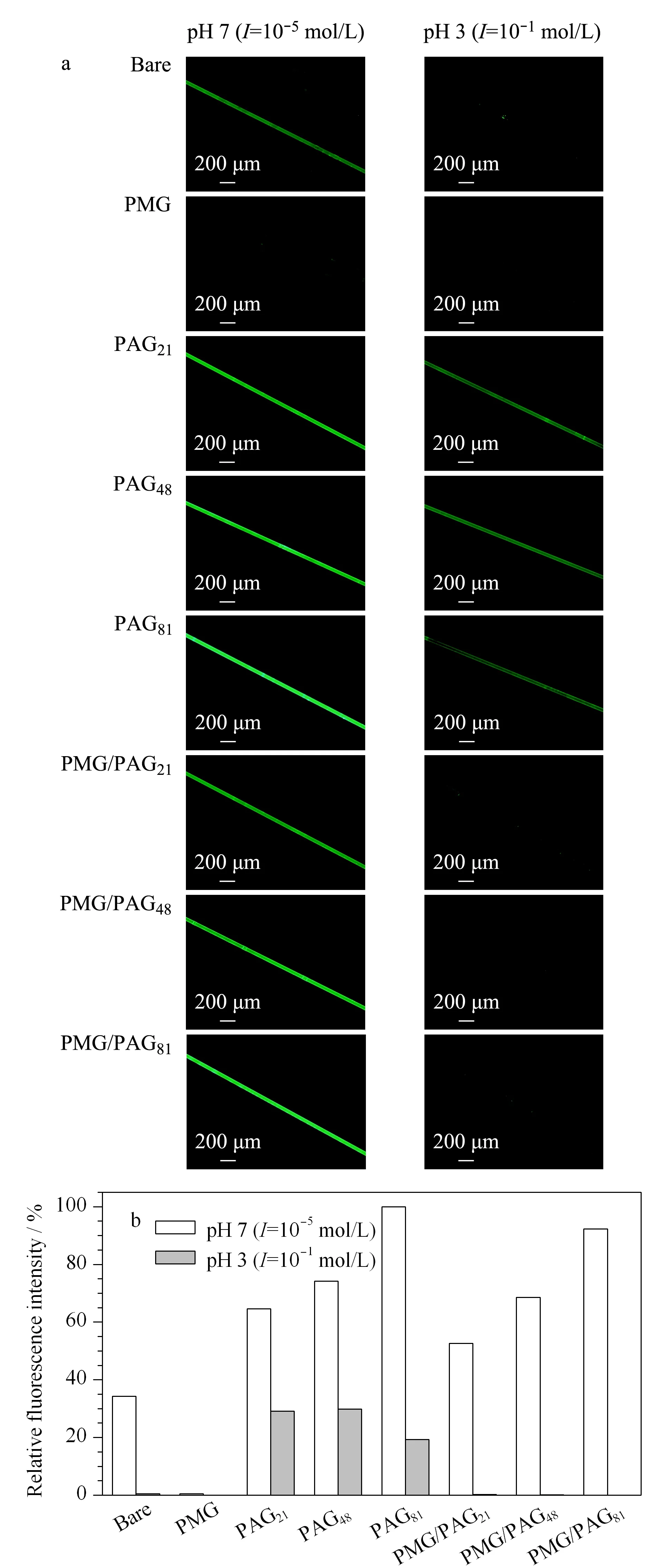
图 4 (a)裸管和涂层毛细管在pH 7和pH 3条件下吸附FITC-溶菌酶的荧光照片与(b)相应荧光照片的相对荧光强度 Fig. 4 (a) Fluorescence images of fluorescein isothio-cyanate-labeled lysozyme (FITC-lysozyme) adsorbed on bare and coated capillaries at pH 7 and pH 3 and (b) relative fluorescence intensities of above images Relative fluorescence intensity: intensity of FITC-lysozyme adsorbed on PAG81 coated capillary at pH 7 normalized to 100%.
2.3 毛细管对溶菌酶的可控吸附
PAG和PMG/PAG涂层毛细管的ζ电势随着环境pH和I的改变而发生变化,意味着涂层与带电大分子如蛋白质之间的相互作用也会随pH和I的改变而发生变化。图4是裸管和各涂层毛细管分别在pH 7 (I=10-5mol/L)和pH 3 (I=10-1mol/L)条件下吸附FITC-溶菌酶的荧光照片和相对荧光强度(将PAG81涂层毛细管在pH 7条件下吸附FITC-溶菌酶的相对荧光强度定为100%),相对荧光强度越大表明毛细管对FITC-溶菌酶的吸附量越多。裸管在pH 7条件下呈现较强的荧光,然而当条件变为pH 3时荧光强度下降,表明在pH 7时裸管内壁带有负电荷,可通过静电吸引作用吸附带正电荷的溶菌酶;当条件变为pH 3时,裸管内壁所带负电荷减少,与溶菌酶的静电吸引作用下降,先前吸附的溶菌酶得以释放。值得注意的是,在所有毛细管中只有PMG涂层毛细管在两种条件下荧光强度都非常小,表明PMOXA可以阻抗蛋白质的吸附[33,34]。PAG涂层毛细管在pH 7条件下呈现很强的荧光,而且随着PAA理论链长由5.28 nm(PAG21涂层毛细管)增加至20.37 nm(PAG81涂层毛细管),相对荧光强度由64.62%提高至100%;在pH 3条件下,PAG涂层毛细管的荧光较弱,PAG21、PAG48和PAG81涂层毛细管的相对荧光强度分别为29.11%、29.83%和19.30%,表明在pH 7下,PAG涂层毛细管可以吸附大量的溶菌酶,当条件变为pH 3时,PAG涂层毛细管释放出部分溶菌酶,即通过改变pH和I可以实现PAG涂层毛细管对溶菌酶的吸附/释放。在pH 7条件下,PAA链中羧基发生解离而带负电荷,PAA链由于链内和链间的静电排斥而呈现伸展的状态,可通过静电吸引作用吸附大量的溶菌酶,而且静电吸引作用随着PAA链中羧基含量的增加而增强,因此PAG81涂层毛细管吸附的溶菌酶最多;在pH 3时,PAA链几乎不带电荷,链间静电斥力大大减弱,在盐效应的共同作用下PAA链呈塌缩的状态[35,36],导致PAA链与溶菌酶之间的静电吸引作用降低,从而将之前吸附的溶菌酶释放出来。
对于PMG/PAG涂层毛细管,在pH 7时呈现较强的荧光,而且随着PAA理论链长由5.28 nm(PMG/PAG21涂层毛细管)增加至20.37 nm(PMG/PAG81涂层毛细管),相对荧光强度由52.67%提高至92.31%,表明PMG/PAG涂层毛细管可吸附大量的溶菌酶,而且吸附量随着PAA链长的增加而提高。在此条件下,PAA链带负电荷且呈伸展的状态。当PAA的链长(5.28 nm)小于PMOXA的链长(9.09 nm)时,PMOXA链暴露在最外层,阻碍了带负电荷的PAA链与带正电荷的溶菌酶之间的相互作用,同时PAA链羧基含量较少,因此在PMG/PAG涂层毛细管中PMG/PAG21涂层毛细管对溶菌酶的吸附量最小;当PAA的链长(12.07 nm和20.37 nm)大于PMOXA的链长(9.09 nm)时,PAA链暴露于最外层,容易与溶液中的溶菌酶接触,溶菌酶可通过静电吸引作用吸附在PAA链上,而且吸附量随着PAA链羧基含量的增加而提高,因此在PMG/PAG涂层毛细管中PMG/PAG81涂层毛细管(PAA链长是PMOXA链长的2.2倍)对溶菌酶的吸附量最大。当条件变为pH 3时,PMG/PAG涂层毛细管相对荧光强度显著下降,相对荧光强度下降率接近100%(相对荧光强度下降率:当pH 7变为pH 3时同一毛细管吸附FITC-溶菌酶相对荧光强度的下降量与在pH 7时相对荧光强度的百分比),高于相应的PAG涂层毛细管(PAG21、PAG48和PAG81涂层毛细管相对荧光强度下降率分别为54.95%、59.82%、80.70%),表明PMG/PAG涂层毛细管将之前吸附的溶菌酶脱附下来,而且脱附率高于相应的PAG涂层毛细管。在pH 3时,PAA链几乎不带电荷而且呈塌缩的状态,之前吸附的溶菌酶得以释放;同时,PMOXA链暴露在最外层以阻抗溶菌酶进一步吸附[23,28],因此,在PAG与PMG的协同作用下,PMG/PAG涂层毛细管的蛋白质脱附率与相应的PAG涂层毛细管相比得到提高。以上结果表明,虽然裸管、PAG涂层毛细管和PMG/PAG涂层毛细管均可通过改变环境的pH和I吸附和脱附溶菌酶,但是只有PMG/PAG混合涂层毛细管在一定条件下可达到对溶菌酶的可逆吸附,且PAA链长是PMOXA链长的2.2倍时(即PMG/PAG81涂层毛细管)对溶菌酶的可控吸附性能最佳。

表 2 裸管和涂层毛细管在线富集法检测溶菌酶的SEF值
2.4 毛细管电泳在线富集溶菌酶
上述研究表明PMG/PAG涂层毛细管对溶菌酶的可控吸附可以通过环境pH及I的变化而实现。将PMG/PAG涂层毛细管应用于毛细管电泳在线富集溶菌酶,其在线富集溶菌酶的过程如下:首先用pH 7磷酸盐缓冲液润洗PMG/PAG涂层毛细管,此时PAA链中羧基发生解离而带负电荷,PAA链内和链间产生静电排斥,导致PAA链处于伸展状态;随后向毛细管中注入溶菌酶溶液,带正电荷的溶菌酶通过静电吸引作用吸附在带负电荷的PAA链上;之后注入pH 3磷酸盐缓冲液,PAA链中羧基解离程度显著下降,PAA链几乎不带电荷而且呈塌缩构象,导致溶菌酶与PAA链之间的静电吸引作用下降,溶菌酶从管壁上脱附下来,同时暴露在最外层的PMOXA链可以阻抗溶菌酶进一步吸附;最后施加电压,脱附的溶菌酶快速迁移至检测器,整个过程可以提高溶菌酶的瞬时浓度,因此检测信号得以放大。图5为裸管和涂层毛细管分别在普通电泳法及在线富集法下检测溶菌酶的电泳图,相应的SEF值见表2。

图 5 不同毛细管检测溶菌酶的电泳图Fig. 5 Electropherograms of lysozyme detection using different capillaries
裸管的SEF值为7.11,表明使用裸管通过在线富集法可以富集溶菌酶,增强溶菌酶信号检测灵敏度。在pH 7条件下裸管内壁带有负电荷(由图3可知),带正电荷的溶菌酶通过静电吸引作用吸附在裸管内壁上,注入pH 3磷酸盐缓冲液后,溶菌酶与裸管内壁之间的静电吸引作用由于裸管内壁所带负电荷的减少而降低,溶菌酶从裸管内壁上脱附下来(由图4可知),最后施加电压,脱附的溶菌酶迁移至检测窗口,整个过程可以提高溶菌酶的瞬时浓度。由表2可知,在PAG涂层毛细管中随着PAA理论链长由5.28 nm(PAG21涂层毛细管)增加至20.37 nm(PAG81涂层毛细管), SEF值由7.47提高至12.62,这是由于随着PAA链长的增加,涂层中羧基含量增大,PAG涂层毛细管对溶菌酶的可控吸附性能提高,因此可以富集更多的溶菌酶。PMG/PAG涂层毛细管与PAG涂层毛细管具有相同的规律,即PMG/PAG涂层毛细管的SEF值随着PAA理论链长的增加而提高。值得注意的是,在PAA理论链长相同的情况下,PMG/PAG涂层毛细管的SEF值高于PAG涂层毛细管的SEF值。PMG/PAG涂层结合了PMOXA的抗蛋白质吸附性能和PAA的刺激响应性,与PAG涂层毛细管相比,PMG/PAG涂层毛细管可进一步增加溶菌酶的瞬时浓度,提高在线富集效果。总之,使用裸管、PAG涂层毛细管和PMG/PAG涂层毛细管通过在线富集法可有效富集溶菌酶,增强溶菌酶信号检测灵敏度,其中,PMG/PAG81涂层毛细管(PAA链长为PMOXA链长2.2倍)的SEF值最大,说明该涂层毛细管具有最佳的在线富集效果,其检测信号强度是普通电泳法检测信号的17.69倍。
2.5 方法学评价
使用PMG/PAG81涂层毛细管通过在线富集法检测溶菌酶,以溶菌酶的质量浓度为横坐标、峰面积为纵坐标进行线性拟合。结果表明,溶菌酶的电泳峰面积与质量浓度在3.0×10-4~7.5×10-3g/L范围内呈线性关系,相关系数(r2)为0.999 0。通过3倍信噪比(S/N)得到溶菌酶的检出限(LOD)为8.7×10-5g/L。
为考察在线富集法的精密度,用同一根PMG/PAG81涂层毛细管在同一天内对溶菌酶连续测定5次以及连续测定5天。峰面积的日内、日间相对标准偏差(RSD)分别为2.9%和4.1%,迁移时间的日内、日间RSD分别为0.9%和2.1%,表明该方法的重复性和毛细管涂层的稳定性良好。涂层的稳定性归因于聚合物与毛细管内壁之间形成了稳定的共价键,即在加热的条件下,PMG和PAG中环氧基团与毛细管内壁上的硅羟基发生化学反应,将PMG和PAG共价键合在毛细管内壁,形成了牢固的涂层,同时GMA间的自交联反应进一步加强了涂层的稳定性。因此,与非共价键涂层[37]相比,该涂层更加稳定不易脱落,同时与其他共价键合涂层相比,该涂层的制备过程简单,只需要一步即可制得。
3 结论
本文通过一步加热法利用GMA中环氧基团与毛细管内壁硅羟基之间的化学反应,将PMOXA-r-GMA和PAA-b-PGMA共价键合在毛细管内壁,制备出基于PMOXA和PAA的混合刷涂层毛细管。该涂层结合了PMOXA的抗蛋白质吸附性能和PAA的刺激响应性,通过改变环境的pH和I可对溶菌酶的吸附和脱附实现调控,从而用于毛细管电泳在线富集溶菌酶。当PAA链长是PMOXA链长2.2倍时,混合刷涂层毛细管具有最佳的在线富集效果,其检测信号强度是普通电泳法检测信号的17.69倍,LOD为8.7×10-5g/L。该研究为提高蛋白质的检测灵敏度提供了简单有效的方法。
