毛细管电泳新型手性分离体系研究进展
2020-08-26张琪
张 琪
(江苏大学药学院, 江苏 镇江 212013)
对于化学或生命科学工作者来说,“手性”不会是一个陌生的名词。其实,手性是自然界的基本属性之一,在医药、化工、食品、环境等各领域都能看到手性的身影及其产生的重要影响[1,2]。以医药行业为例,手性药物不同对映异构体之间往往拥有显著不同,甚至完全相反的生物学活性。因此,手性药物的质量控制以及安全用药问题,一直受到各国药政管理部门的高度重视。使用光学纯手性药物是提高药物生物学活性、减少或避免对映体杂质危害的有效途径。近年来,手性药物(尤其是光学纯手性药物)市场规模在现代制药工业中的占比呈现逐年稳定上升的趋势。美国著名市场行业研究咨询机构“大观研究”(grand view research)的一项关于“手性化学制品市场分析”(chiral chemicals market analysis)的调查报告显示,截至2019年,美国及英国的手性药物市场规模分别达到了150亿及50亿美元,并且将以每年约11%的高速度继续保持稳定增长[3]。由此可见,手性药物的分离分析工作将在长时间内在制药工业领域扮演着必不可少的角色。
随着现代分离科学的发展,已经有多种技术手段被成功应用于手性分离。而各类色谱方法,比如薄层色谱(TLC)[4]、高效液相色谱(HPLC)[5,6]、气相色谱(GC)[7]、超临界流体色谱(SFC)[8]、高速逆流色谱(HSCCC)[9,10]等,是目前应用最为广泛的手性分离方法。毛细管电泳(CE)早在1985年便被成功用于手性分离,并在随后的几十年里经历了富有起伏的发展[11-13]。现如今,尽管CE并没有占据医药化工等行业中手性分离工作的主导地位,但不可否认CE技术凭借其高效率和低消耗的优势,已被证明是手性分离研究领域最有发展前景的分析方法之一,并且已成为HPLC等其他经典手性分离方法的一个重要补充应用手段[14-16]。国内外药典中越来越多的手性药物质量标准也采用了CE技术用于光学纯度质量控制。如2015版中国药典(二部)新增品种佐米曲普坦及其制剂,就采用了CE法进行R型异构体的检查[17],美国药典也采用CE法对盐酸罗哌卡因进行光学纯度质量控制[18]。
除了高效率和低消耗两大重要特点之外,分离模式的多样性也是CE技术受到分析工作者青睐的一个重要原因。常见的可用于手性分离的CE模式包括“毛细管区带电泳(CZE)”“毛细管电动色谱(EKC)”“胶束电动色谱(MEKC)”“非水毛细管电泳(NACE)”“配体交换毛细管电泳(LECE)”“毛细管电色谱(CEC)”等。而近年来,在CE手性分离工作中,研究人员基于此类电泳模式不断地对传统手性分离体系进行优化和改造,构建出许多新型、高效的手性化合物分离体系,如离子液体(ionic liquid)修饰、纳米材料修饰、金属有机骨架材料(MOF)修饰、低共熔溶剂修饰的手性分离体系等等。本综述将重点对近年来此类新型CE手性分离体系的发展现状进行梳理,并结合相应的手性识别机理研究和手性CE方法实际应用情况,对该领域存在的问题及发展前景进行分析和展望。
1 新型手性分离体系的构建
1.1 基于离子液体的CE手性分离体系
离子液体是指在室温或接近室温条件下呈液态的,且完全由阴阳离子组合而成的熔融盐体系。与传统有机溶剂和电解质相比,离子液体具有低蒸汽压、高热稳定性、高化学稳定性等一系列突出优点。通过阴阳离子的组合设计,研究人员还可以得到具有特定用途的功能化离子液体,因而离子液体也被人们称为“可设计合成的溶剂”。离子液体在手性分离领域的应用也已经得到了广泛关注。在2015~2019年的文献[19-21]报道中,以手性离子液体作为识别物质的CE手性分离体系的占比仅次于环糊精及其衍生物类手性选择剂(见图1)。

图 1 2015~2019年各类手性选择剂在CE中的应用比例(不完全统计)Fig. 1 Proportion of application of the various chiral selectors in CE in 2015-2019 year (incomplete statistics) CEC was not covered. Data were searched from Web of Science.
目前可查阅到最早的关于离子液体在CE手性分离中的文献出现在2003年,Mwongela等[22]报道了在以聚油酸-L-亮氨酰缬氨酸钠盐为手性表面活性剂的MEKC体系中,3种烷基咪唑及烷基吡啶类非手性离子液体作为修饰剂均能显著改善一系列联萘化合物对映体的分离效果。随后,Rizvi等[23]首次使用了吡咯烷醇类和亮氨醇类手性离子液体型表面活性剂直接构建MEKC体系,成功分离了对溴苯乙酸以及2-(2-氯苯氧基)丙酸两个酸性化合物。此类应用模式可以概括为基于离子液体的手性MEKC分离体系。
第二种出现较早的应用模式为非手性离子液体修饰的CZE或EKC手性分离体系。研究人员将短链的烷基咪唑、烷基吡啶、四烷基铵盐类非手性离子液体添加到以β-环糊精(β-CD)为手性选择剂的CE体系中,发现离子液体可以通过改变电渗流、改变运行缓冲液离子强度、抑制样品在管壁内的吸附、竞争性地影响样品与β-CD疏水空腔的包合作用等机制来改善对映体的分离[24-26]。然而非手性离子液体的“非手性”特征注定了它们在绝大多数情况下无法直接参与到手性识别过程中,导致拆分体系的对映选择性(enantioselectivity)不能得到显著改善。因此,此类应用模式逐渐被第三种模式所取代,也就是手性离子液体协同拆分体系。
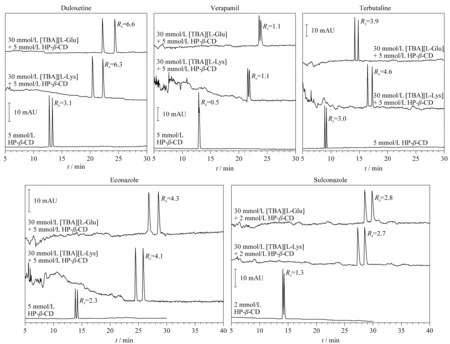
图 2 羟丙基β-CD(HP-β-CD)与氨基酸手性离子液体构建的协同拆分体系与单一HP-β-CD体系对5个手性药物的电泳图[28]Fig. 2 Electropherograms corresponding to the enantioseparation of five chiral drugs using hydroxypropyl-β-cyclodextrin (HP-β-CD)/amino acids chiral ionic liquids synergistic separation systems or single HP-β-CD system[28]
手性离子液体是指在离子液体结构中引入手性中心,这是离子液体功能化研究的一个重要方面。研究人员发现,手性离子液体不仅能够保留非手性离子液体对拆分体系的修饰能力,还因手性部分的引入使其本身具备额外的手性识别能力,当它们与传统手性选择剂配伍使用时,往往可以通过协同作用很大程度地改善手性分离结果。此类分离模式构建过程简便,性能优越,近年来已有多篇文献[27-33]报道,其中应用最多的是氨基酸类或乳酸类手性离子液体与环糊精及其衍生物、多糖、抗生素类手性选择剂配伍的协同体系,用于各类手性化合物的分离(见图2),涉及的电泳模式主要为EKC或NACE。然而目前此类拆分体系的一个普遍缺陷是对手性识别机理,尤其是手性离子液体为何能够大幅改善分离体系手性识别能力机制的阐述还不够充分和明确。使用基于色谱或CE的热力动力学方法来研究此类分离体系的手性识别机理具有一定的潜力,但是目前为止还没有很多确证信息。对于这种三元(手性选择剂+手性离子液体+对映体)甚至多元体系识别机制的探索仍然是一项充满挑战的任务。
第四种基于离子液体的手性识别模式是以氨基酸或氨基醇类手性离子液体为配体构建LECE分离体系[34]。其中氨基酸在离子液体结构中可作为阳离子部分也可作为阴离子部分,具体包括1-烷基-3-甲基咪唑-L-脯氨酸盐[35]、1-乙基吡啶-L-赖氨酸盐[36]、1-丁基-3-甲基咪唑-L-鸟氨酸盐[37]、1-丁基-3-甲基咪唑-L-丙氨酸盐[38]、L-脯氨酸三氟乙酸盐[39]、L-苯丙氨酰胺三氟乙酸盐[40],以及一系列四烷基铵盐类氨基酸离子液体等[41]。这些离子液体型手性配体绝大多数都能高效地分离氨基酸及其衍生物类手性化合物,并且与传统的游离型氨基酸配体相比,呈现出更好的手性识别作用。
第五种模式是研究人员通过筛选或设计,将手性离子液体作为手性选择剂直接拆分手性化合物。在这些研究工作当中,基于传统手性选择剂结构直接修饰改造成离子液体型手性选择剂是一个值得关注的研究方向,近几年相关的报道数量也显著增多。比如将β-CD改造成6-氧-2-羟丙基三甲铵-β-CD四氟硼酸盐[42]、单-6-去氧-6-(3-甲基咪唑)-β-CD甲苯磺酸盐[43]、单-6-去氧-6-(4-氨基-1,2,4-三唑鎓)-β-CD[44];将羧甲基-β-CD改造成羧甲基-β-CD四甲基铵盐[45];将乳糖酸(lactobionic acid)改造成乳糖酸四甲基铵盐[46]、3-甲基-1-(3-磺丙基)-1-氢-咪唑乳糖酸盐[47];将克林霉素磷酸酯(clindamycin phosphate)改造成克林霉素磷酸酯胆碱盐[48]等。这种传统手性选择剂向离子液体型手性选择剂的进化往往可以通过阴阳离子的协同作用较大程度地改善手性分离性能,比如增加对映选择性、改善手性选择剂亲水性、改善样品吸附、调控运行缓冲溶液离子强度等。
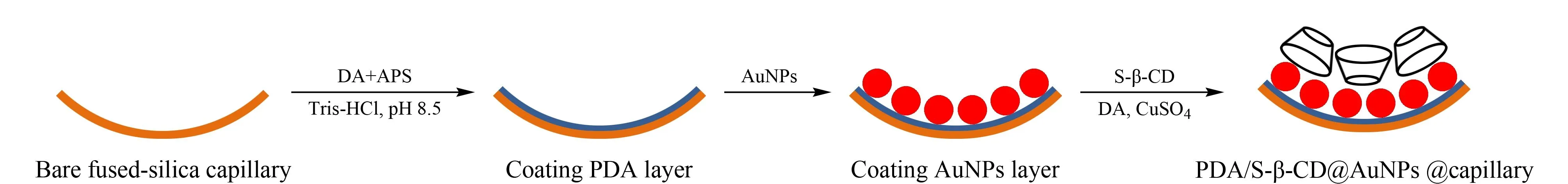
图 3 聚多巴胺/磺化-β-环糊精修饰的金纳米粒涂层开管柱组装示意图[59]Fig. 3 Schematic diagram for the preparation of PDA/S-β-CD@AuNPs coated OT column[59] PDA: polydopamine; S-β-CD: sulfated-β-cyclodextrin; AuNPs: gold nanoparticles; OT: open tubular; DA: dopamine; APS: ammonium persulfate; Tris-HCl: tris(hydroxymethyl)aminomethane-hydrochloric acid buffer.
此外离子液体还有一些较为零散的应用模式,如Wang等[49]报道了一种离子液体介导的非水解溶胶-凝胶法用于制备分子印迹杂化硅胶整体柱,在CEC模式下成功用于佐米曲普坦对映体的分离。离子液体的介入可以显著改善整体柱的多孔性能,从而提高其对映选择性。Stavrou等[50]利用烷基咪唑类离子液体的高助溶性,成功制备了基于纤维素类手性固定相的涂层柱,在开管毛细管电色谱(OT-CEC)模式下成功分离了硫喷妥钠及索他洛尔对映体。
1.2 基于纳米材料的CE手性分离体系
纳米材料一直是分析化学领域的研究热点之一[51-54]。在CE手性分离工作中,研究人员也一直热衷于探索纳米材料的各种应用模式,其中一种是将传统手性选择剂与纳米材料结合。比如Yang等[55]将巯基-β-CD共价键合在金纳米粒上作为手性选择剂,与单一巯基-β-CD相比可以显著改善二硝基苯基氨基酸的分离结果。Liu等[56]将链霉素修饰的金纳米粒作为手性选择剂用于肾上腺素等手性化合物的分离,可以在较低手性选择剂浓度条件下获得较高的分离度,同时还可以抑制链霉素在毛细管内壁的吸附。
纳米材料近年在CE手性分离领域中另一个较为热门的研究方向是与传统手性选择剂有机结合构建CEC分离体系。如Guo等[57]通过层层组装技术,将金纳米粒子键合于预先经(3-巯丙基)三甲氧基硅烷处理的毛细管内壁,再在金纳米层表面修饰巯基-β-CD,成功制备一种新型OT-CEC柱,对美普他酚及其3个中间体表现出较高的对映体选择性。该课题组[58,59]随后又提出两种策略,即在石英毛细管内壁依次修饰聚多巴胺(PDA)-金纳米粒-磺化-β-CD或PDA-金纳米粒-PDA/磺化-β-CD的组装机制(见图3),成功地在OT-CEC模式下,实现了一系列氨基酸、β2受体激动剂等手性分子的分离。此外,在一些最新的文献中,羧甲基-β-CD修饰的Fe3O4磁性纳米粒子[60]、β-CD修饰的Fe3O4磁性纳米粒子以及单-6-去氧-6-(1-甲基咪唑)-β-CD修饰的Fe3O4磁性纳米粒子[61]、胃蛋白酶修饰的介孔硅纳米材料都被成功地用于制备CEC柱[62],均表现出较好的手性分离性能。
1.3 基于MOF材料的CE手性分离体系
MOF材料既不同于无机多孔材料,也不同于常规有机配合物。MOF兼有有机材料的柔性特征和无机材料的刚性,在现代有机化学、分析化学等各领域已经呈现出巨大的发展潜力[63]。目前MOF材料在CE手性分离方向也出现了一定数量的文献报道。如Pan等[64]以ZnO为成核剂,在毛细管内壁原位制备并涂布[Zn(s-nip)2]n型手性MOF材料,在OT-CEC模式下用于肾上腺素等化合物的对映体分离,涂层柱连续使用100次后分离效率无明显衰减,柱与柱之间重现性较好。Sun等[65]将HKUST-1型MOF修饰于毛细管内壁,以羧甲基-β-CD为手性选择剂,在CEC模式下分离了一系列β-受体阻滞剂对映体。相比于无MOF涂层的EKC模式,手性化合物的分离可以得到显著改善。Ding等[66]以聚甲基丙烯酸缩水甘油酯-co-二甲基丙烯酸乙酯整体柱(GMA M-CEC)为载体,利用层层组装机制,将沸石咪唑酯骨架-8 (ZIF-8)型MOF修饰在固定相表面,并进一步将胃蛋白酶作为手性选择剂共价键合在MOF材料上,与缺少MOF材料、直接在整体柱基质上修饰胃蛋白酶相比,氯喹、奈福泮、氨氯地平等一系列手性药物的分离度可以得到较大程度的提高(见图4)。
1.4 其他代表性CE手性分离体系
低共熔溶剂(deep eutectic solvents)是指由一定比例的氢键受体(如季铵盐类)和氢键供体(如酰胺类、羧酸类和多元醇类化合物)配伍而成的两组分或多组分混合物,其凝固点显著低于各个组分纯物质的熔点。与传统的有机溶剂相比,低共熔溶剂具有环保、经济、易制备、生物可降解等优点,近年来在材料、化工、电化学等领域受到了大量关注[67,68]。在最新的文献报道中,出现了以低共熔溶剂作为添加剂用于CE手性分离的报道。Mu等[69]将氯化胆碱分别与尿素、乙二醇、丙二醇、丁二醇配伍获得4种低共熔溶剂,在CZE模式下添加到以β-CD为手性选择剂的分离体系中,可以显著改善佐匹克隆、沙丁胺醇、氨氯地平等药物对映体的分离,证实了低共熔溶剂与手性选择剂之间的协同作用。
非连续分段式部分填充CE技术(plug-plug partial filling CE)是一种较为新颖、灵活的分离模式。与CEC不同,该模式是在部分填充技术的基础上,通过设计,在毛细管内部分段式引入两段(或多段)分离介质,不同介质间互不干扰而又充分发挥自身功能,在CE手性分离中表现出一定的发展潜力[70]。如Chalavi等[71]在毛细管中预先填充两段包含不同手性选择剂(分别为CD和麦芽糊精)的分离介质,形成两段独立的分离介质塞(plugs),每段分离介质塞各司其职,分离各自所适合的手性化合物。与单独使用任意一种手性选择剂的常规CZE体系相比,此模式的对映体识别范围显著扩大。Chalavi等[71]进一步对比了该模式和CD、麦芽糊精二元混合体系的分离效果,发现这种分段式的分离介质可以有效地避免手性选择剂之间相互干扰,对映选择性也相应得到了明显提升。
CE灵活的操作模式使得分析研究人员可以设计并构建新颖、高效的手性分离体系。除上述提到的分离模式之外,还有大量同样优异的CE手性分离体系的文献报道,如多元手性选择剂体系[72,73],基于分子印迹材料的手性分离体系[74,75]、基于超分子自组装的蛋白膜涂布毛细管电色谱[76]、二元手性配体交换毛细管电色谱[77]、基于质量源于设计(quality by design)的手性分离体系[78,79]等,都极大地拓展了CE技术在手性分离领域的应用思路。
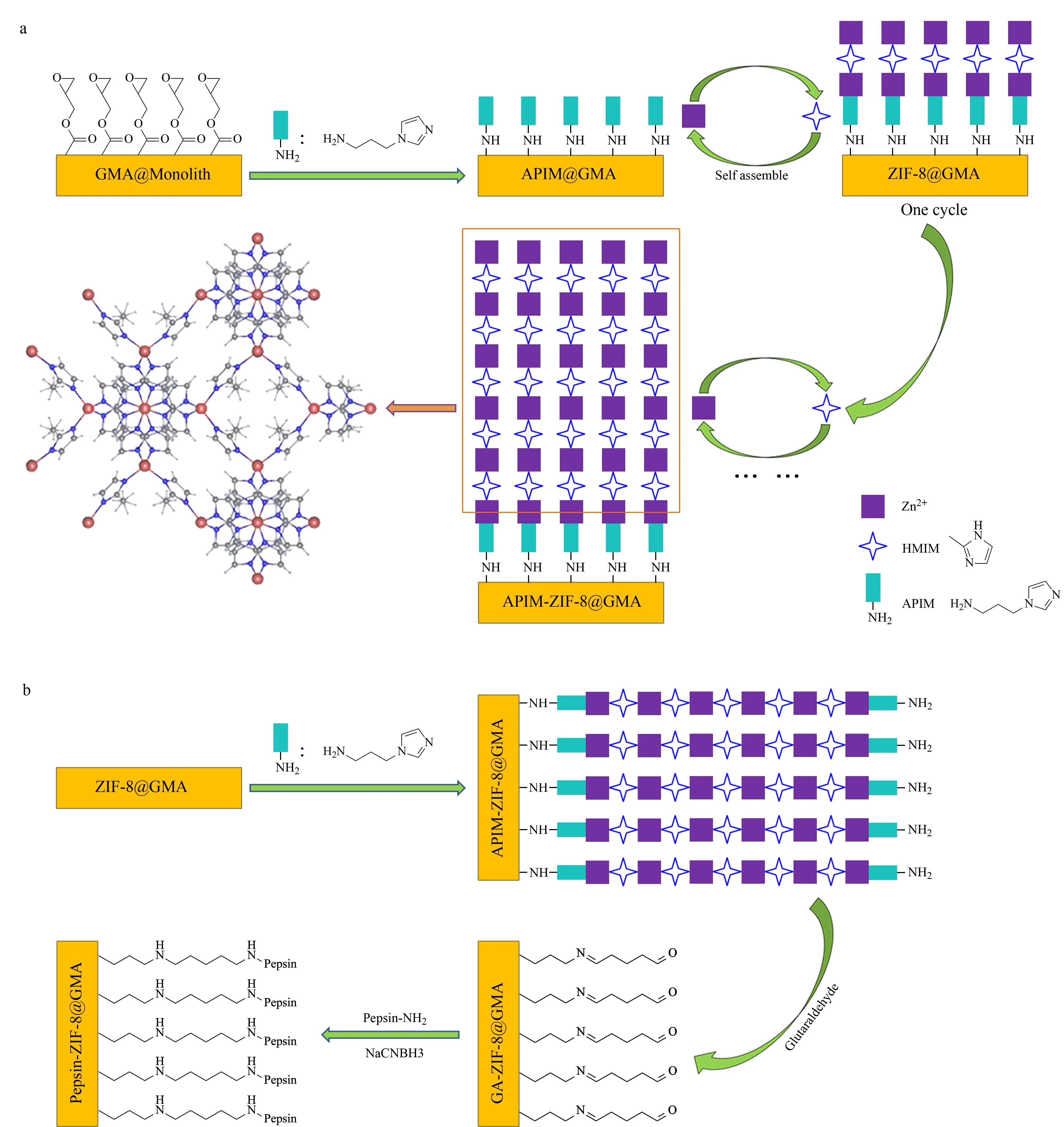
图 4 (a)ZIF-8@GMA整体柱和(b)胃蛋白酶修饰的ZIF-8@GMA整体柱制备示意图[66]Fig. 4 Scheme for the preparation of (a) ZIF-8@GMA monolithic column and (b) pepsin-ZIF-8@GMA monolithic column[66]ZIF-8: zeolitic imidazolate framework-8; GMA: poly(glycidyl methacrylate).
2 手性识别机理
CE手性识别机理,尤其是分子水平手性受体-配体非共价相互作用机制的阐述一直是CE手性分离领域较为薄弱的环节。现代手性识别机理的研究热点已经由传统的基于色谱或电泳法的热力动力学实验模式,向基于现代光谱技术及计算机分子模拟技术的计算模式转变[80,81]。如利用核磁共振的NOESY谱(nuclear overhauser effect spectroscopy)和ROESY谱(rotating-frame overhauser enhancement spectroscopy)可以获得信息量更为丰富的手性受体-配体复合物立体结构信息,尤其是通过质子间核极化效应(NOE)效应来推断手性选择剂官能团与对映体分子间的相互作用机制。Krait等[82]基于核磁共振技术,利用ROESY谱信息研究了美托咪定与一系列天然及阴离子型CD之间的作用模式和包合方式,从分子水平上模拟并解释了不同CD拆分美托咪定表现出不同对映选择性,甚至改变对映体出峰顺序的原因。
计算机分子模拟技术可用于研究CE手性识别过程中受体-配体之间的作用类型、作用位点以及作用强度,并基于结合自由能(ΔG)等评价参数验证或预测手性分离结果。如Sun等[83]利用分子对接技术,研究了乳糖酸四甲基铵盐手性离子液体和克林霉素磷酸酯构建的二元拆分体系的手性识别机制,以结合自由能之差(ΔΔG)为评价参数计算并验证了二元协同拆分体系与单一手性选择剂拆分体系的对映选择性差异,所得到的计算模拟结果与CE手性分离实际结果基本一致。
3 应用
近年来,研究人员依托手性CE技术,以高分离效率、高选择性、高灵敏度、短分析时间为目标,在药物分析、生物分析、食品分析、环境分析、法医分析等领域报道了大量关于实际样品分析应用的文章。从总体上看,EKC是这些实际应用工作的主要CE操作模式。在手性选择剂的选择方面,环糊精衍生物依然占据着绝对的主导地位,其次是多糖和抗生素类手性选择剂。检测器方面,商用紫外检测器(UV)使用比例最高,当面对极低浓度的生物样品、环境样品、法医样品(如毛发)等分析物时,研究人员通常利用前处理富集技术、毛细管在线富集技术等手段提升分析方法的灵敏度。此外,激光诱导荧光检测器(LIF)及CE-MS技术也常用于此类极低浓度样品的分析。如Patel等[84]结合大体积样品堆积技术(LVSS)和CE-LIF检测手段,成功地在单神经元细胞内实现了亚皮克级别(sub-pg)天冬氨酸及谷氨酸对映体的分离及检测(见图5)。
由于篇幅限制,本文将不再一一介绍具体的应用工作,文章的最后笔者罗列了一些近期代表性综述类文章,涉及理论、机理、应用、各类分离模式等各方面,供CE手性分离研究方向的读者参考使用(见表1)。
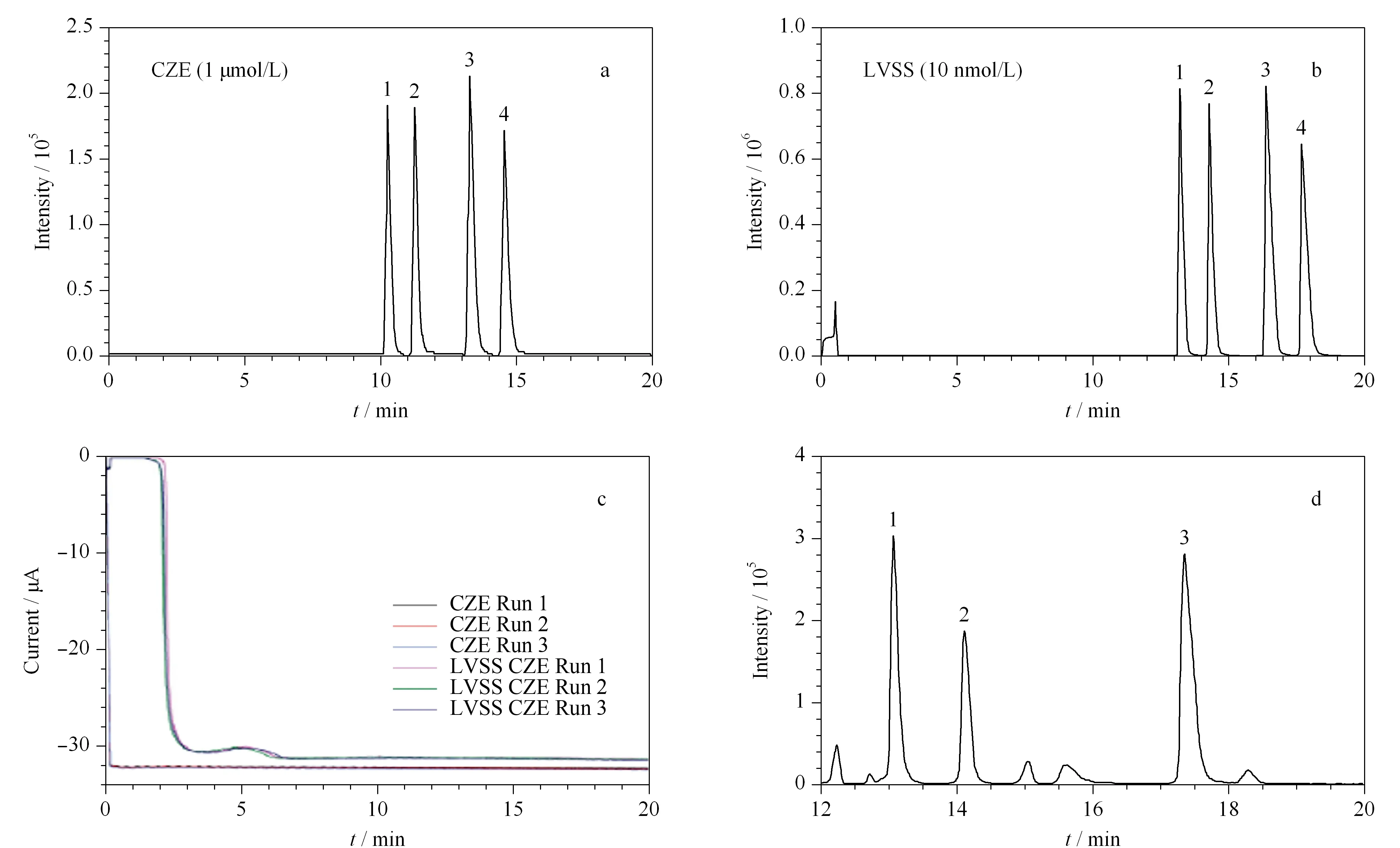
图 5 CZE-LIF模式和LVSS-CE-LIF模式性能对比[84]Fig. 5 Comparison of capillary zone electrophoresis-laser induced fluorescence detector (CZE-LIF) and LVSS (large-volume sample stacking)-CE-LIF performance[84] a. CZE-LIF electropherogram from the analysis of D- and L-Asp, and D- and L-Glu by CZE. b. CZE-LIF electropherogram from the analysis of D- and L-Asp, and D- and L-Glu by LVSS. c. current profiles for CZE and LVSS separations (n=3 for each method). d. representative electropherogram from the analysis of a single neuron from the F-cluster of the cerebral ganglion. Conditions: buffer, 60 mmol/L 2-(morpholino)-ethanesulfonic acid (pH 6.0), 10 mmol/L KBr, 0.011% quaternary ammonium β-CD; applied voltage, -26 kV; temperature, 18 ℃. Peaks identification: 1. L-Asp; 2. D-Asp; 3. D-Glu; 4. L-Glu.

表 1 近期手性CE领域部分代表性综述文章
4 结论与展望
从最新的文献报道可以明显看出,将各式各样的新型材料(advanced materials)引入到CE中构建各类修饰、协同分离体系是近年来的热点研究方向。随着材料科学的高速发展和学科交叉的不断渗透,可以预计此研究方向(基于新型材料的CE手性分离体系)还将在较长时间内保持热度。在CE分离模式的选择方面,各类CEC体系的报道呈现显著增多的趋势,如利用纳米粒、MOF、分子印迹等材料独特的尺寸效应、多样性、可设计性等特点,构建各类M-CEC或OT-CEC体系。然而从总体上看,目前此类工作的研究依然处于探索阶段,尤其在实际应用方面与CZE、EKC等相对更加成熟的手性分离模式相比还有较大差距。究其原因,一方面可能是由于合成、制备等实验操作的复杂性,另一方面此类相对复杂的CE体系会导致批次之间的重复性难以得到有效保证,从而一定程度地限制了此类CE手性分离体系的广泛开发与应用。
手性CE技术于20世纪80年代诞生,经历了20世纪90年代的迅猛发展和21世纪00年代的平稳过渡。在刚刚过去的21世纪10年代,我们可以看到CE手性分离领域的累累硕果,但也必须认识到现阶段它还不能取代HPLC等其他色谱技术在多个分离分析领域的主导地位。分离分析技术所追求的目标是高效、准确、灵敏、稳定、低耗、快速、简便和环保。在这些指标当中,CE拥有高效率,低消耗等天然优势,但在稳定性、灵敏度等方面相较于现代HPLC、GC等技术还稍有距离。笔者认为研究人员在未来的CE手性分离工作中应该多从实际应用的角度去发现和解决问题,尤其是充分利用现代分析科学和信息技术在手性识别机理方面取得突破,进而指导CE手性分离工作。相信在每一个CE领域工作者的智慧结晶中,手性CE,乃至整个CE技术还会迎来下一轮蓬勃发展。
