沉默缺氧诱导因子1α可抑制携带C-kit基因突变的急性髓细胞白血病细胞增殖
2020-08-17张继彬李永辉高晓宁
陈 泽,张继彬,吕 娜,李永辉,周 薇,关 伟,高晓宁
解放军总医院第一医学中心,北京 100853 1血液科;2心血管内科
伴t(8;21)染色体易位的急性髓系白血病(acute myeloid leukemia,AML)虽然是AML中预后较好的一个亚型[1],但合并C-kit基因突变时则因复发率高而预后不佳[2]。C-kit是一种原癌基因,在约80%的AML患者中有表达,其突变频率为13% ~22%,在t(8;21) AML中其突变频率高达40%[3]。C-kit编码基因位于染色体4q11-12,其蛋白产物属3型酪氨酸激酶家族。C-kit蛋白通过与其配体,即干细胞因子结合,形成同源二聚体化从而促进细胞内酪氨酸残基磷酸化[4],促进细胞信号转导,引起细胞信号改变,从而达到对某些造血细胞增殖、分化、凋亡等一系列调控[5]。C-kit基因突变可引起其下游信号通路异常活化,进而导致细胞增殖及凋亡紊乱,从而引发白血病。目前临床上对于携带C-kit基因突变的AML尚无有效治疗药物。我们前期研究发现,缺氧诱导因子1α(hypoxia inducible factor 1α,HIF1α),这一介导细胞缺氧应答反应的重要转录因子,在t(8;21) AML患者中选择性高表达,HIF1α特异性抑制剂棘霉素(echinomycin)能抑制t(8;21) AML细胞的增殖[6]。本研究拟在前期基础上,探索抑制HIF1α对携带C-kit基因突变的AML细胞中C-kit基因表达的影响及对细胞恶性生物学行为的作用。
材料与方法
1 试剂 棘霉素 (MERCK:330175),RPMI1640细胞培养基(康宁:10-040-CVR),胎牛血清(Hyclone:SV30087.03),100× 青 霉 素 -链 霉 素溶液(白鲨:BL505A),反转录试剂盒(Promega:A3500),实时定量PCR试剂盒(KAPA:KK4601),人甲基纤维素培养基(R&D Systems:4434),兔抗人 C-kit抗体(CST:3074S),兔抗人HIF1α抗体(CST:14179S),兔抗人β-actin抗体 (CST:4970),TRIzolTMReagent(Invitrogen:15596018),BCA 蛋白定量试剂盒(碧云天:P0012S),ECL化学发光试剂盒(Merck Millipore:WBKLS0100),HRP标记山羊抗兔IgG抗体(CST:7074),Annexin V-FITC/PI细胞凋亡检测试剂盒(索莱宝:CA1020)。
2 细胞培养及药物处理 携带C-kit基因突变的t(8;21) AML细胞系Kasumi-1和SKNO-1采用RPMI1640培养基(90% RPMI1640、10%胎牛血清、1%双抗)于37℃、5% CO2、饱和湿度的细胞培养箱培养,每2 ~ 3 d更换1次细胞培养基。实验前1 d采用含10%胎牛血清的RPMI1640培养液调整细胞密度为1×105/ml接种于6孔板,每孔2 ml,实验当天采用终浓度为1 nmol/L、5 nmol/L、10 nmol/L、20 nmol/L、30 nmol/L的棘霉素以及DMSO分别处理Kasumi-1和SKNO-1细胞,放置培养箱继续培养至24 h收集待测细胞。
3 实时定量RT-PCR法检测 mRNA表达收集细胞,Trizol一步法提取细胞总RNA,逆转录试剂盒合成cDNA,荧光定量PCR检测mRNA表达,引物由博迈德(北京)合成,C-kit前引物序列:5'-CGTTCTGCTCCTACTGCTTCG-3',后引物序列:5'-CCCACGCGGACTATTAAGTCT-3';HIF1α 前 引物序列 :5'-GAACGTCGAAAAGAAAAGTCTCG-3',后引物序列:5'-CCTTATCAAGATGCGAACTCACA-3'。反应条件为95℃预变性20 min,94℃变性30 s,56℃退火30 s,72℃延伸90 s,进行40次循环,最终72℃延伸15 min。反应结束后根据熔解曲线判断扩增产物,记录不同基因的Ct值。目的基因相对表达量应用2-ΔΔCt公式来计算,ΔΔCt=(Ct加药组目的基因-Ct加药组内参基因) - (Ct对照组目的基因-Ct对照组内参基因,比较mRNA的相对表达含量。每组实验独立重复3次。
4 Western blot 收集待测细胞,PBS洗涤后用100μl RIPA裂解液于冰上裂解细胞提取总蛋白,BCA法定量后采用SDS-PAGE凝胶电泳,通过湿转的转膜方法转到PVDF膜上(300 mA,110 min),5%脱脂牛奶室温封闭2 h后加入C-kit(1∶1 000)、HIF1α抗体(1∶1 000)、GAPDH抗体(1∶1 000),4℃孵育过夜。TBST洗膜3次,每次15 min。再加入HRP标记兔二抗(1∶10 000),37℃孵育2 h,TBST洗膜3次,每次15 min,然后采用ECL化学发光法进行发光,经软件成像系统扫描目的条带后分析。以GAPDH作为内参照。每组实验独立重复3次。
5 流式细胞术检测细胞凋亡 收集待测细胞,PBS缓冲液洗涤后加入500 μl PBS重悬,每组样本留取4管分别加入Annexin V 3μl、PI 3μl、Annexin V和PI各3μl、PBS(空白对照),混匀后室温避光放置15 min,转移至流式管,1 h内流式细胞仪检测,每组实验独立重复3次。
6 克隆形成实验 收集待测细胞,在15 ml离心管中加入3 ml人甲基纤维素复合培养液待用,计数1 500个细胞加入300μl细胞培养液后,再加入甲基纤维素培养基中,涡旋振荡器充分混匀并静置5 min,将细胞放入两个3 cm培养皿中,3 d后开始密切观察克隆数以及克隆大小,每日拍照记录,计算7~14 d后的克隆数,每组实验独立重复3次。
7 统计学分析 采用Graphpad 7.0进行统计学分析。组间比较用Student-t检验,P<0.05为差异有统计学意义。
结 果
1 棘霉素对C-kit突变阳性的t(8;21) AML细胞系中HIF1α和C-kit的mRNA表达的影响 采用实时定量RT-PCR检测棘霉素处理后的Kasumi-1和SKNO-1细胞内HIF1α mRNA、C-kit mRNA表达变化。如图1所示,与经DMSO处理的对照组相比,HIF1α mRNA、C-kit mRNA表达均明显降低,且随棘霉素浓度增加,这一抑制作用逐渐增强。
2 棘霉素对C-kit突变阳性的t(8;21) AML细胞系中HIF1α和C-kit蛋白表达的影响 采用Western blot检测棘霉素处理后的Kasumi-1和SKNO-1细胞内HIF1α蛋白、C-kit蛋白表达变化。如图2所示,与DMSO对照组相比,HIF1α蛋白、C-kit蛋白表达明显降低,且随棘霉素浓度增加,这一抑制作用逐渐增强。
3 棘霉素对C-kit突变阳性的t(8;21) AML细胞系细胞凋亡的影响 用不同浓度棘霉素处理Kasumi-1和SKNO-1细胞24 h,显微镜观察,可发现细胞形态学上发生了明显变化。用DMSO对照处理的Kasumi-1,SKNO-1细胞,形状规则,大小一致,随着棘霉素浓度的增加细胞开始变大,出现细胞碎片,细胞数变少,形状不规则,且随着药物浓度增大细胞变化越来越明显。如图3所示,通过PI与Annexin V双染后流式细胞仪检测Kasumi-1、SKNO-1细胞凋亡情况可见,棘霉素处理24 h的细胞,与用DMSO对照处理的细胞相比,早期凋亡(PI与Annexin V双阳性)和晚期凋亡(PI阳性)细胞比例明显增加;而且随着棘霉素浓度增加凋亡细胞所占比例增高。
4 棘霉素对C-Kit突变阳性的t(8;21) AML细胞系增殖能力的影响 棘霉素处理后的Kasumi-1和SKNO-1细胞接种到克隆形成培养基中,7 ~ 14 d观察细胞增殖情况。如图4所示,随药物浓度增加,细胞克隆数明显下降,提示细胞增殖能力受抑制。
讨 论
原癌基因C-kit通过与其配体干细胞因子结合,调控造血干细胞早期增殖和分化[6]。C-kit基因突变后C-kit蛋白的活化不需要干细胞因子参与,即可持续刺激细胞的增殖、抑制细胞凋亡,促进白血病发生[6-9]。AML细胞系Kasumi-1和SKNO-1是携带t(8;21)染色体易位和C-kit基因突变的常见AML细胞系。研究表明,在Kasumi-1细胞系中存在C-kit基因Ash822Lys的激活突变[10],Asn822在RTK家族的激活使Kasumi-1细胞系成为C-kit突变的AML的理想模型[11],而SKNO-1是t(8;21)AML的第二个C-kit突变模型,两者的区别是Kasumi-1细胞为N822K突变杂合子,而SKNO-1为纯合子,所以本研究选择以上两种细胞系进行实验[11]。
HIF1α是缺氧条件激活的转录因子,调节着数百种影响细胞增殖凋亡的关键基因,其一旦被激活常提示肿瘤患者预后较差[11]。我们前期研究发现,HIF1α在t(8;21) AML患者中选择性高表达,抑制HIF1α可抑制t(8;21) AML细胞的增殖[6]。本试验中我们选择了HIF1α靶向抑制剂棘霉素处理Kasumi-1和SKNO-1两种细胞系,发现棘霉素处理细胞后,随着HIF1α表达水平的下降,C-kit基因mRNA和蛋白表达水平均明显降低,且随加药浓度增加,该抑制作用越来越明显,提示棘霉素可能通过抑制HIF1α表达进而抑制C-kit。当然,由于HIF1α与C-kit之间关系尚无报道,我们有必要进一步研究两者之间是否存在直接调控亦或是间接调控。
我们发现,伴随C-kit表达的降低,Kasumi-1和SKNO-1细胞系在经30 nmol/L的棘霉素处理后,相对于DMSO组早期凋亡和晚期凋亡都增加,且随药物浓度增加,凋亡情况加剧。C-kit基因突变是伴t(8;21)AML中的常见突变,发生率为12.7% ~ 47.2%[12-14],并且C-kit的功能获得性突变导致其下游AKT、STAT3和MAPK[14]信号通路的激活,C-kit/PI3K/AKT通路增加了对细胞凋亡和Survivin表达的抑制使Survivin表达增加,降低促凋亡Bak蛋白的表达[15]。值得注意的是,Survivin是凋亡抑制蛋白家族(IAPs)的成员[16],这种蛋白与Caspase-3和Caspase-7结合,阻断它们的作用,从而调控细胞凋亡。
我们还发现,伴随C-kit表达的降低,Kasumi-1和SKNO-1细胞系的体外细胞克隆形成数均明显减少,且随药物浓度增加,细胞增殖抑制情况越明显。有文献报道[15],C-kit下游的MAPK家族主要包括p38、JNK1/2和ERK1/2三类酶,JNK信号已被证实和凋亡密切相关,磷酸化激活的JNK可促进c-jun的基因转录从而参与细胞的增殖,p38通过促进Caspase-3和PARP的活性来实现对凋亡的调节,这些信号分子通过磷酸化水平调节活性影响细胞的增殖及凋亡[17]。

图1 棘霉素对Kasumi-1和SKNO-1细胞系HIF1α和C-kit mRNA表达的影响(aP<0.01, vs DMSO)Fig. 1 Effects of echinomycin on mRNA expression levels of HIF1α and C-kit genes in Kasumi and SKNO-1 cell lines cells (aP<0.01, vs DMSO)
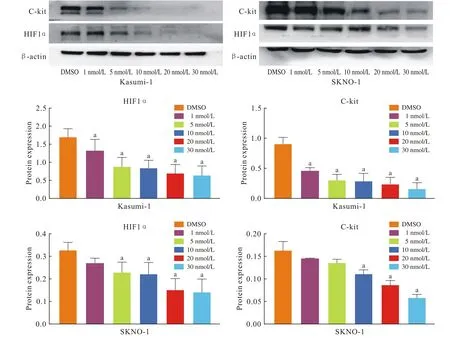
图2 棘霉素对Kasumi-1和SKNO-1细胞系HIF1α和C-kit蛋白表达的影响(aP<0.05, vs DMSO)Fig.2 Effects of echinomycin on protein expression levels of HIF1α and C-kit genes in Kasumi and SKNO-1 cell lines cells (aP<0.05, vs DMSO)
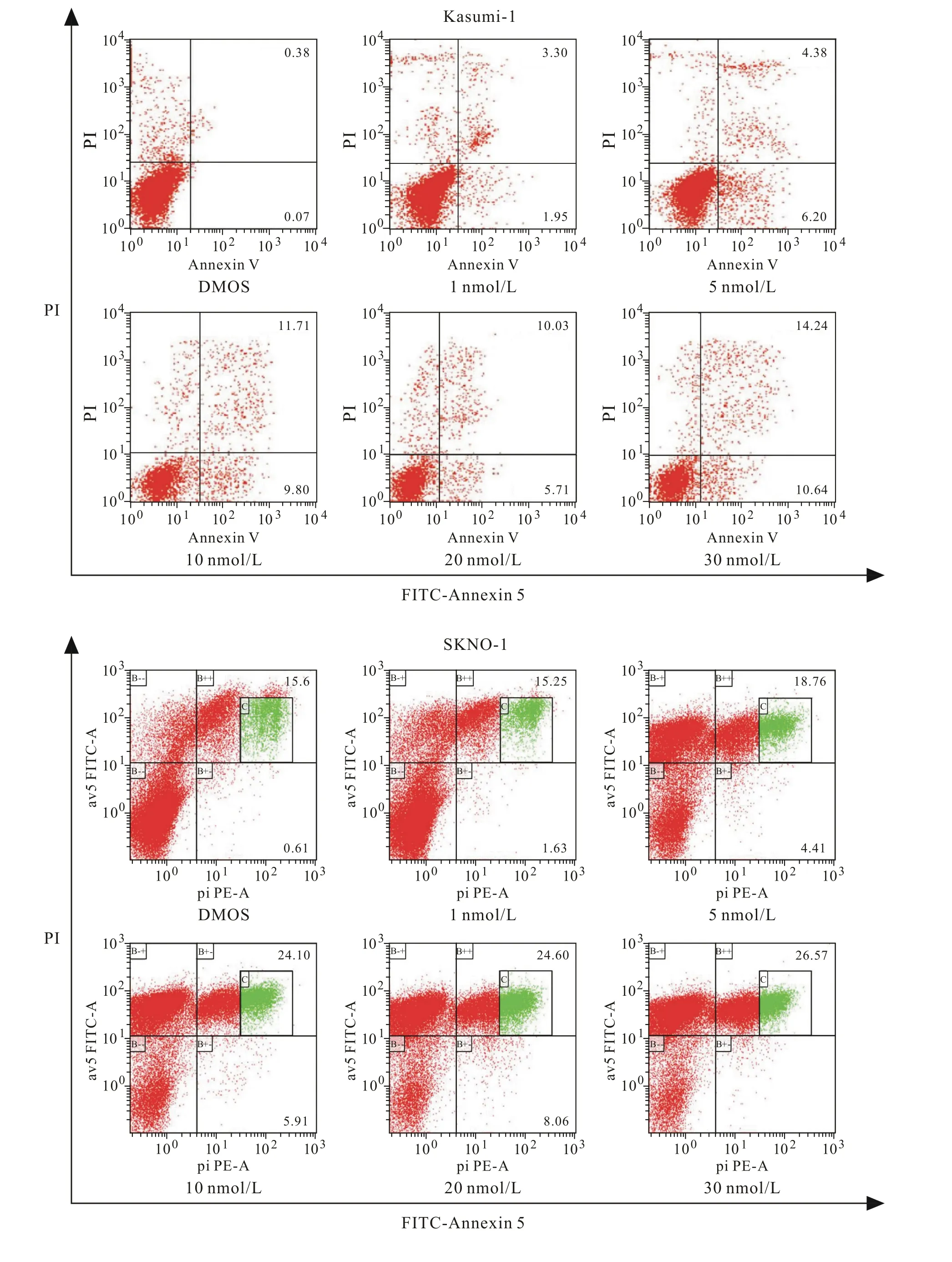
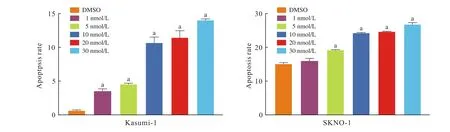
图3 棘霉素对Kasumi-1和SKNO-1细胞系细胞凋亡的影响(aP<0.01, vs DMSO)Fig.3 Effects of echinomycin on apoptosis of Kasumi and SKNO-1 cell lines cells (aP<0.01, vs DMSO)
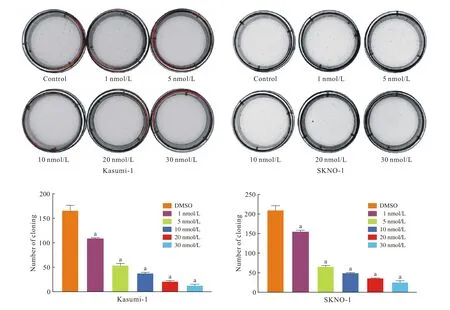
图4 棘霉素对Kasumi-1和SKNO-1细胞系增殖能力的影响(aP<0.05, vs DMSO)Fig.4 Effects of echinomycin on cellular proliferation of Kasumi and SKNO-1 cell lines cells (aP<0.05, vs DMSO)
综上,我们推测棘霉素可能通过抑制HIF1α表达从而影响C-kit,诱导细胞凋亡、抑制细胞增殖。目前临床对于C-kit突变合并t(8;21) AML尚无有效靶向治疗药物,本研究为进一步将棘霉素应用于这类AML的治疗提供了实验基础。
