miR-513b-5p表达变化对结肠癌细胞增殖、迁移的影响及机制探讨
2020-08-05刘磊杜攀王芳包迪林立新
刘磊,杜攀,王芳,包迪,林立新
湖北文理学院附属医院 襄阳市中心医院,湖北襄阳441100
结肠癌(CC)是最常见的消化系统恶性肿瘤之一,病死率居全球恶性肿瘤第三位[1]。CC在我国消化道肿瘤中发病率仅次于胃癌和食管癌[2]。由于早期筛查手段不足,大多数患者首次确诊已发展为中晚期,失去手术根治机会[3]。近年来随着内窥镜检查的普及,CC早期诊断水平有所进步,但是晚期CC患者的预后仍然很差[4]。因此,寻找有效的治疗CC的途径对改善患者预后意义重大。微小RNA(miRNA)为非编码RNA,长度为18~25个核苷酸[5]。miRNA通过与mRNA的3′ UTR结合调控靶基因表达,从而介导肿瘤的进展[6]。miR-513b-5p作为miRNA家族中的一员,其在鼻咽癌中低表达,并抑制肿瘤细胞的增殖和迁移[7]。类似研究表明,miR-513a-5p可抑制视网膜母细胞瘤的增殖[8]。miR-513a-5p在CC中的作用及其机制尚未明确。有研究表明,重组人细胞信号转导与转录激活因子3(STAT3)在CC中具有促进细胞生长的作用[9],其发挥作用的上游机制尚不清楚。2016年7月~2018年7月,本研究观察了CC组织、细胞中miR-513b-5p的表达变化,及miR-513b-5p对CC细胞增殖和迁移的影响,并探讨相关机制,以期为临床上治疗CC提供新的理论依据。
1 材料与方法
1.1 组织、细胞及主要实验材料 选择2016~2018年本院收治的57例CC患者的CC组织及其癌旁组织,所有患者均经病理检查确诊为CC且未接受放化疗,手术切除组织标本后,保存于-80 ℃冰箱。本研究经医院伦理委员会批准,并获得所有患者的书面知情同意。人CC细胞系HCT116、RKO、SW480、LoVo和SW620细胞均购自中科院典型培养物保藏委员会细胞库。人结肠成纤维细胞(CCD-112CoN细胞)购自美国ATCC生物生物标准品资源中心。Lipofectamine 2000、空载质粒miR-con、过表达STAT3质粒、miR-513b-5p模拟物(miR-513b-5p mimics)和miR-513b-5p抑制剂(miR-513b-5p inhibitors)均购自美国Invitrogen公司。TRIzol RNA提取试剂盒、逆转录试剂盒及SYBR PCR Master Mix购自美国Thermo Fischer公司。PVDF膜、CCK-8试剂盒和Transwell小室购自美国Millipore公司。RIPA裂解缓冲液购自碧云天生物技术公司。ECL试剂盒购于Amersham Pharmacia公司。荧光素酶活性检测试剂盒、野生型STAT3(STAT3-WT)和突变型STAT3(STAT3-MUT)载体购于美国Promega公司。
1.2 CC组织和细胞中miR-513b-5p检测 使用TRIzol法提取CC组织、癌旁组织和CC细胞、CCD-112CoN细胞的总RNA,检测纯度后将RNA反转录成cDNA,按照PCR试剂盒操作说明进行目的基因扩增。以U6(组织)GAPDH(细胞)作为内参,以2-ΔΔCt表示目的基因相对表达量。每组实验重复3次,结果取平均值。
1.3 miR-513b-5p表达抑制对CC细胞增殖、迁移的影响观察 培养HCT116细胞,待细胞融合度达到80%~90%时进行传代。HCT116细胞分为miR-con组、miR-513b-5p抑制剂组,按照Lipofectamine 2000转染试剂盒说明书将miR-513b-5p inhibitors和miR-con转染细胞。将两组细胞按照2×103/孔接种于96孔板中。贴壁培养24 h后,向每孔加入10 μL的CCK-8溶液。将培养板在培养箱内孵育4 h,用酶标仪测定在450 nm的吸光度值,以此表示转染后0、1、2、3、4 d的细胞增殖能力。采用Transwell实验检测细胞迁移能力。取两组细胞,胰酶消化后以1 000 r/min离心3 min,无血清RPMI-1640重悬细胞沉淀至密度为1×105/mL,取200 μL细胞悬液加入至Transwell小室上室,下室加入700 μL的含10% FBS的完全培养液,于5% CO2、37 ℃恒温培养箱中培养24 h。取出小室,用棉签轻轻将小室上室表面细胞擦去,晾干,用结晶紫溶液染色30 min,PBS洗涤2次,显微镜观察并拍照,随机选取5个视野(100×)计数迁移细胞,每个样本均设置3个复孔,实验结果取均值。
1.4 miR-513b-5p与STAT3的靶向关系验证 通过生物信息预测miR-513b-5p在STAT3上的结合位点并用PCR对STAT3上miR-513b-5p的结合位点进行扩增。将扩增片段插入到pmiR-GLO report载体,构建STAT3-WT质粒。用基因突变技术将部分核苷酸突变,构建STAT3-MUT质粒。分别用STAT3-WT、STAT3-MUT质粒和miR-513b-5p mimic、miR-con转染HCT116细胞,用荧光素酶检测试剂盒检测荧光素酶活性,采用Western blotting法检测STAT3蛋白。
1.5 STAT3过表达对CC细胞增殖、迁移的影响观察 取部分HCT116细胞,分为miR-con组(转染miR-con)、miR-513b-5p模拟物组(转染miR-513b-5p mimics)、STAT3过表达组(共转染STAT3过表达质粒和miR-513b-5p mimics)。采用CCK-8试剂盒检测各组细胞增殖能力,采用Transwell实验检测细胞迁移能力。
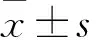
2 结果
2.1 CC组织和细胞中miR-513b-5p表达变化 CC组织和癌旁组织中miR-513b-5p相对表达量分别为0.410±0.053、1.000,CC组织miR-513b-5p表达低于癌旁组织(P<0.01)。HCT116、RKO、SW480、LoVo、SW620细胞及CCD-112CoN细胞中miR-513b-5p相对表达量分别为0.613±0.065、0.461±0.048、0.223±0.024、0.536±0.055、0.302±0.033、1.000,五种CC细胞miR-513b-5p相对表达量均低于CCD-112CoN细胞(P均<0.01)。
2.2 miR-513b-5p表达抑制对CC细胞增殖、迁移的影响 转染0、1、2、3、4 d后,miR-513b-5p抑制剂组细胞增殖能力高于miR-con组(P均<0.05),见表1。miR-513b-5p抑制剂组、miR-con组细胞迁移数量分别为(52±11)、(21±2)个,miR-513b-5p抑制剂组细胞迁移能力高于miR-con组(P<0.01)。见图1。
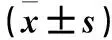
表1 转染0、1、2、3、4 d后miR-513b-5p抑制剂组、miR-con组细胞增殖能力比较

图1 miR-513b-5p抑制剂组、miR-con组Transwell实验细胞迁移情况(结晶紫染色,100×)
2.3 miR-513b-5p与STAT3的靶向关系 StarBase在线分析数据库(http://starbase.sysu.edu.cn/panCancer.php)显示STAT3与miR-513b-5p存在结合位点。与miR-con组相比,miR-513b-5p模拟物组STAT3-WT细胞的荧光素酶活性降低(P<0.05),相对荧光素酶活性分别为1.000±0.100和0.641±0.066。与miR-con组相比,miR-513b-5p模拟物组STAT3-MUT细胞的荧光素酶活性无显著改变,相对荧光素酶活性分别为1.000±0.100和1.020±0.124。miR-con组、miR-513b-5p模拟物组、miR-513b-5p抑制剂组STAT3蛋白相对表达量分别为1.000±0.100、0.310±0.034、2.510±0.311,miR-513b-5p模拟物组STAT3蛋白相对表达量低于miR-con组、miR-513b-5p抑制剂组STAT3蛋白相对表达量高于miR-con组(P均<0.01)。由此可见,miR-513b-5p可能靶向负调控STAT3。
2.4 STAT3过表达对CC细胞增殖、迁移的影响 转染0、1、2、3、4 d后,miR-513b-5p模拟物组细胞增殖能力低于miR-con组,STAT3过表达组细胞增殖能力高于miR-513b-5p模拟物组,组间两两比较,P均<0.01。见表2。miR-513b-5p模拟物组、STAT3过表达组、miR-con组细胞迁移数量分别为(15±3)、(34±8)、(52±11)个,miR-513b-5p模拟物组细胞迁移数量低于miR-con组,STAT3过表达组细胞迁移数量高于miR-513b-5p模拟物组,组间两两比较,P均<0.01。见图2。
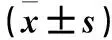
表2 转染后0、1、2、3、4 d miR-con组、miR-513b-5p模拟物组、STAT3过表达组细胞增殖能力比较

图2 miR-con组、miR-513b-5p模拟物组、STAT3过表达组Transwell实验细胞迁移情况(结晶紫染色,100×)
3 讨论
miRNA是近年来研究发现的一种基因调控元件,通过协同或抑制作用共同调控靶基因,从而参与机体各种病理生理过程[10]。大量实验证据表明,miRNA是一类重要的调控因子,可作为多种恶性肿瘤的预后标志物[11]。例如,miR-552在卵巢癌中表达上调,其高表达与患者不良预后密切;进一步研究表明miR-552通过靶向张力蛋白同源的磷酸酶促进卵巢癌细胞的生长和转移[12]。而在骨肉瘤中,miR-618通过靶向Maelstrom在体内和体外抑制肿瘤的生长[13]。miRNA表达失调预示着患者预后更差,而且miRNA在功能上与肿瘤的发生和发展密切相关。本研究发现miR-513b-5p在CC组织和CC细胞中表达下调,miR-513b-5p抑制剂可促进HCT116细胞的增殖、迁移能力,而miR-513b-5p模拟物可抑制HCT116细胞的增殖、迁移能力,这表明miR-513b-5p在CC中可作为抑癌基因发挥作用。
通常,miRNA可通过碱基配对方式与位于mRNA 3′UTR的互补序列结合,导致mRNA的降解或翻译抑制,从而影响肿瘤的生长和转移。迄今为止科学家们已在人体内发现超过1 400种miRNA,这些基因占人类基因组的1%~3%,而30%~60%的蛋白质编码基因由miRNA来调节[14]。据文献报道,miR-195-5p在CC中表达下调,并与患者生存期短密切相关;进一步研究表明miR-195-5p通过靶向调节Yes相关蛋白1抑制CC的生长和转移[15]。类似研究报道,miR-495在CC中直接靶向FA83D蛋白抗体(FAM83D)抑制CC的生长;进一步研究表明PTEN/PI3K/AKT/mTOR信号通路参与miR-495/FAM83D轴介导的CC的进展[16]。本研究为进一步探究miR-513b-5p的下游靶点,通过StarBase数据库分析发现,STAT3是miR-513b-5p的潜在靶点,体外实验则表明miR-513b-5p可通过靶向负调控STAT3抑制CC细胞的增殖和迁移。
STAT3在CC中被频繁激活,从而表达异常,发挥致癌作用[17]。据研究,STAT3在维持干细胞表型重要基因的表达方面起着重要作用。STAT3通路在富含肿瘤干细胞(CSC)标记的细胞亚群中优先激活。CD133是一种可标记CSC的跨膜糖蛋白,而活化的STAT3可通过与NF-κB和缺氧诱导因子1α的联合作用上调CD133表达,这表明STAT3可作为CSC的标志物[18]。此外,STAT3在肿瘤细胞和肿瘤浸润的免疫细胞中均被激活,激活的STAT3发生磷酸化、同型二聚化、核易位和DNA结合,促进肿瘤生长、血管生成、侵袭和免疫逃逸,从而持续促进肿瘤进展[19]。因此,本研究通过荧光素酶活性实验和Western blotting检测证实了miR-513b-5p可直接靶向STAT3并负调节后者的表达;功能实验表明过表达STAT3可部分逆转miR-513b-5p模拟物对CC细胞增殖和迁移的抑制作用。
总之,本研究发现,miR-513b-5p在CC组织和细胞中低表达,miR-513b-5p表达下调可增强细胞增殖和迁移;miR-513b-5p可能通过靶向负调控STAT3起到抑制CC细胞增殖和迁移的作用。本研究尚存在一些不足之处,如STAT3的下游信号转导途径和miR-513b-5p的上游靶基因不明确,需进一步探究。此外,仍需要更大样本的实验研究完善上述结论。
