魔芋多聚糖对改善2型糖尿病大鼠糖脂代谢异常的机制研究
2020-07-23阮凌
阮 凌
(西安石油大学 体育系,陕西 西安 710065)
目前,2型糖尿病(Type 2 Diabetes,T2DM)已成为一个人们生活中重要的健康问题,由于生活方式的改变,使其发病率在全球迅速上升,并呈现出逐年增加的趋势[1]。有研究表明,不良的生活方式将会诱发T2DM,占T2DM发病率的90%[2-3]。T2DM治疗的核心目标是通过降低血糖,从而改善胰岛素抵抗(Insulin Resistance,IR)。一般来说,可溶性膳食纤维对血糖和血清胰岛素有改善的效果[4-6]。因此,通过改变饮食习惯,如摄入更多的高膳食纤维来改善T2DM具有良好的效果。
流行病学的研究证实,摄入高纤维饮食可以起到降低体重和血脂水平的作用。有研究表明,高膳食纤维可以抑制食欲,减少能量摄入,从而起到降低体重的作用。魔芋是一种亚热带植物,它是一种可食用的球茎,被称为天然纤维,长期以来作为亚洲地区的传统食品。魔芋多聚糖(Konjac Glucomannan,KMG)是一种从魔芋粉中提取的天然多糖类物质。KGM对人体健康有益,是一种高质量的可溶性膳食纤维。国内学者研究认为,KMG是一种有益的营养素,有预防和改善2型糖尿病的效果,KMG显著降低了血糖和血清胰岛素水平,改善了脂质代谢。而KGM调节脂质代谢的机制,促进肠道黏液的生长,改善排便[7]。
本研究旨在通过魔芋多聚糖改善T2MD大鼠血糖,胰岛素抵抗,脂代谢指标,炎症因子和相关蛋白质的表达,试图发现其潜在的分子机制。
1 研究方法
1.1 材料与方法
FBG、FIN、TC、TG、LDL-C和HDL-C的测定试剂盒(南京建成生物技术有限公司)。TNF-α和IL-6 ELISA试剂盒进行测试(武汉BOSTE生物技术有限公司)。采用免疫印迹法测试GLUT-4、IRS1、pIRS1Ser730、IRS2和pIRS2Ser731(武汉BOSTER生物技术有限公司)。
1.2 实验动物模型与设计
雄性SD大鼠(180~220 g,7~8周)从西安交通大学实验动物中心购买。大鼠在动物实验中心(23±1 ℃,湿度60%~70%,12 h光/12 h暗周期)环境中饲养。所有大鼠进行1周的适应性喂养。SD大鼠(n=40)被随机分成2个实验组,喂食标准啮齿动物饮食的正常对照组(NC;n=10)和高脂饮食组(HFD;n=30)。高脂饲料含40%脂肪、18%蛋白质、42%碳水化合物。喂养2周后,高脂饮食组在禁食12 h后,注射40 mg/kg链脲佐菌素(STZ)。在STZ注射72 h后尾静脉取血,测试血糖值,将血糖维持在16.7 mmol/L以上的大鼠确定为2型糖尿病大鼠[8]。
2型糖尿病大鼠模型建立后,将所有大鼠分为3组,正常对照组(NC,n=10),喂养普通饲料;2型糖尿病模型大鼠随机分为2组,2型糖尿病组(DM,n=10);喂养普通饲料8周;2型糖尿病魔芋多聚糖组(DK,n=10),以含有KMG的饮食喂养持续8周[9]。
1.3 魔芋多聚糖饲料配方
采用10%的魔芋多聚糖混合基础饲料(面粉20%、米粉10%、玉米20%、鼓皮25%、豆料20%、鱼粉2%、骨粉3%;其中,脂肪提供能量占18%、蛋白质占32%,碳水化合物占50%)添加成分和水按一定比例混合成团,将混匀的饲料团块填充到实验大鼠特配饲料自制装置中,压实,然后用注射器活塞将饲料推出,魔芋多糖特配饲料采用高温烘干。
1.4 血清指标测定
8周后实验结束时,所有大鼠禁食12 h,取血液和腓肠肌样本。从腹主动脉采集血液样本,用离心机在3000 r/min下离心15 min,然后取血清。使用全自动分析仪测试TG(mmol/L)、TC(mmol/L)、LDL-c和HDL-c水平(mmol/L)。采用ELISA法检测TNF-α、IL-6的含量。
1.5 口服葡萄糖耐受性试验(OGTT)实验
在实验结束时进行口服葡萄糖耐受试验(OGTT)实验。SD大鼠分别在对照组和2型糖尿病模型组随机选取。禁食12 h后,使用尾静脉的血液样本测试FBG和FIN。然后,大鼠接受OGTT测试(2克/千克体重)[8]。胃内注射后,在0、30、60和120 min尾静脉测量血糖和血胰岛素水平[10-11]。
1.6 免疫印迹法测试
骨骼肌称重后用冷盐水清洗,IRS1、pIRS1Ser730、IRS2和pIRS2Ser731的腓肠肌蛋白表达的用免疫印迹法测定。SDS-PAGE电泳后,将蛋白质转移到PVDF膜,室温下用TBS/T封闭液体(TBS含有0.1%~20.5%脱脂奶粉)PVDF膜孵育2 h,TBS/T缓冲液冲洗3次,每次5 min。用抗稀释剂稀释(TBS/T含有5%BSA)稀释一个抗体(抗体为1∶1000制备),并在4 ℃的TBS/T缓冲液冲洗,孵育PVDF膜,3次/5 min,然后膜和两个电阻(1∶5000),封闭稀释液体在室温孵育1 h,TBS/T缓冲液冲洗。将化学发光试剂A液体与B液体混合,孵育PVDF膜1 min,并在凝胶成像器中成像。
1.7 统计分析
各组数据应用SPSS 16.0统计软件和Excel 2007加载软件包进行分析。实验数据采用平均数±标准差(Mean±SD)表示,所有数据比较在确定方差齐性后(P>0.05)进行组间比较;各组间采用单因素方差分析,两样本间比较采用t检验,以P<0.05为差异,具有统计学意义,P<0.01为具有非常显著性差异。
2 结果与分析
2.1 每组大鼠OGTT后葡萄糖和胰岛素的变化
采用OGTT测试,与NC组相比,DM组从30~120 min(P<0.01)血糖和胰岛素含量明显升高(图1A)。与DM组相比,DK组血糖(P<0.05,图1A)和胰岛素水平显著性降低(P<0.05,图1B)。
2.2 各组大鼠血清指标的变化
由表1可知,各组大鼠血糖、血清胰岛素和HOMA-IR的变化。与NC组相比,DM组中FBG和FIN升高(P<0.05)。经过8周的KMG补充,与DM组相比,DK组血糖、血清胰岛素和HOMA-IR(P<0.05)明显减少。
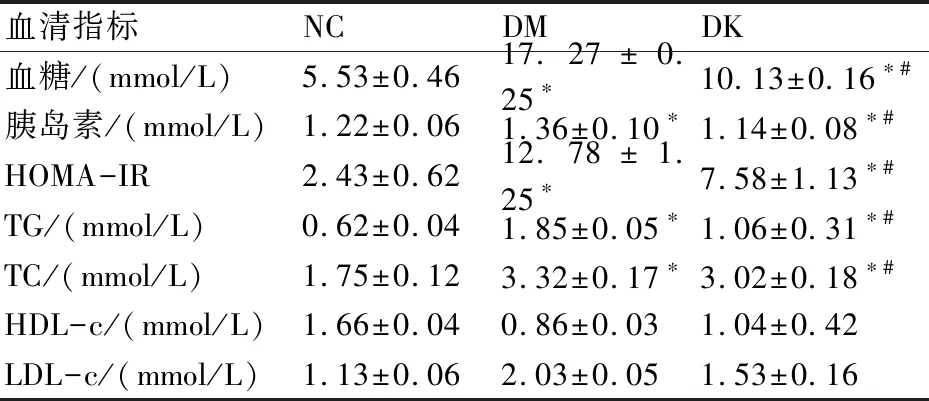
表1 各组大鼠血清指标的变化
DM组中的TG和TC水平明显高于NC组(P<0.05)。此外,与DM组相比,DK组的TG和TC水平显著下降(P<0.05)。然而,每组HDL-c和LDL-c没有显著变化(P<0.05)。
2.3 各组大鼠炎症细胞因子的变化
由去2可知,各组大鼠IL-6和TNF-α的变化,与NC组相比,DM组中的IL-6和TNF-α显著增加(P<0.05),与DM组相比,DK组中TNF-α显著减少(P<0.05)。
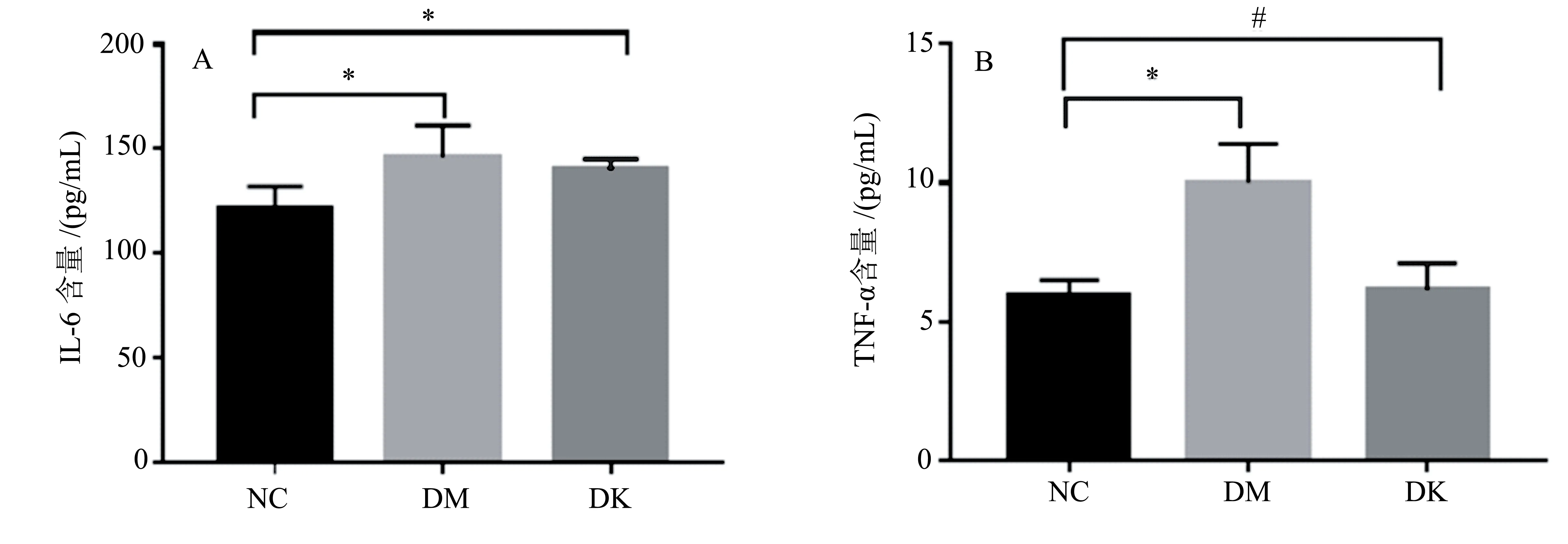
*P<0.05,与NC组相比;#P<0.05,与DM组相比。图2 不同处理组大鼠炎症细胞因子的变化
2.4 各组大鼠GLUT-4的蛋白质表达
由图3可知,与NC组相比,DM组GLUT-4蛋白水平明显下降(P<0.01)。8周的魔芋多聚糖干预,DK组的GLUT-4蛋白表达高于DM组(P<0.01,图3)。
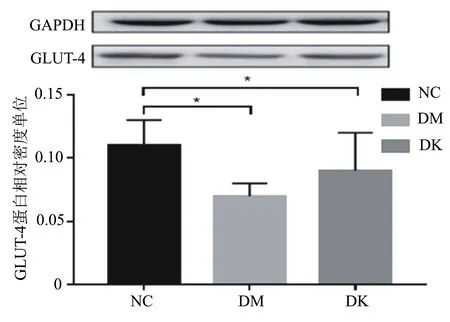
*P<0.05,与NC组相比。图3 不同处理组大鼠GLUT-4的蛋白质表达
2.5 各组大鼠IRS1、pIRS1Ser730、IRS2和pIRS2Ser731蛋白在腓肠肌中的表达
由图4可知,与NC组相比,DM组和DK组中的pIRS1Ser730显著降低(P<0.05),与DM组相比,pIRS1Ser730在DK组显著增加(P<0.05)。DM组和DK组中,IRS2明显高于NC组,而DM组和DK组中pIRS2Ser731明显低于NC组。然而,IRS1的表达在各组之间没有显著的差异(P>0.05)。
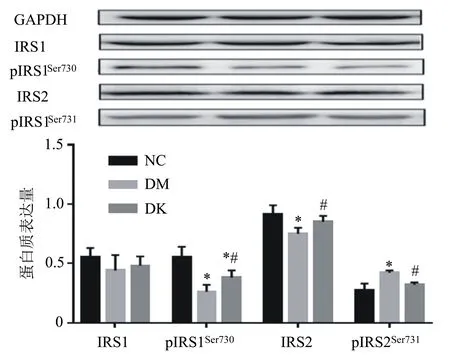
*P<0.05,与NC组相比;#P<0.05,与DM组相比。图4 不同处理组大鼠IRS1、pIRS1Ser730、IRS2和pIRS2Ser731蛋白在腓肠肌中的表达
3 讨论
在本研究中,笔者采用高脂饮食诱导和STZ注射的方式,建立了2型糖尿病模型大鼠。与前人的研究一致,使用HFD和STZ可以建立了T2MD大鼠模型[12],高脂饮食会导致高血糖,高胰岛素血症和胰岛素抵抗[13-15]。使用HFD和STZ诱导这种2型糖尿病大鼠模型与人类T2MD的发生相同[16]。本研究发现KMG对T2DM大鼠的血糖、血脂、炎症因子和胰岛素信号通路蛋白的表达,有改善的作用。
本研究结果表明,2型糖尿病组葡萄糖耐受性和胰岛素抵抗能力受损,因此,血糖和血清胰岛素水平明显高于正常对照组。同时,高血糖还可激活各种信号通路,导致ROS大量增加并诱导胰岛素抵抗[17]。胰岛素抵抗的特征是T2DM发病机制的中心环节,导致T2DM大鼠糖代谢紊乱,同时,由于胰岛素抵抗和胰岛素缺乏,血清TG、TC和LDL-c的含量升高,成为T2DM的常见特征。有研究表明,2型糖尿病的脂质增加造成机体脂代谢异常,过量的脂质是导致胰岛素抵抗的重要原因之一[18-19]。
KMG的补充显著地改善了血糖水平和胰岛素抵抗。每天摄入KGM对改善血糖有益。本研究结果表明:KMG补充8周后,对2型糖尿病大鼠的血糖和胰岛素抵抗得到改善。此外,摄入KGM对HOMA-IR也有改善作用。最新研究表明,KMG在降低血脂和改善IR方面均有效。魔芋多聚糖可以降低血糖和血脂,同时促进肠道蠕动。本研究与前人的研究结果一致,2型糖尿病组大鼠的TG和TC水平明显较高,但补充KGM后TG和TC水平下降[20]。其机制可能是KMG吸收水分后膨胀,可以填充胃肠道,减少食物摄入量,增加饱腹感。然而,HDL-c和LDL-c在各组之间没有显著差异。
2型糖尿病除高血糖、高脂血症和胰岛素抵抗外,还被作为一种炎性疾病。炎症细胞因子,如TNF-α和IL-6可降低机体胰岛素敏感性,同时,TNF-α和IL-6升高也损害胰岛素的信号通路。最新研究发现,TNF-α造成胰岛素抵抗表现为高脂血症,即外周胰岛素抵抗和胰岛素信号通路的抑制。结果表明,2型糖尿病大鼠,炎症细胞因子TNF-α和IL-6水平升高,然而,补充KMG饮食可以降低TNF-α水平。Kang等证明,KMG可明显改善机体炎症反应。另有研究表明,TNF-α水平升高与胰岛素抵抗有关。Alipourfard等[2]研究发现通过改善胰岛素敏感性,机体的TNF-α表达也减少。本研究也印证了KMG也可以通过降低TNF-α的表达,从而达到改善胰岛素的敏感性的作用。
本研究试图通过IRS的信号通路蛋白表达,来说明魔芋多聚糖改善2型糖尿病大鼠的作用。胰岛素受体(IRS)在胰岛素信号通路中起到非常重要的作用,IRS是胰岛素受体后信号细胞内传导的重要组成部分,在胰岛素抵抗中起到重要作用。IRS-1和IRS-2的主要作用已经得到了证实,它们作为细胞表面受体和细胞内信号级联之间的纽带。IRS-1是胰岛素信号通路的上游通路蛋白,是胰岛素抵抗的负调节器,其磷酸化的增加会导致IRS-1酪氨酸磷酸化,并调节细胞对胰岛素的反应,从而起到调节糖代谢。同时,IRS-2在胰岛素信号介导系统中也起着重要的作用,它具有调节胰岛素和细胞因子分泌作用。此外,GLUT-4是胰岛素信号转导通路蛋白的关键因素,它将葡萄糖从血液转移到组织中。本研究发现,2型糖尿病大鼠的GLUT-4蛋白水平显著降低,而IRS-1的表达没有显著变化。因此,8周KMG补充对周围胰岛素抵抗有明显的改善作用,这可能与骨骼肌胰岛素信号通路障碍的改善有关。前人研究表明,HFD/STZ诱导大鼠出现胰岛素抵抗,炎症因子表达的增加,胰岛素信号通路上的蛋白质水平也发生变化。本研究中pIRS1Ser730在KMG补充组中比在T2MD组显著增加。此外,Ser307的IRS1磷酸化及其降解是由慢性胰岛素抵抗引起的。然而,没有观察到各组之间IRS1在腓肠肌中的表达有显著性差异。同时,KMG补剂可调节GLUT-4蛋白水平、IRS-2和IRS-2Ser731蛋白的表达,降低血糖,提高胰岛素的敏感性。
4 小结
本研究发现KMG对HFD和STZ诱导T2DM大鼠,有降低血糖、血脂,改善胰岛素抵抗,同时有抗炎的效果,但关于IRS信号通路的可能机制仍需进一步研究。
