油棕EgNAC33基因的克隆与逆境响应表达分析
2020-07-23周丽霞曹红星
周丽霞,曹红星
(中国热带农业科学院 椰子研究所/海南省热带油料作物生物学重点实验室,海南 文昌 571339)
当植物受到低温、干旱及盐碱等非生物逆境胁迫时,细胞会发生一系列的基因调控,产生一系列的逆境响应机制来适应逆境[1]。转录因子在基因调控过程中起到效应基因开关的作用,常见的转录因子,如WRKY、AP2、bZIP及NAC等[2-4],都在植物逆境响应过程中发挥调控作用,其中,NAC转录因子广泛参与植物对逆境的响应过程。NAC转录因子的N端存在1个比较保守的NAC结构域,其C端有1个转录调控结构域,当接收到逆境胁迫信号后,NAC通过转录调控结构域来调控下游基因的表达[5]。
NAC转录因子最初是从矮牵牛分生组织中分离出来的[6],当缺少该基因时,叶片无法正常发育。近年来,随着对NAC转录因子调控功能的不断挖掘,发现NAC在植物生长发育、代谢衰老、植物对抗生物及非生物胁迫等多方面都起到表达调控的作用,如Kusano等[7]研究发现NAC在水稻根、茎和花的发育早期及水稻成熟韧皮部的维管束组织中均有所表达。Guo等[8]研究发现AtNAC基因在衰老叶片中的表达量上调,且过表达的AtNAC基因会加速叶片的衰老。Zhang等[9]发现当水稻受稻瘟菌侵染后,28个OsNAC基因的表达量上调,19个OsNAC基因的表达量下调。Ochiai等[10]在水稻中筛选出1个NAC基因Boronexcesstolerant1,该基因可以负调控水稻的耐硼毒性。Yokotani[11]发现水稻中至少有5个NAC基因在干旱及盐胁迫中的表达量上调,SNAC1基因的过量表达会促进水稻叶片气孔的关闭,减少水分流失,提高抗旱能力。Xue等[12]通过转基因克隆小麦的TaNAC基因,发现该基因在干旱和低温胁迫下的表达量上调,以提高小麦对环境的抗逆性。孙丽娟等[13]通过分析巨桉的基因EgrNAC1在低温、干旱和高盐胁迫下的表达量,发现该基因在上述3种非生物胁迫下的表达量均上调,该基因对这3种胁迫均会产生响应。
我国从马来西亚、印度尼西亚等油棕传统种植区引进油棕试种近90年,主要种植在海南、广西等热区。近年来,随着棕榈油消费量的增大,油棕的种植面积急需扩大,但我国冬季的低温天气严重限制了油棕的扩大种植,低温是限制我国油棕产业发展的瓶颈之一,研究油棕EgNAC33基因的表达特征和功能,对油棕的抗逆尤其是抗寒育种具有重要意义。目前,关于油棕NAC基因受非生物胁迫诱导表达的研究鲜有报道。笔者借助分子技术,克隆了油棕的EgNAC33基因,应用生物信息学方法分析了其序列结构特征,通过荧光定量PCR方法检测了该基因在低温条件下被诱导表达的规律,同时初步探索了此基因对干旱及高盐胁迫的响应,旨在为进一步的基因功能鉴定工作提供试验依据,同时为油棕分子辅助育种提供候选基因。
1 材料与方法
1.1 试验材料
供试油棕材料来自中国热带农业科学院椰子研究所油棕品种试种示范园。选取9株同一批培育、植株大小相近,长势良好、茎高约45 cm的幼苗,将其分为3个重复,每个重复为3株,放入可控植物三色光培养箱中,进行8 ℃低温(光照14 h/黑暗10 h)处理,分别在处理后1、4、8、24和48 h时进行叶片采样;以28 ℃室外生长条件下的幼苗为对照组。分别用7、5、3、2和1 d不浇水的植株作为干旱处理组;以正常浇水组为对照组,进行叶片采样。高盐处理:将油棕幼苗置于不同塑料容器内,处理组容器中保持植株栽培盆1/2高度的300 mmol/L NaCl溶液,对照组则用清水保持同样液面高度,并分别在处理后0、4、12、24、48及72 h时进行叶片采样。取样样品均为幼苗的中间嫩叶,用液氮冷冻,用于RNA的提取。
主要试剂:大肠杆菌Escherichiacoli5α为湖南大学分子育种实验室保存;T4 DNA连接酶、Taq DNA polymerase、RNA逆转录试剂盒购自海口琼山莱客(海南)科技服务中心;克隆载体pGEM-T Easy Vector购自Promega公司; RT-PCR试剂盒、RACE试剂盒购自Invitrogen公司;荧光定量试剂盒[FastStart Universal SYBR Green Master (Rox)]购自罗氏公司;引物合成及测序由深圳华大基因科技服务有限公司完成。
主要仪器设备: Mx3000P型实时荧光定量PCR仪、SYNGENE GBOXHR 凝胶成像分析系统、三色光培养箱(LED-30HL1,美国)、超速冷冻离心机(Eppendorf Centrifuge 5810 R型,德国)、超微量核酸蛋白检测仪(Thermo Nanodrop 2000)。
1.2 RNA的提取及cDNA的合成
采用Trizol法[14]提取油棕嫩叶的RNA。称取约2 g油棕嫩叶,利用液氮将其研磨至粉末状,置于2 mL EP离心管中,向管中加入1 mL RNA提取液,充分振荡并静置10 min;再向其中加入0.2 mL氯仿,充分振荡混匀后静置7 min;然后在4 ℃超速冷冻离心机中以10000 r/min离心10 min;吸取600 μL上清液至新的1.5 mL无RNase的离心管中,加入等体积冰冻的异丙醇,轻轻摇匀后冰上放置10 min,在4 ℃超速冷冻离心机上以10000 r/min离心10 min;去上清,加入1 mL 75%乙醇,在4 ℃超速冷冻离心机上以8000 r/min离心5 min;去上清,在超净工作台上静置至酒精完全挥发,加入20 μL RNase-free水,用枪头吹打混匀得RNA。用1%琼脂糖凝胶电泳检测所提取RNA的完整性,利用超微量核酸蛋白检测仪检测RNA的纯度及浓度。
取1 μL上述检测过的质量和纯度较好的RNA,应用海口琼山莱客(海南)科技服务中心的RNA逆转录试剂盒进行cDNA合成。
1.3 EgNAC33基因的克隆和序列分析
首先,从GenBank数据库中获得NAC基因的编码序列,通过Clustal X进行多序列比对,根据序列的保守性设计兼并性引物NAC-F:5′-GGACAAAGAATTGCTTAATGC-3′;NAC-R:5′-CACAACAGCTGAACTTGATATC-3′。以cDNA为模板进行PCR扩增,利用获得的片段以T载体法克隆PCR产物,将阳性克隆送深圳华大基因科技服务有限公司进行测序。
根据RT-PCR片段的序列测定结果,合成RACE-PCR所需的特异引物GSP1:5′-CTGGTTTCCGTTTCCATCCC-3′;GSP2:5′-CGAACCGAGCAGCCAACA-3′,分别用于克隆cDNA的5′端序列和3′端序列,具体步骤均按RACE试剂盒说明书执行;PCR产物回收后经T载体克隆、测序,并与已克隆的NAC基因编码拼接,从而获得全长cDNA序列。以拼接得到的基因全长cDNA设计引物NAC-F:5′-CTCAAAGATTAGAGGCTCCCC-3′;NAC-R:5′-AGTGATAAGCTCCTCGTCGGT-3′,通过PCR扩增和测序,验证所获基因全长的准确性。
1.4 EgNAC33基因的表达分析
应用实时荧光定量PCR考察EgNAC33基因在油棕叶片中的表达量变化情况,以Actin1为内参基因,引物为Actin1-F:5′-GTTGTCGCTCCACCCG-3′;Actin1-R:5′-GCAGGACCACATTCATCATA-3′[15]。应用Primer 5软件设计EgNAC33基因的定量引物EgNAC33-F:5′-ACGCTTTCCGCGACACTG-3′;EgNAC33-R:5′-CCGGAGTGCCGTGAACAA-3′。定量PCR分别进行3个生物学重复和3个技术重复,反应体系为10 μL:5 μL FastStart Universal SYBR Green Master缓冲液、0.5 μL上引物(10 μmol/L)、0.5 μL下引物(10 μmol/L)、0.2 μL Rox、1 μL cDNA模板、2.8 μL ddH2O。反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃复性30 s,72 ℃延伸20 s,共35个循环。
1.5 数据分析
应用SMART软件预测EgNAC33的保守结构域;通过NCBI网站blast油棕EgNAC33与其他植物NAC蛋白序列的同源性;同时应用MEGA 6.06软件构建油棕与其他植物NAC蛋白的进化树,分析进化关系。
2 结果与分析
2.1 EgNAC33基因的克隆与测序分析
在RACE后通过拼接、验证和再测序,获得了1条NAC的全长cDNA序列,该序列大小约为1952 bp,含1个长约735 bp的开放阅读框,可编码245个氨基酸残基。在NCBI网站上blast (http://blast.ncbi.nim.nih.gov/blast)对比后,发现该基因靠近N端的位置具有NAC保守结构域。将EgNAC33基因编码的蛋白序列与其他植物的同源蛋白序列进行比对,结果如图1所示,在不同植物间蛋白序列N端约11个氨基酸的同源性较低,第47~143氨基酸序列相对保守。通过分析不同植物间NAC基因的系统进化树(图2),发现大致分为2个亚族,其中油棕NAC33与CnNAC同源蛋白的亲缘关系最近,其同源氨基酸相似度高达93%,且与椰枣和槟榔同属1个亚族,该亚族中的植物均为木本植物;而拟南芥、大豆和花生作为草本植物聚类在一起,与其他木本植物的亲缘关系较远。在进化上,EgNAC33与CnNAC的亲缘关系最近。

At为拟南芥;Cn为椰子;Gm为大豆;Os为水稻;Dp为椰枣;Ac为槟榔。图1 油棕EgNAC33蛋白序列与其他植物同源蛋白序列的比对
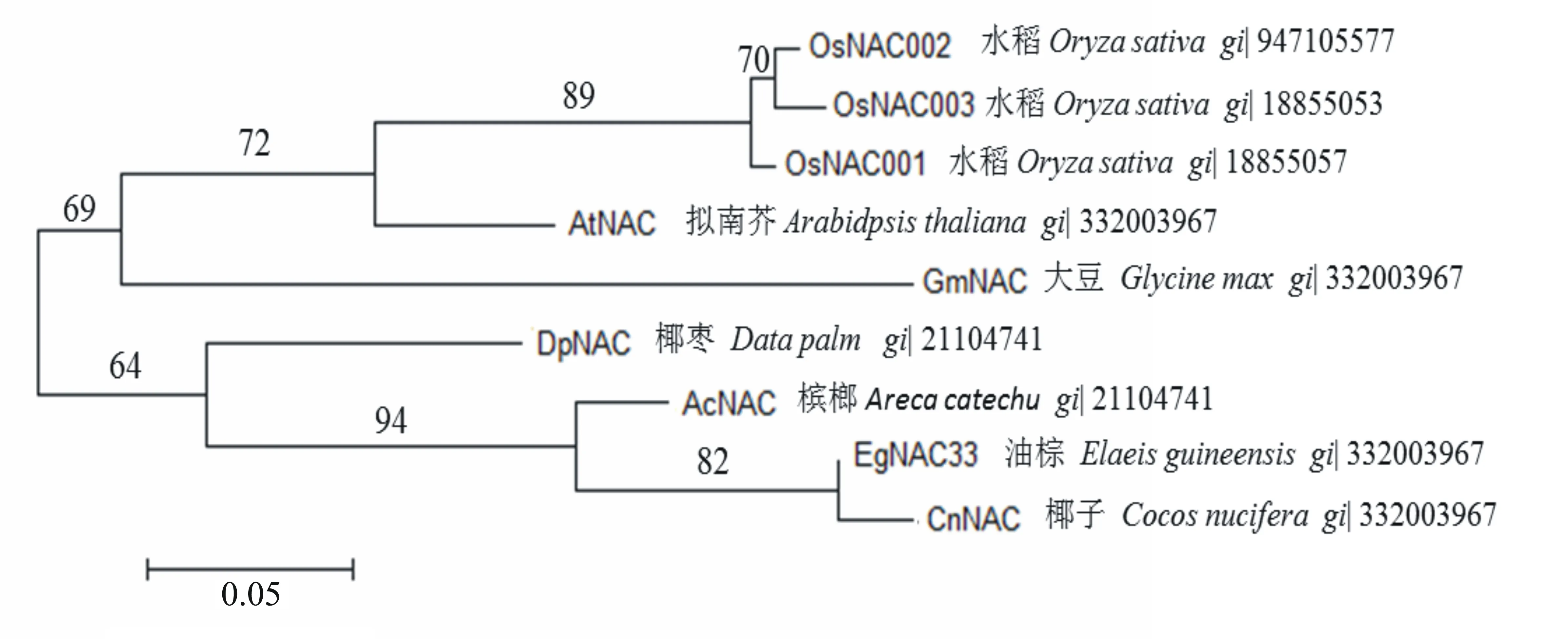
图2 不同植物间NAC基因的进化树分析
2.2 在低温胁迫下EgNAC33基因的表达
由图3可知,油棕幼苗经过8 ℃低温处理后,EgNAC33在各时间点的表达明显受到低温诱导,且在各低温胁迫时间点的相对表达量均比对照组的表达量高,显示该基因受到了低温胁迫的诱导。其中在低温胁迫的0~8 h期间,EgNAC33的表达量逐渐变大,在8 h时其相对表达量达到最高水平;随着低温胁迫时间的增加,其表达量先降低,然后又增加;从整体上看,在8 ℃低温条件下,EgNAC33的表达在不同处理时间下均被强烈诱导,与对照相比,该基因的表达量在1 h时即被诱导增加了4.42倍,在4 h时增加了7.83倍,在8 h时增加了9.88倍,在24 h时增加了2.91倍,在48 h时增加了5.98倍。由此可见,在不同的胁迫时间段内,EgNAC33基因的表达量存在一定的波动性。这说明EgNAC33基因参与了调控油棕的抗寒响应,但又体现了其对低温胁迫响应调控的复杂性,一方面该基因的表达与温度有关,另一方面,它还可能受到植物其他生理因子的影响[16]。

图3 在低温胁迫下EgNAC33基因的相对表达量
2.3 在高盐胁迫下EgNAC33基因的表达
从图4可以看出:油棕幼苗经过300 mmol/L NaCl溶液处理后,EgNAC33在各胁迫时间点的表达量明显受到高盐诱导,且在各胁迫时间点的相对表达量均高于对照组的表达量,初步表明该基因受到了高盐胁迫的诱导。具体来说,在胁迫的0~24 h期间,EgNAC33的表达量逐渐变大,其中,在24 h时的相对表达量达到最高水平,高达4.3倍;随着胁迫时间的延长,其表达量逐渐降低。由此可见,EgNAC33基因对高盐胁迫做出了应答,参与了调控油棕的耐盐机制。
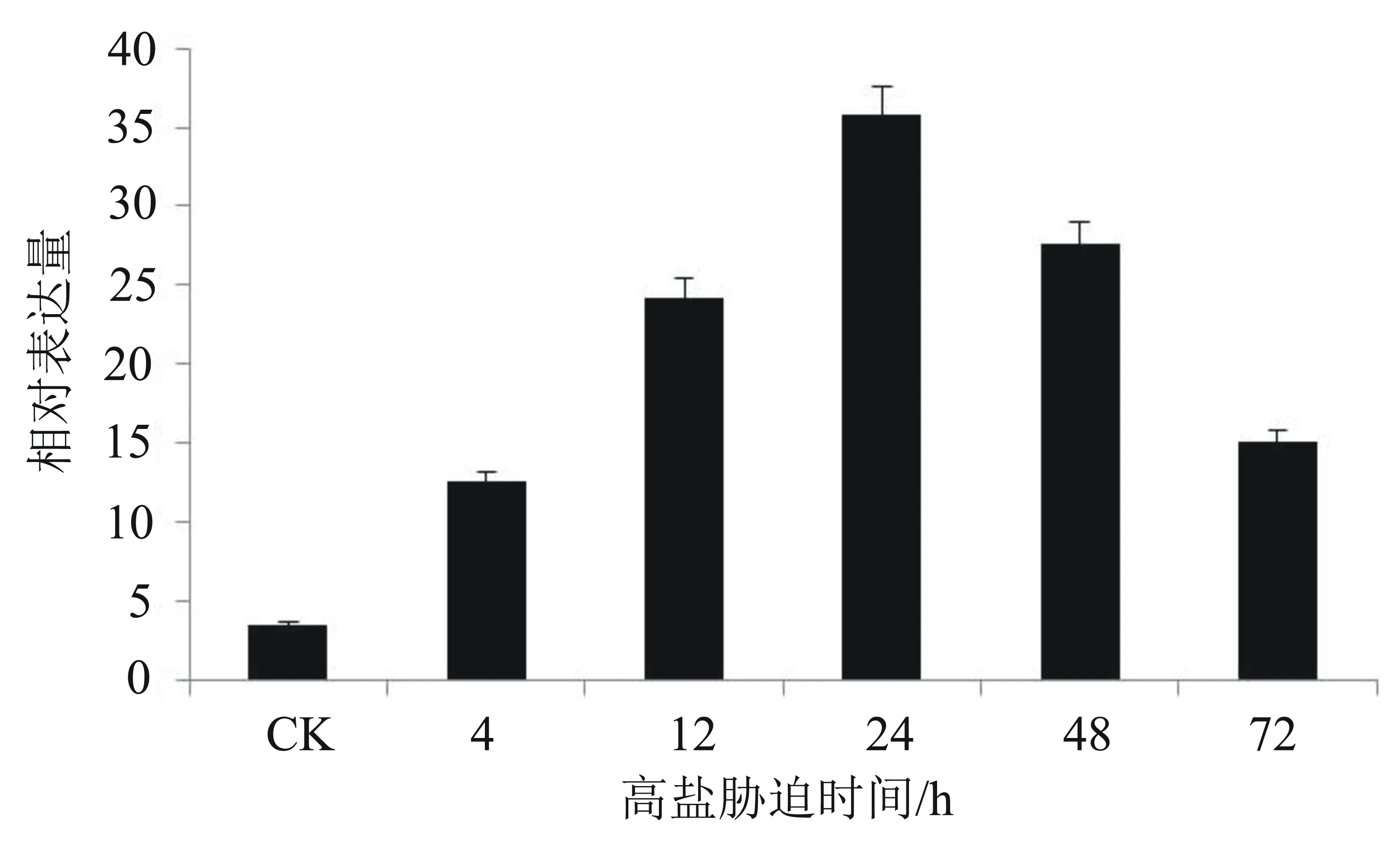
图4 在高盐胁迫下EgNAC33基因的相对表达量
2.4 在干旱胁迫下EgNAC33基因的表达
从图5可以看出,在干旱胁迫条件下,在各时间点EgNAC33基因的相对表达量与对照组相比无明显差异。推测EgNAC33不能被干旱胁迫诱导,该基因不参与干旱逆境的应答信号途径。
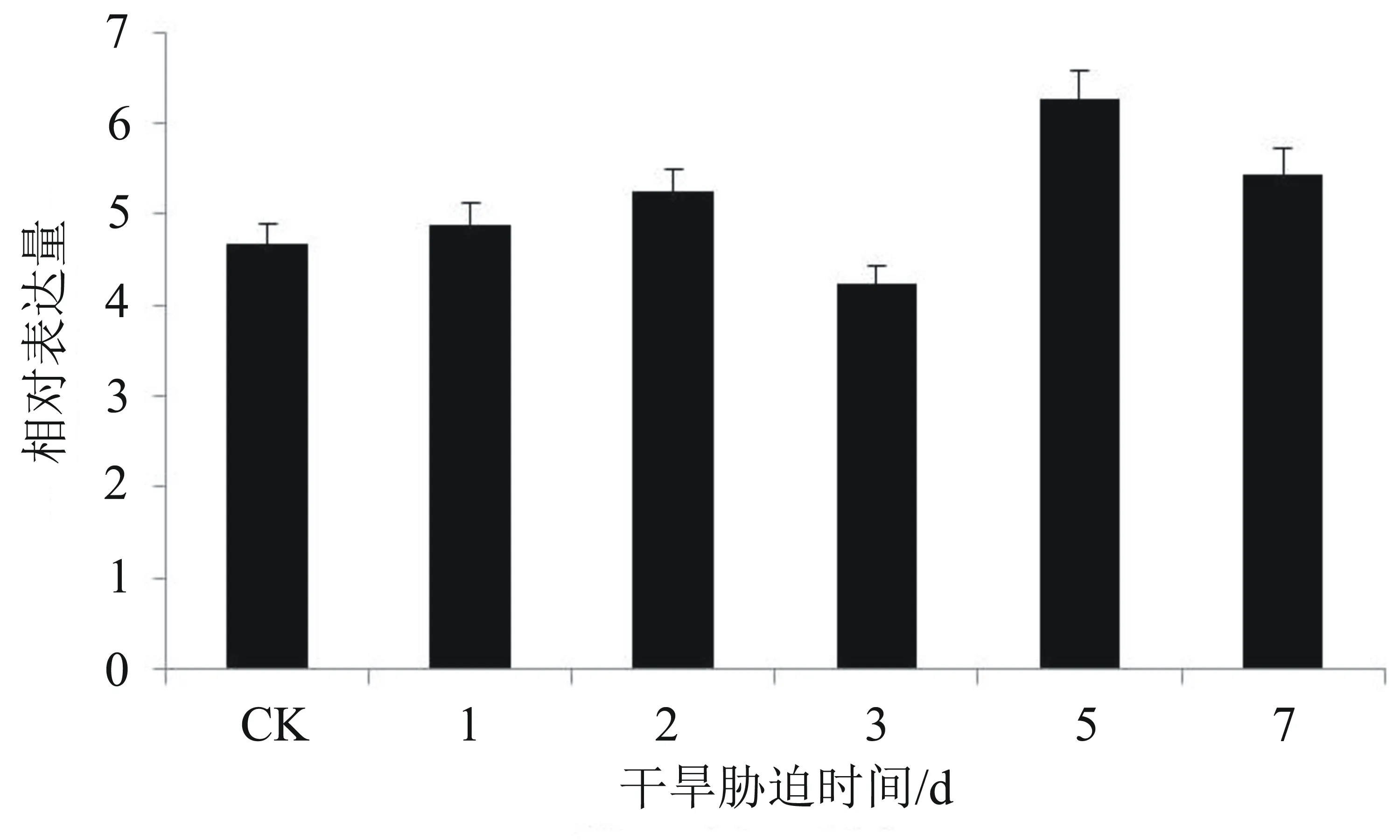
图5 在干旱胁迫下EgNAC33基因的相对表达量
3 讨论与结论
NAC基因家族是植物特有的一类转录因子,在植物生长发育中具有重要的调控作用,而且也参与植物对干旱、高盐、低温等非生物胁迫的抗逆反应,其中有20%~25%的家族成员参与至少1种以上逆境因子的响应[17]。本研究通过分析EgNAC33蛋白的生物信息学特性,发现EgNAC33基因的长度为1952 bp,含有1个长约735 bp的开放阅读框,编码245个氨基酸;EgNAC33蛋白质的N端具有NAC保守结构域;在系统进化上,该基因与椰子NAC的亲缘关系最近,且与椰枣和槟榔同属一个亚族。该结果表明棕榈科植物中NAC蛋白的氨基酸序列具有高度的保守性。
很多研究表明,NAC基因受多种逆境因子的影响,并能启动多个逆境反应调控途径,参与植物的多种抗逆响应,例如:棉花的GhSNAC5和GhSNAC8基因会不同程度地被高盐、干旱及黄萎病胁迫诱导[18];番茄的TNAC基因同时受高盐和低温逆境的诱导[19];大豆的GmNAC基因受盐胁迫的诱导[21]。本研究发现,EgNAC33对干旱胁迫没有明显响应,但对低温和高盐胁迫均表现出典型的诱导表达效应,且在不同处理时间点均表现出诱导表达的特点,同时由EgNAC33介导的冷胁迫及高盐胁迫响应与干旱胁迫响应途径没有交叉反应。
基因的表达调控是一个复杂的过程。本研究只初步考察了油棕受到低温、高盐及干旱胁迫时EgNAC33基因的表达量变化,虽然可以为研究NAC基因家族调控油棕抗逆反应机制提供一定的试验依据,但对该基因家族的具体表达调控机制及其在油棕对抗外界胁迫时发挥的具体作用还需更深入的探索。
