参芪扶正注射液通过下调MMP-2表达抑制口腔鳞状细胞癌转移
2020-07-09张乐琪谭蕾罗晶邓春妮刘治
张乐琪, 谭蕾, 罗晶, 邓春妮, 刘治
(西安交通大学第一附属医院口腔科,陕西西安 710061)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是指发生于口腔内以鳞状细胞为主的恶性肿瘤,具有高复发率和高频率淋巴结转移的特点[1]。尽管手术、化疗和靶向治疗取得了较大的进展,但由于其易远处转移,OSCC仍有很高的复发率[2]。因此,减少OSCC的转移是治疗OSCC和改善患者预后的有效策略。参芪扶正注射液是由传统中药材党参和黄芪为主要原料,提取分离总皂苷和黄芪甲苷等主要有效成分精制而成的中药注射液,具有益气养阴、扶正固本的功效[3]。既往药理学研究表明,参芪扶正注射液在临床上常作为肿瘤治疗的辅助药物,具增加肿瘤抑制的作用,并能减轻各种毒副反应[4-5]。故本研究观察参芪扶正注射液对OSCC的治疗作用及其对OSCC远处转移的影响,以期为临床治疗OSCC提供实验依据。现将研究结果报道如下。
1 材料与方法
1.1细胞来源及培养人口腔鳞状细胞癌SCC-25细胞,购自上海匹拓生物科技有限公司。SCC-25细胞在37℃、体积分数为5%的CO2培养箱中,以含有体积分数为10%胎牛血清的RPMI-1640培养基培养。
1.2动物来源及饲养40只SPF级3~4周龄雌性BALB/c-nu/nu裸鼠,体质量16~22 g,购自四川夏派森医药科技有限公司,动物质量合格证号:SYXK(川)2017-203。饲养在西安交通大学第一附属医院中心实验室,温度控制在25℃左右、湿度在50%左右,裸鼠在实验前均予普通饲料适应性喂养1周。
1.3药物、试剂与仪器参芪扶正注射液(丽珠集团利民制药厂,批号:国药准字Z19990065);顺铂(浙江联硕生物科技有限公司,批号:PHR1624)。RPMI-1640培养液(上海栩冉生物科技有限公司);RIPA裂解缓冲液(南京海克尔生物科技有限公司);二喹啉甲酸(BCA)试剂盒(上海易色医疗科技有限公司);基质金属蛋白酶2(MMP2)抗体、细胞外信号调节激酶(ERK)抗体、磷酸化ERK(p-ERK)抗体(英国Abcam公司);c-Raf抗体(上海博研生物科技有限公司);p-c-Raf抗体(上海邦景实业有限公司);丝裂原激活蛋白激酶激酶(MEK)抗体(康朗生物有限公司);磷酸化MEK(p-MEK)抗体(南京厚百电子商务有限公司);pc-MMP2质粒(上海生物工程有限公司);Lipofectamine 2000转染试剂(上海恪敏生物科技有限公司);QIAzol裂解试剂(北京鸿跃创新科技有限公司);cDNA逆转录试剂盒(上海捷瑞生物工程有限公司)。Elx800酶标仪(美国Biotek公司);DYCZ-40G型转印电泳仪(北京六一仪器厂);FluorChem HD2凝胶成像系统(美国Proteinsimple公司)。
1.4体外实验
1.4.1 应用四甲基偶氮唑盐(MTT)法观察参芪扶正注射液的细胞毒性 将SCC-25细胞接种到24孔板上,用0~80μg·mL-1参芪扶正注射液37℃处理24 h。再用磷酸盐缓冲液(PBS)洗涤细胞,加MTT 0.5 g·L-1温育4 h后,每孔加入150μL二甲基亚砜(DMSO)在摇床低速振荡10 min,应用分光光度法于570 nm波光处测定吸光度。
1.4.2 细胞分组及处理 ①实验1:设置空白对照组,顺铂组,参芪扶正低、中、高剂量组。其中:空白对照组SCC-25细胞正常培养;顺铂组用含有40μg·mL-1顺铂的培养基培养[6];参芪扶正低、中、高剂量组分别用含有10、20、40μg·mL-1参芪扶正注射液的培养基培养[6]。②实验2:设置空白对照组、参芪扶正高剂量组、MMP2高表达组、MMP2+参芪扶正组。其中:空白对照组和参芪扶正高剂量组处理同“实验1”;MMP2高表达组应用LipofectamineTM2000试剂将pc-MMP2质粒转染至SCC-25细胞,以正常培养基培养;MMP2+参芪扶正组应用LipofectamineTM2000试剂将pc-MMP2质粒转染至SCC-25细胞,用含有40μg·mL-1参芪扶正注射液的培养基培养。
1.4.3 划痕实验测定细胞迁移情况 细胞铺满单层后用小号枪头垂直划痕,加入无血清培养基,在体积分数5%CO2、37℃恒温的培养箱中培养24 h后,在显微镜下拍照,用Image J软件分析。
1.4.4 Transwell实验测定细胞侵袭情况 培养48 h后,将细胞消化成单细胞,并配成5×104个/mL浓度的不含血清的悬液。在用Matrigel包被的Transwell小室上室加入该细胞悬液,下室加入含有体积分数10%胎牛血清的DMEM细胞培养。孵育24 h后,除去膜上层细胞,将通过膜侵袭的细胞固定染色,每组随机选取5个视野,在显微镜下观察。细胞侵入情况以每视野的平均细胞数表示。
1.4.5 蛋白免疫印迹(Western Blot)法检测细胞MMP2/β-actin、 p-c-Raf/c-Raf、 p-MEK/MEK、p-ERK/ERK蛋白相对表达水平 用RIPA裂解液提取细胞总蛋白,并用BCA试剂盒检测总蛋白浓度。经十二烷基硫酸钠—聚丙烯酰氨凝胶电泳(SDS-PAGE)分离蛋白后,用半干转膜仪转移蛋白质至聚偏氟乙烯(PVDF)膜。以脱脂牛奶室温封闭2 h后,加入一抗(分别为MMP2 1∶500、β-actin 1∶1 000、 p-c-Raf 1∶1 000、 c-Raf 1∶1 000、p-MEK 1∶500、 MEK 1∶500 、 p-ERK 1∶1 000、ERK 1∶1 000稀释)4℃过夜。再加入对应二抗室温封闭1 h。TBST洗脱后,使用电化学发光(ECL)暗室曝光,X光片扫描,最后分析各条带的灰度值。
1.5体内实验
1.5.1 移植瘤实验 将40只裸鼠随机分为空白对照组、参芪扶正高剂量组、MMP2高表达组、MMP2+参芪扶正组,每组10只。各组裸鼠于右后肢腹侧分别皮下注射0.2 mL的1×107个/mL对应组别培养24 h的SCC-25细胞。同时,参芪扶正高剂量组和MMP2+参芪扶正组裸鼠每天给予癌旁注射40 mg·kg-1·d-1参芪扶正注射液,空白对照组和MMP2高表达组裸鼠每天给予癌旁注射等量生理盐水1次,连续21 d。期间,各组裸鼠均于SPF条件下正常喂食。第21天给药后颈椎脱位法处死裸鼠,完整取出皮下移植瘤,测定移植瘤体积,电子天平称质量。
1.5.2 免疫组织化学法检测裸鼠移植瘤E-cadherin表达水平 裸鼠皮下移植瘤经常规体积分数10%中性甲醛溶液固定后,石蜡包埋切片,脱蜡水化。应用过氧化物酶阻断内源性过氧化物酶活性,非免疫性动物血清阻断非特异性反应。再分别加入鼠抗人E-cadherin抗体(1∶100稀释),4℃过夜。然后,滴加生物素标记二抗,DAB显色,蒸馏水冲洗,苏木素复染,梯度酒精脱水,二甲苯透明。最后,封片观察统计。免疫组织化学阳性细胞胞质为棕色着染,显微镜下随机选取5个视野,每个视野阳性细胞比率=阳性细胞数/总细胞数×100%。
1.5.3 Western Blot法测定裸鼠移植瘤MMP2/β-actin、p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相对表达水平 操作方法同“1.4.5”项。
1.6统计方法采用SPSS21.0统计软件进行数据分析,图形使用GraphPad Prism 6.0构建。实验数据以均数±标准差(-x±s)表示,数据呈正态分布,方差齐,2组比较采用t检验,检验标准为α=0.05(双侧),以P<0.05为差异有统计学意义。
2 结果
2.1不同浓度参芪扶正注射液的细胞毒性图1结果显示,0~40μg·mL-1参芪扶正注射液对SCC-25细胞的增殖活性无明显毒性,50~80μg·mL-1参芪扶正注射液明显降低口腔鳞状细胞癌SCC-25细胞的增殖活性(P<0.05)。因此,选择参芪扶正注射液0~40μg·mL-1浓度进行后续实验。
2.2参芪扶正注射液对SCC-25细胞迁移、侵袭及MMP2、c-Raf/MEK/ERK通路的影响图2-A、-B结果显示:与空白对照组比较,参芪扶正中、高剂量组和顺铂组细胞迁移率、每视野侵袭细胞个数均降低(P<0.05或P<0.01)。表明参芪扶正注射液可抑制SCC-25细胞迁移、侵袭。
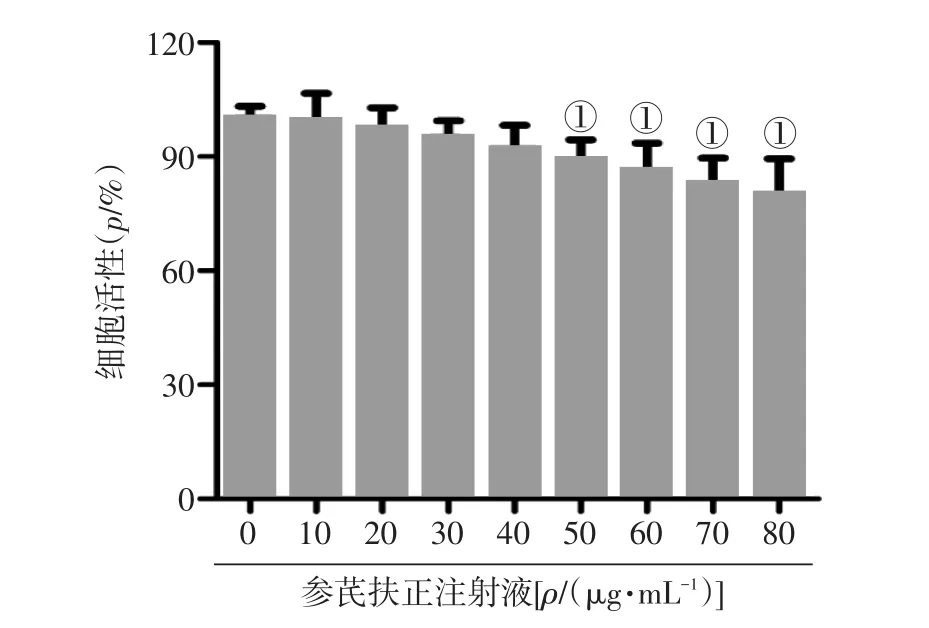
图1 不同浓度参芪扶正注射液的细胞毒性Figure 1 The cytotoxicity of different concentrations of Shenqi Fuzheng Injection
图2-C结果显示,与空白对照组比较,参芪扶正中、高剂量组SCC-25细胞MMP2/β-actin蛋白相对表达量显著降低(P<0.05或P<0.01),而顺铂组SCC-25细胞MMP2/β-actin蛋白相对表达量无显著变化(P>0.05)。结果表明,参芪扶正注射液可抑制SCC-25细胞MMP2蛋白的表达,作用优于顺铂。
图2-D结果显示,与空白对照组比较,参芪扶正中、高剂量组SCC-25细胞p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相对表达量显著降低(P<0.05或P<0.01),而顺铂组SCC-25细胞p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相对表达量无显著变化(P>0.05)。结果表明,参芪扶正注射液可抑制SCC-25细胞c-Raf/MEK/ERK通路的激活,作用优于顺铂。
2.3参芪扶正注射液对MMP2高表达SCC-25细胞侵袭、迁移及c-Raf/MEK/ERK通路的影响图3-A、-B结果显示,与空白对照组比较,参芪扶正高剂量组细胞迁移率、每视野侵袭细胞数目显著降低(P<0.01),MMP2高表达组细胞迁移率、每视野侵袭细胞数目明显增加(P<0.05);与MMP2高表达组比较,MMP2+参芪扶正组细胞迁移率、每视野侵袭细胞数目明显减少(P<0.01)。结果表明,参芪扶正注射液可通过抑制MMP2活性阻止SCC-25细胞迁移、侵袭。

图2 参芪扶正注射液对SCC-25细胞迁移、侵袭及MMP2表达、c-Raf/MEK/ERK通路的影响Figure 2 The effects of Shenqi Fuzheng Injection on the migration,invasion,and MMP2 expression,c-Raf/MEK/ERK pathway in SCC-25 cells

图3 参芪扶正注射液对MMP2高表达SCC-25细胞侵袭、迁移及c-Raf/MEK/ERK通路的影响Figure 3 The effects of Shenqi Fuzheng Injection on the migration,invasion,and c-Raf/MEK/ERK pathway in MMP2 over-expressed SCC-25 cells
图3-C结果显示,与空白对照组比较,参芪扶正高剂量组SCC-25细胞p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相对表达量显著降低(P<0.01),MMP2高表达组p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相对表达量明显升高(P<0.05);与MMP2高表达组比较,MMP2+参芪扶正组细胞p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相对表达量明显下调(P<0.01)。结果表明参芪扶正注射液可通过抑制MMP2活性来阻止SCC-25细胞c-Raf/MEK/ERK通路的激活,从而限制OSCC转移。
2.4参芪扶正注射液对裸鼠MMP2高表达移植瘤生长的影响图4-A、-B、-C结果显示,与空白对照组比较,参芪扶正高剂量组裸鼠移植瘤体积和质量均显著降低(P<0.01),MMP2高表达组裸鼠移植瘤体积和质量均明显增加(P<0.01);与MMP2高表达组比较,MMP2+参芪扶正组移植瘤体积和质量均明显减少(P<0.01)。
图4-D结果显示,与空白对照组比较,参芪扶正高剂量组移植瘤E-cadherin阳性细胞所占比率显著增多(P<0.01),MMP2组移植瘤E-cadherin阳性细胞所占比率明显减少(P<0.01);与MMP2高表达组比较,MMP2+参芪扶正组移植瘤E-cadherin阳性细胞所占比率明显增加(P<0.01)。
图4-E结果显示,与空白对照组比较,参芪扶正高剂量组移植瘤中MMP2/β-actin、p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相对表达量显著下调(P< 0.01),MMP2组移植瘤中MMP2/β-actin、p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相对表达量明显上调(P<0.01);与MMP2高表达组比较,MMP2+参芪扶正组移植瘤中MMP2/β-actin、p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白相对表达量明显降低(P<0.01)。
以上研究结果表明,参芪扶正注射液可能通过抑制细胞MMP2的活性阻止c-Raf/MEK/ERK通路的激活,从而控制OSCC移植瘤的生长。

图4 参芪扶正注射液对裸鼠MMP2高表达移植瘤生长的影响Figure 4 The effects of Shenqi Fuzheng Injection on the growth of MMP2-overexpressed SCC-25 xenografts
3 讨论
远处转移是口腔鳞状细胞癌(OSCC)高复发率和预后差的主要原因。高侵袭能力和高迁移能力是肿瘤细胞高转移能力的必要条件,抑制肿瘤细胞侵袭能力和迁移能力可有效地预防肿瘤细胞向远处转移。肿瘤转移通过一系列包括细胞外基质的降解、细胞—细胞粘附、侵袭、迁移、血管生成和无限制细胞增殖的丧失等复杂事件发生[7]。有研究表明,基质金属蛋白酶2(MMP2)在细胞迁移和侵袭过程中发挥重要作用,主要降解细胞外基质蛋白并参与信号转导[8-9]。其在OSCC转移病例中高表达,可促进OSCC细胞转移[10-11]。本研究结果显示,MMP2高表达使OSCC细胞迁移率、每视野侵袭细胞数目明显增加,高剂量参芪扶正注射液可逆转上述改变,表明参芪扶正注射液可通过抑制MMP2活性来阻止OSCC的转移。
c-Raf/丝裂原活化蛋白激酶激酶(MEK)/细胞外调节蛋白激酶(ERK)信号通路是一条可被广泛激活的丝裂原活化蛋白激酶(MAPK)通路,能够将细胞外信号传递入细胞核内,其广泛参与细胞的生长、增殖、分化、凋亡、侵袭和迁移等过程[12],其失调与肿瘤的发病和恶性进展密切相关[13]。c-Raf可磷酸化激活MEK1和MEK2双特异性蛋白激酶,而MEK1和MEK2反过来磷酸化激活ERK1和ERK2,激活的ERKs是细胞生理的多效性效应因子,在调控细胞分裂周期、细胞凋亡、细胞分化和细胞迁移的基因表达方面发挥重要作用[12]。已有研究发现,OSCC中c-Raf/MEK/ERK信号通路过度活化[14]。本研究结果显示,MMP2高表达使OSCC细胞p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白表达升高,而参芪扶正注射液可逆转上述改变,表明参芪扶正注射液可能通过抑制MMP2活性来阻止SCC-25细胞c-Raf/MEK/ERK通路的激活,从而限制OSCC转移。
相比单一的外部环境,生物体内环境是极其复杂多变的。本研究进行了裸鼠体内MMP2高表达的移植瘤实验,进一步探讨了参芪扶正注射液对裸鼠MMP2高表达移植瘤生长的影响。E-cadherin的表达与恶性肿瘤的侵袭和迁移能力呈负相关,与预后呈正相关[15],故E-cadherin的表达间接反映了肿瘤细胞的侵袭和迁移能力,而高侵袭能力和高迁移能力是肿瘤细胞高转移能力的必要条件。本研究结果显示,MMP2高表达使OSCC裸鼠体内移植瘤的质量和体积明显增加,移植瘤的E-cadherin阳性细胞比率降低,p-c-Raf/c-Raf、p-MEK/MEK、p-ERK/ERK蛋白表达明显升高,而参芪扶正注射液可逆转上述变化,表明参芪扶正注射液可能通过抑制细胞MMP2的活性阻止c-Raf/MEK/ERK通路的激活,从而控制OSCC移植瘤的生长。
综上所述,参芪扶正注射液可抑制OSCC的转移和发生发展,其机制可能与抑制OSCC细胞MMP2活性来阻止c-Raf/MEK/ERK信号通路激活有关。但具体分子机制还有待进一步深入研究。
