Dickkopf 家族在肝癌发生发展中的作用研究进展
2020-07-07王晓艳权会琴申焕君王平忠
王晓艳,权会琴,杜 虹,申焕君,王平忠
(空军军医大学 唐都医院 传染病诊疗中心,陕西 西安 710038)
肝细胞肝癌(hepatocellular carcinoma,HCC)是最常见的原发性肝脏恶性肿瘤之一,占所有肿瘤的5%以上[1-2],每年全球约有50万~100万的新发病例[3]。HCC的发展具有与其他实体瘤类似的多步致癌过程,但有不同的病因。乙型肝炎(HBV)或丙型肝炎(HCV)病毒感染、大量酒精摄入、长期膳食暴露于黄曲霉毒素或氯乙烯,以及原发性血色素沉着症等都与HCC发生发展有关[4]。其中,Wnt/β-catenin通路异常活化对HCC的发生发展可能起促进作用。
1 Wnt/β-catenin信号通路
Wnt是一种富含半胱氨酸的糖蛋白,其信号通路高度保守,在多种生物学过程中发挥重要作用,比如胚胎发育、体内动态平衡和癌症[5-6]。Wnt/β-catenin 信号通路与肿瘤有着密切的关系, 该通路的异常活化参与人类多种癌症的发病过程。在Wnt信号通路中,Fzd受体结合共受体LRP5/6形成复合体能够激活Wnt经典通路和Wnt非经典通路。目前关于经典通路研究得相对较多。正常情况下,经典通路中β-catenin结合GSK3β, CKI, axin 和APC,GSK3β磷酸化β-catenin,随后被泛素化并导致降解;在受到刺激时,GSK3β磷酸化LRP5/6,导致复合体解聚,阻止β-catenin降解并在细胞质中积累,随后转入核内并和转录因子TCF/LEF结合,引起下游Wnt的不同靶基因的表达,调节生理过程。如图1所示[7]。而在非经典通路中,不需要β-catenin的介入,包括Wnt/Ca2+通路、PCP通路和JNK 信号通路[8]。研究发现一些拮抗剂可通过阻止Wnt/FZD/LRP5/6复合物的形成来调节Wnt/β-catenin信号通路,例如DKKs、sFRP和Wnt抑制因子。Wnt/β-catenin信号通路的异常活化能够导致β-catenin积累,促进HCC的发生发展[9]。
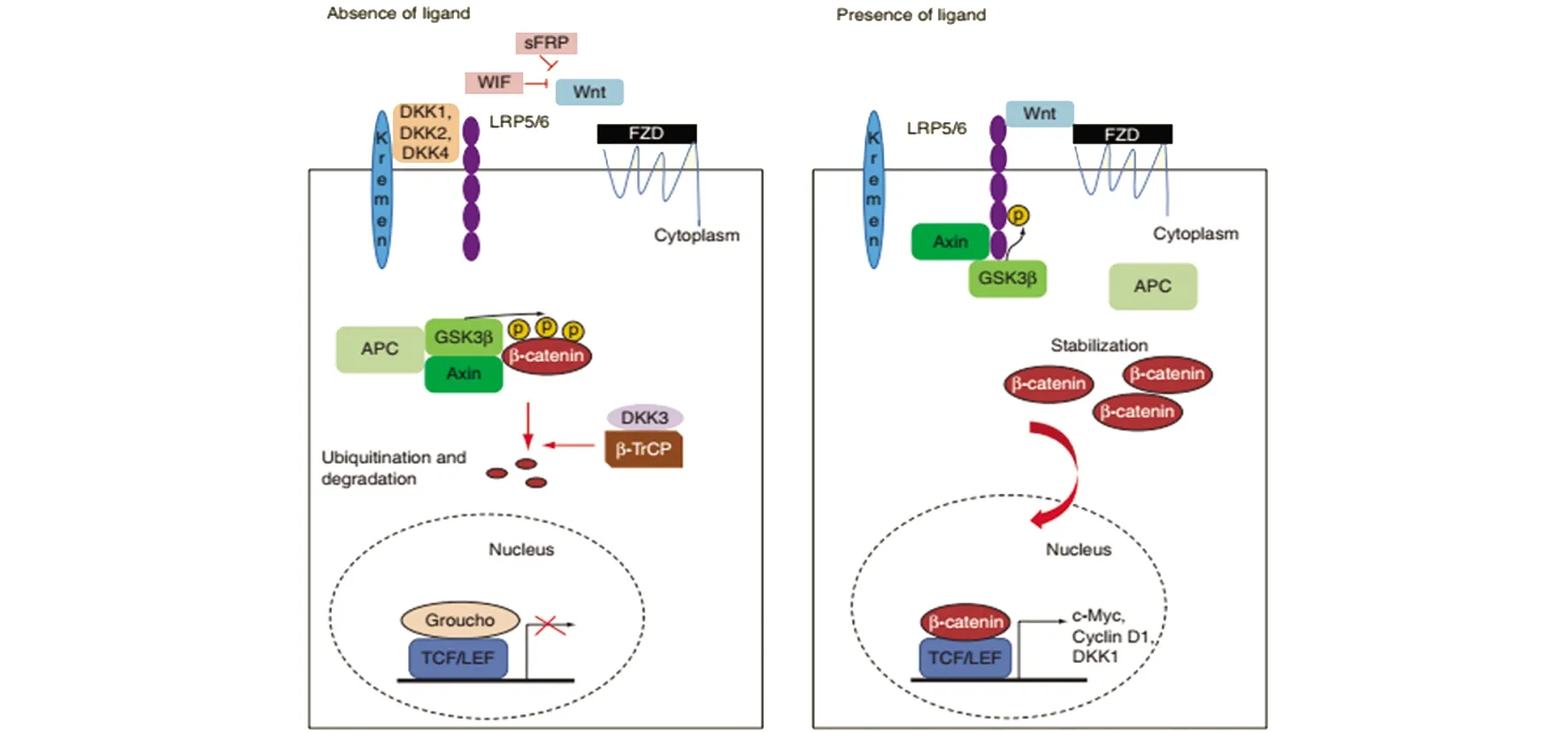
图1 Wnt/β-catenin信号通路[7]Fig 1 Wnt/β-catenin signaling pathway[7]
2 DKK在肝癌发展中的作用
许多报道指出一些细胞外蛋白质可以作为Wnt拮抗剂调节Wnt/β-catenin信号通路,例如SFRP、WIF-1和DKK[10-11]。在脊椎动物中,DKK蛋白家族包括4个成员,分别为DKK1,DKK2,DKK3和DKK4,其具有不同的生化和生理特性。DKK家族共享两个保守的富含半胱氨酸的结构域,N端的cysteine-rich对于每种类型的DKKs都是特异的,而C端在每个成员中是保守的。DKK在肿瘤细胞系或组织中的表达(结直肠癌、卵巢癌、胃癌和肾细胞癌)均有研究。本文主要综述DKK家族在肝癌发生发展中的作用。
2.1 DKK1
1998年人们首次研究了DKK1在非洲爪蟾头部发育中的作用。该研究组发现负责神经板和头部形成的胚胎细胞群分泌的DKK1抑制了爪蟾胚胎中Wnt信号通路[12-13]。后来Krupnik等[14]从人胎肾cDNA文库中分离出DKK1克隆序列。人DKK1基因长度为1815 kb,蛋白由266个氨基酸组成,相对分子质量约为29 kDa。有研究表明在肺腺癌中,DKK1由于表观遗传修饰表达降低,然而DKK1在另一些肿瘤中是过表达的,比如肝癌、肺癌、食道癌、骨肉瘤、卵巢上皮癌和多发性骨髓瘤。关于DKK1在肝癌中是致癌还是抑癌仍然存在分歧。
p53是细胞中最重要的肿瘤抑制基因之一,可作为转录因子调节大量靶基因的表达。Wnt基因是一个可以促进肝细胞癌变后增殖和转移的原癌基因。研究发现,当p53功能消失时,Wnt能够加剧肿瘤的发生。Wang等[15]用p53缺失的腺病毒载体转染Hep3B细胞,RT-PCR方法检测发现DKK1在20 h后开始表达,且逐渐增加,32 h达到高峰,提示p53可调节Wnt信号通路抑制剂DKK1。表明p53介导的DKK1对Wnt信号传导具有拮抗作用。
全基因组DNA低甲基化和启动子区特异性高甲基化可导致形成广泛的癌症,包括HCC[16]。过度的高甲基化可导致关键基因的转录沉默。这些基因包括,抗肿瘤基因、细胞增殖抑制基因(p16INK4A, p21, p27, RASSF1A, SOCS1-3)、细胞凋亡(CASP8)、转移(E-Cadherin)和DNA修复(GSTP1)等。研究发现在肝硬化和肝癌组织中DKK1的甲基化程度均高于正常肝脏组织,并且mRNA水平降低,表明肝癌转移是由于DKK1的甲基化修饰引起其表达沉默所致[17]。Liang等[18]通过MSP和RT-PCR研究,表明在癌组织中DKK1和DKK3的甲基化水平最高,mRNA水平最低。在Aza处理后,DKK1和DKK3的mRNA水平升高58.9~59.3倍。表明在肝癌组织中,DKK1由于其甲基化而表达下降。Qin等[19]将H7402改造成转移肝癌细胞系M-H7402,通过相关检测发现DKK1和磷酸化β-catenin在M-H7402中表达显著下降,而β-catenin表达上调并且在细胞核中积聚,DKK1表达下降促进H7402细胞的转移。另有研究发现, DKK1通过激活β-catenin/MMP7 信号通路促进HCC细胞迁移和侵袭发挥致癌作用[20],表明DKK1可能作为一个HCC治疗的潜在靶标。
然而,Yu等[21]得到了相反的结论,他们发现DKK1在转移性肝癌细胞系中和肝癌复发病人中过表达,这意味着DKK1在肝癌中作为一个致癌因子而不是抑癌因子。可见,DKK1在HCC发生发展中的作用仍需进一步研究。
另外,研究发现miR-217通过负调控DKK1,激活Wnt/β-catenin信号通路,促进肝细胞癌的致瘤性[22]。此外,在临床方面,有研究指出DKK1和AFP联合应用比单独应用AFP具有更好的诊断率,单独使用AFP优于DKK1和DKK3[23]。另一研究发现利用CSCs cDNA微阵列数据库鉴定了DKK1 mRNA在HCC组织中的表达,可以反映HCC患者的肿瘤特异性,其有望成为HCC一个新的预后指标[24]。
2.2 DKK2
DKK2作为DKK家族的一员,和其他成员不同,研究的报道最少。近年来,DKK2的表观遗传沉默现象在结直肠癌、胃癌[25]、肾癌[26]、卵巢癌[27]等诸多肿瘤中已被证实。在卵巢癌方面,Zhu等[27]体内外实验均发现DKK2的表达增强会抑制Wnt/β-catenin通路,进而抑制肿瘤生长。DKK2也可能是乳腺癌正常亚型的一种潜在的预后生物标志物。
Lin等[28]通过转染Huh7细胞来研究DKK2在Wnt/β-catenin信号通路中的作用,发现DKK2可作为Wnt3a的拮抗剂来抑制细胞增殖,并且具有剂量依赖性。在DKK2缺陷型小鼠模型的研究显示,小鼠DKK2的缺失与肝癌的发生和干细胞特性的富集有关。总之,DKK2可能通过Wnt依赖和独立机制在肝癌发生过程中发挥作用,可作为流行病学研究的生物标志物。此外,miR-197能够诱导HCC细胞侵袭,DKK2通过β-catenin信号通路发挥作用。
另有研究发现,与相应的非癌性肝硬化组织(16%,50例中8例)相比,HCC组织中DKK2启动子区显著甲基化(42%,50例中21例),表明DKK2通过甲基化发挥其在肝癌中的作用[29]。DKK2与HCC预后的关系尚未见研究,仍有待进一步证实。在卵巢癌方面,Zhu等[27]体内外实验均发现DKK2过表达,其下游Wnt信号基因cyclin D1和c-Myc表达减少,进而抑制卵巢癌细胞的侵袭。
2.3 DKK3
DKK3可作为一种肿瘤抑制因子在肝癌中发挥作用。Hsieh等[30]报道指出,相较于人正常肝组织,DKK3 mRNA在人肝癌组织中表达水平降低。相较于肝硬化组织样本,肝癌组织中DKK3甲基化发生频率、甲基化水平更高,提示DKK3启动子甲基化可能是肝硬化向肝癌转变的一个重要事件[29]。此外, DKK3启动子甲基化与肝癌手术切除后不久复发或转移后生存率降低有关。因此,DKK3基因甲基化在肝癌中具有重要意义,但具体机制尚不明确,有待进一步研究。
上述DKK3的研究均局限在肝癌组织中,血清中DKK3蛋白水平或DKK3启动子甲基化目前尚未见报道。在乳腺癌和急性淋巴细胞白血病(ALL)中DKK3表达降低,DKK3可以作为这些疾病的潜在的治疗靶点和诊断的生物标志物,但在肝癌中还未得到有力的证实。
微小RNA(miRNA)直接结合靶mRNA的3′-非翻译区(UTR)沉默基因。因此,miRNA参与包括细胞存活,增殖,分化,凋亡,迁移,自噬,侵袭,血管生成和肿瘤发生等多种生物过程。近几十年来,一些报道指出miRNA的失调与癌症的发展和进展相关。MiRNA-125在许多物种中高度保守,miR-125b可直接结合DKK3的3′UTR区域(核苷酸626和648之间的序列),下调DKK3表达,调节肿瘤的发生和发展。Pei等[31]发现GATA4是一种在肝母细胞瘤增殖期间抑制miR-125b表达并诱导DKK3活化的上游因子。GATA4/miR-125b/DKK3通路可能作为一个新型小儿肝母细胞瘤患者的治疗靶点。值得关注的是,GATA4在哺乳动物肝脏发育中扮演着特定的角色。一些研究表明GATA4表达缺失发生在许多癌症中,包括上皮性卵巢癌,肾上腺皮质肿瘤,肝细胞癌和结直肠癌等,表明GATA4可以作为TSG起作用。
2.4 DKK4
DKK4是DKK家族中最小的成员,目前有研究证实DKK4是Wnt信号通路中重要的调节因子,与肝癌和结肠癌相关[32]。据报道,DKK4过表达能够抑制细胞增殖、迁移和侵袭;相反通过shRNA敲低DKK4则可促进细胞增殖和侵袭[33],且在DKK4过表达裸鼠模型中观察到肿瘤尺寸变小。此外,DKK4高表达组的肝癌患者总生存率高于DKK4低表达组,证实DKK4能够抑制肿瘤进展。
DKK4作为Wnt信号通路的重要调节因子,在肝癌发生发展中发挥重要作用。Fatima等[34]通过RT-PCR发现在HCC组织中DKK4 mRNA的表达下降47%,免疫组化分析发现相较于非肝癌组织,癌组织中DKK4蛋白表达减少58%左右。另有研究发现在44个肿瘤组织中DKK4 mRNA表达下降56.8%,以及芯片发现DKK4在肝癌组织和癌旁组织的表达均低于正常肝脏组织。这表明DKK4可能通过抑制Wnt/β-catenin信号而发挥抑癌作用。通过瞬时转染DKK4的肿瘤细胞中细胞质中β-catenin水平下降,下游分子c-Jun,cyclinD1和CD44水平下调[34],而细胞核中β-catenin的变化未见报道,表明DKK4无法单独抑制经典Wnt信号通路,需要其他因子辅助。
在HCC细胞系中过表达DKK4后总GSK3β的水平没有变化,但是磷酸化的GSK3β下降。LiCl抑制GSK3β后通过稳定β-catenin能减少DKK4表达,进而抑制肿瘤细胞的增殖[33]。总之,活化的GSK3β对DKK4介导的抑制作用和β-catenin磷酸化十分重要。有研究报道大多数DKK4在细胞质中表达。β-catenin主要聚集在肝癌细胞的细胞质和细胞核中,但在邻近的肝组织中,发现β-catenin主要聚集在细胞膜和细胞质中,且表达下降。DKK4与细胞核中的β-catenin水平呈负相关。表明DKK4可以调节β-catenin入核而发挥作用。
此外,有文献报道,在T3介导下, TR能够结合DKK4基因启动子区1645-1629核苷酸,上调了DKK4水平,进而抑制肝癌细胞Wnt信号转导的活化及肿瘤进展[35-36]。同时,在高糖条件下,c-Myc、DKK4和β-catenin之间的相互作用可促进肝癌细胞增殖。高糖会减少DKK4蛋白并激活经典的Wnt信号,进而将β-catenin转运到细胞核中,加速HCC细胞增殖。这些结果证明DKK4抑制了高糖诱导的β-catenin依赖的HCC细胞增殖[33]。
3 总结与展望
综上所述,DKK家族成员在肝癌的发生发展中可能具有不同的作用,其多种表达调控机制在疾病的预警方面也有重要意义。尽管Wnt/β-catenin信号通路抑制剂DKK在肝癌发生发展进程中起到了关键的作用,但仍然有一些细节尚不清楚,如DKK1致癌或者抑癌作用与什么因素有关?DKK2在肝癌预后方面是否发挥作用?DKK3在肝癌组织中甲基化下调的具体作用机制是什么?等问题尚待进一步阐明。因此,深入理解Wnt/β-catenin信号通路抑制剂DKK家族成员的具体作用机制,阐明其在肝癌发生发展中的研究具有重要意义。
