烟酰胺单核苷酸对血管紧张素 Ⅱ 致小鼠心肌纤维化的抑制作用及其机制
2020-06-27于芃马思聪代新春蒋敏曹瑞华张继彬韩东李苏雷曹丰
于芃,马思聪,代新春,蒋敏,曹瑞华,张继彬,韩东,李苏雷,曹丰*
(1空军军医大学西京医院心血管内科,西安 710032;2解放军总医院第二医学中心,解放军总医院国家老年疾病临床医学研究中心,北京 100853)
近年来,高血压、冠心病等心血管疾病发病率不断升高,这些疾病最后可进展为心力衰竭(heart failure,HF),严重威胁人类的生命健康[1,2]。心肌纤维化(cardiac fibrosis)是心血管疾病中的主要过程,可引起心脏的收缩及(或)舒张功能下降,最终导致HF[3]。研究显示,肾素-血管紧张素系统(renin-angiotensin system,RAS)的激活是HF进展的关键因素[4],其中血管紧张素Ⅱ(angiotension Ⅱ,AngⅡ)作为RAS的主要生物肽,通过增强结缔组织生长因子(connective tissue growth factor, CTGF)-趋化因子FKN信号的激活,在心肌间质纤维化过程中起重要作用,导致心肌肥大、心脏功能障碍及心脏损伤的加重[5]。Sirtuin 6(SIRT6)是一种保守的烟酰胺腺嘌呤二核苷酸依赖性去乙酰化酶,已被证实在调节心脏功能、能量代谢以及衰老中起重要作用[6]。研究发现,HF患者心脏中SIRT6表达水平显著降低[7]。目前以SIRT6为靶点的药物研发受到广泛关注。烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)是哺乳动物体内烟酰胺腺嘌呤二核苷酸(nicotina-mide adenine dinucleotide,NAD+)补救合成途径的中间体[8],NMN具有修复脑功能、改善胰岛素抵抗及促进心脏损伤修复的重要作用[9]。本研究通过使用微量泵泵入AngⅡ构建小鼠心肌纤维化模型,并通过腹腔注射NMN,观察NMN抑制小鼠心肌纤维化的作用及其相关机制。
1 材料与方法
1.1 材料
本研究所用实验动物为SPF级雄性C57/BL6J小鼠,40只,体质量25~30 g,8周龄;烟酰胺单核苷酸(NMN)购自中国汤普森有限公司;异氟烷购自河北一品公司;Trizol试剂(Invitrogen,CA)和Prime Script RT试剂盒(TAKARA,Japan)均购自武汉谷歌生物科技有限公司;SIRT6抗体、CollagenⅠ抗体、Collagen Ⅲ抗体、α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体及内参Tublin抗体均购自英国Abcam公司;微量泵Osmotic Pump,Model 1004购自美国Alzet 公司。所用设备包括:小鼠心脏超声系统(Vevo®2100 VisualSonics,Canada);血压测定仪(MOUSE CUFF Bp-98A,Softron Co Japan);酶标仪(Thermo,US)和Bio-Rad成像系统(BioRad,US)等。
1.2 小鼠模型分组
使用异氟烷麻醉小鼠,取俯卧位固定小鼠,背部剃毛消毒,用剪刀剪开约2 cm皮下组织,心肌纤维化模型小鼠组埋入已预装 Ang Ⅱ 1.6 mg/(kg·d)[10]的微量泵,对照组埋入预装等量蒸馏水的微量泵,均皮下持续泵入给药4周。各取10只给予NMN腹腔注射[300 mg/(kg·d)],注射时间为手术后即刻至术后4周。实验动物共分为4组,分别为心肌纤维化模型小鼠组(模型组),生理盐水正常对照组(对照组),心肌纤维化模型小鼠 + NMN(模型 + NMN组),生理盐水正常对照 + NMN(对照 + NMN组),每组各10只小鼠。
1.3 超声心动图检测小鼠心脏变化
异氟烷吸入麻醉小鼠,心前区脱毛后取仰卧位,经胸行超声检查,探头频率为2~4 MHz,测量左室收缩末期内径(left ventricular end-systolic diameter,LVESD),左室舒张末期内径(left ventricular end diastolic diameter,LVEDD)和左室后壁厚度(left ventricular posterior wall thickness,LVPWT)。左室收缩功能通过左室射血分数(left ventricular ejection fraction,LVEF)和左室短轴缩短率(left ventricular fraction shortening,LVFS)进行评估,具体为LVEF(%)=(LVEDV-LDESV)/LVEDV×100%和LVFS(%)=(LVEDD-LVESD)/LVEDD ×100%。
1.4 小鼠血压测量
采用尾套测压法测量小鼠血压(blood pressure,BP),具体操作为:使用血压测定仪在术前1周及术后4周在小鼠清醒状态下对小鼠尾动脉进行血压测量,共测量3次,取平均值[11]。
1.5 实时定量PCR
药物处理4周,小鼠血压及心功能测定完成后,4组小鼠各取3只处死,切取心脏速冻备用。使用Trizol试剂从速冻小鼠心脏中提取总核糖核酸(ribonucleic acid,RNA)。使用Prime Script RT试剂盒合成cDNA。在ABI 7900T实时系统(Applied,Biosystems,CA)中,使用SYBR Premix ExTaq Ⅱ(TAKARA,Japan)进行定量实时PCR(real-time quantitative polymerase chain reaction,RT-qPCR)检测。引物序列如表1。GAPDH作为内参。
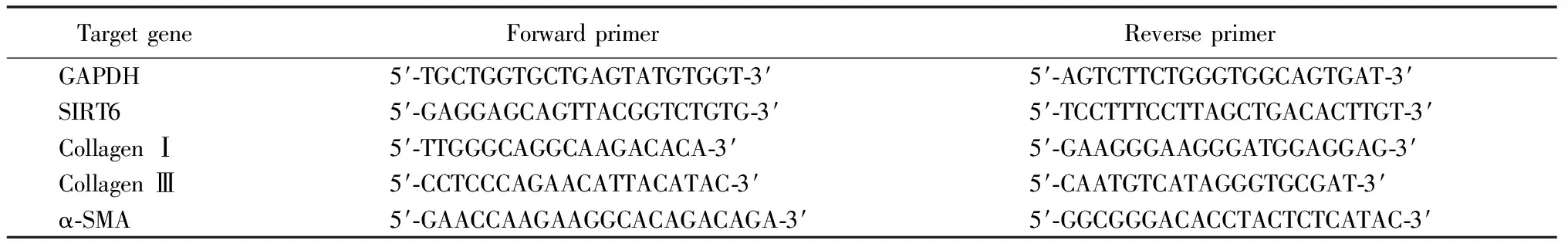
表1 实时定量PCR引物序列
RT-qPCR: real-time quantitative polymerase chain reaction; GAPDH: glyceraldehyde-3-phosphate dehydrogenase; SIRT6: Sirtuin 6; α-SMA: α-smooth muscle actin.
1.6 Western blot分析
使用二喹啉甲酸(bicinchonininc acid,BCA)法(BioRad,US)测定整个心脏裂解物的蛋白质浓度。将整个组织裂解物进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳,随后转膜至聚偏氟乙烯(polyvinylidene uoride,PVDF)膜。5%蛋白封闭液封闭2 h,孵一抗过夜,孵二抗,通过化学发光法检测目标蛋白质。
1.7 心肌纤维化染色
小鼠麻醉后处死,分离心脏组织,4%多聚甲醛固定后脱水,石蜡包埋,切片厚度5 μm,分别对切片进行HE染色及Masson染色。使用Image-Pro Plus 6.0软件对Masson染色图像进行心肌胶原容积分数(collagen volume fraction,CVF)分析[12]。
1.8 统计学处理
2 结 果
2.1 4组小鼠基线情况
4组小鼠在手术前均进行超声心动图检测及血压测定,结果显示4组小鼠的基线情况一致,心功能指标及血压未见统计学差异(P>0.05;表2)。
表2 4组小鼠基线情况
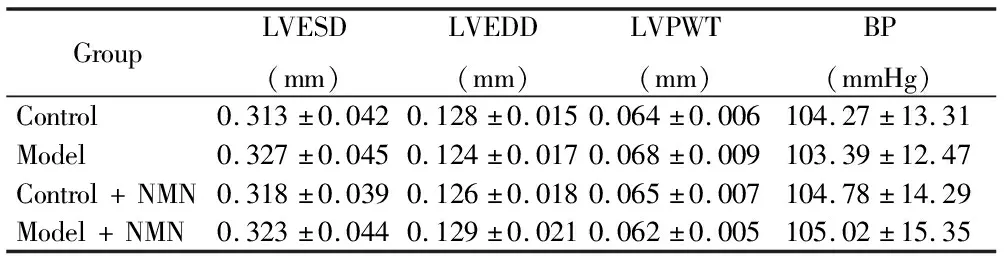
GroupLVESD(mm)LVEDD(mm)LVPWT(mm)BP(mmHg)Control0.313±0.0420.128±0.0150.064±0.006104.27±13.31Model0.327±0.0450.124±0.0170.068±0.009103.39±12.47Control+NMN0.318±0.0390.126±0.0180.065±0.007104.78±14.29Model+NMN0.323±0.0440.129±0.0210.062±0.005105.02±15.35
NMN: nicotinamide mononucleotide; LVESD: left ventricular end-systolic diameter; LVEDD: left ventricular end diastolic diameter; LVPWT: left ventricular posterior wall thickness.BP: blood pressure.1 mmHg=0.133 kPa.
2.2 4组小鼠术后心功能改变
通过心脏超声对小鼠心功能进行评估,发现模型 + NMN组及模型组小鼠均表现出显著的心脏肥大和心肌纤维化,但模型 + NMN组小鼠的心脏肥大和心肌纤维化程度显著低于模型组,而对照组和对照 + NMN组小鼠较术前无显著差异,均优于模型 + NMN组及模型组小鼠(图1A)。对照组和对照 + NMN组的LVEF以及LVFS较术前均无显著变化,而模型 + NMN组及模型组小鼠的LVEF以及LVFS较术前和同期对照组和对照 + NMN组显著下降,但模型 + NMN组的LVEF、LVFS下降程度显著低于模型组(P<0.05;图1B,C)。对小鼠血压进行测量发现,对照组和对照 + NMN组小鼠较术前无显著差异,但模型 + NMN组及模型组小鼠的血压显著上升,而模型组小鼠上升程度高于模型 + NMN组(P<0.05;图1D)。
2.3 4组小鼠术后病理改变
通过HE染色观察4组小鼠心肌变化发现,对照组及对照 + NMN组小鼠心肌细胞排列规则,无心肌细胞肥大;而模型组可见明显肥大的心肌细胞,且心肌细胞排列紊乱,细胞间质明显增多;模型 + NMN组则未见明显的肥大心肌细胞,且心肌细胞排列与模型组相比更规则,细胞间质变化较对照组及对照 + NMN组也未见明显改变(图2A)。通过Masson染色法观察4组小鼠心肌间胶原含量发现,对照组及对照给药组的CVF无明显变化,而实验组CVF出现明显上升,而实验给药组上升程度较低(P<0.05;图2A,B)。
2.4 NMN对于小鼠心肌纤维化相关基因及蛋白表达的影响
通过实时定量PCR及Western blot分析NMN对小鼠心肌纤维化相关基因及蛋白表达的影响发现,模型组小鼠的SIRT6表达明显降低,模型 + NMN组及对照 + NMN组小鼠的SIRT6表达均增加,但对照 + NMN组的SIRT6表达要明显高于模型 + NMN组;同时,Collagen Ⅰ、CollagenⅢ以及α-SMA在4组中的表达趋势与SIRT6相反(P<0.05;图3A,B)。
3 讨 论
研究发现,心肌纤维化是各种心血管疾病导致HF的重要过程,而NMN可有效改善心血管功能[13]。在本研究中,我们通过微量泵入AngⅡ,构建小鼠心肌纤维化模型,随后通过给予NMN腹腔注射进行干预。结果发现,NMN可有效改善由AngⅡ引起的心肌纤维化,其机制可能是通过上调心肌细胞中的SIRT6抑制了与心肌纤维化相关的Collagen Ⅰ、Collagen Ⅲ以及α-SMA的表达。
心肌纤维化的致病因素主要包括炎症、应激或容量负荷、糖尿病以及年龄[14],其中炎症细胞可分泌AngⅡ、转化生长因子-β(transforming growth factor-β,TGF-β)、白细胞介素(interleukine-6,IL-6)等激活心脏成纤维细胞,导致炎症区域发生不同程度的纤维化[15]。有文献表明,RAS与心肌纤维化的发生发展密切相关,而AngⅡ是RAS中的重要因子,参与了心脏重塑的过程[16]。本研究通过微量泵输注AngⅡ成功制备了心肌纤维化模型,并发现模型组和模型 + NMN组小鼠心脏中SIRT6表达较对照组和对照 + NMN组小鼠相比显著降低。SIRT6是心血管疾病中的重要保护因子,大量研究表明,SIRT6与RAS系统之间存在相互作用[17],SIRT6可以通过激活AMPK-ACE2信号和抑制CTGF-FKN途径来抑制心脏的病理性重塑、纤维化和心肌损伤过程,从而起到保护心脏的作用[18]。SIRT6已越来越多地被用作药物靶点,通过药物刺激心脏SIRT6表达上调,从而达到治疗目的。有学者通过慢病毒载体介导的SIRT6过表达,发现心肌细胞中端粒酶逆转录酶(telomerase reverse transcriptase,TERT)和端粒重复结合因子(telomere repeat binding factor,TRF)-1的表达升高,并通过组织学分析证实了SIRT6对于心肌具有保护作用[6]。Muraoka等[19]发现,小鼠近端肾小管特异性敲除Nampt使得SIRT6表达下调,因此,他们认为Nampt-Sirt6轴是糖尿病肾病中纤维化发生的细胞外基质重塑的关键因素。而Nampt经过体内代谢,可以转化为NMN[20],因此我们推测NMN可能也具备上调SIRT6表达的能力。本研究通过腹腔注射NMN,发现给药后小鼠心脏SIRT6表达明显上调,且心肌纤维化程度得到明显逆转。当前,NMN在帕金森病、脑卒中和糖尿病肾病的治疗中已取得一定的进展[21]。本研究通过腹腔注射NMN,发现给药组小鼠心脏SIRT6表达明显上调,心肌纤维化程度显著逆转,为心肌纤维化的治疗提供了新的思路和方向。
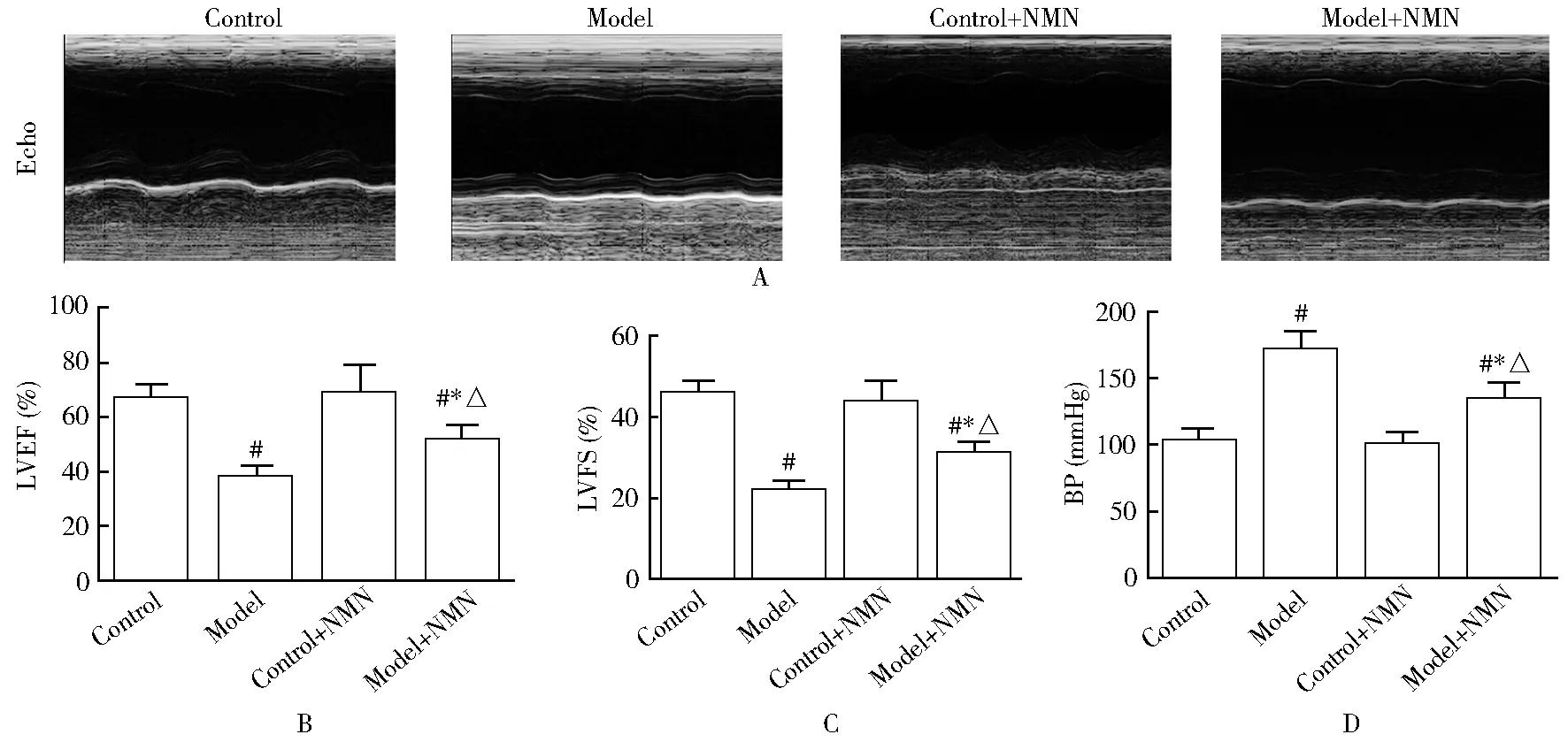
图1 4组小鼠术后心功能改变
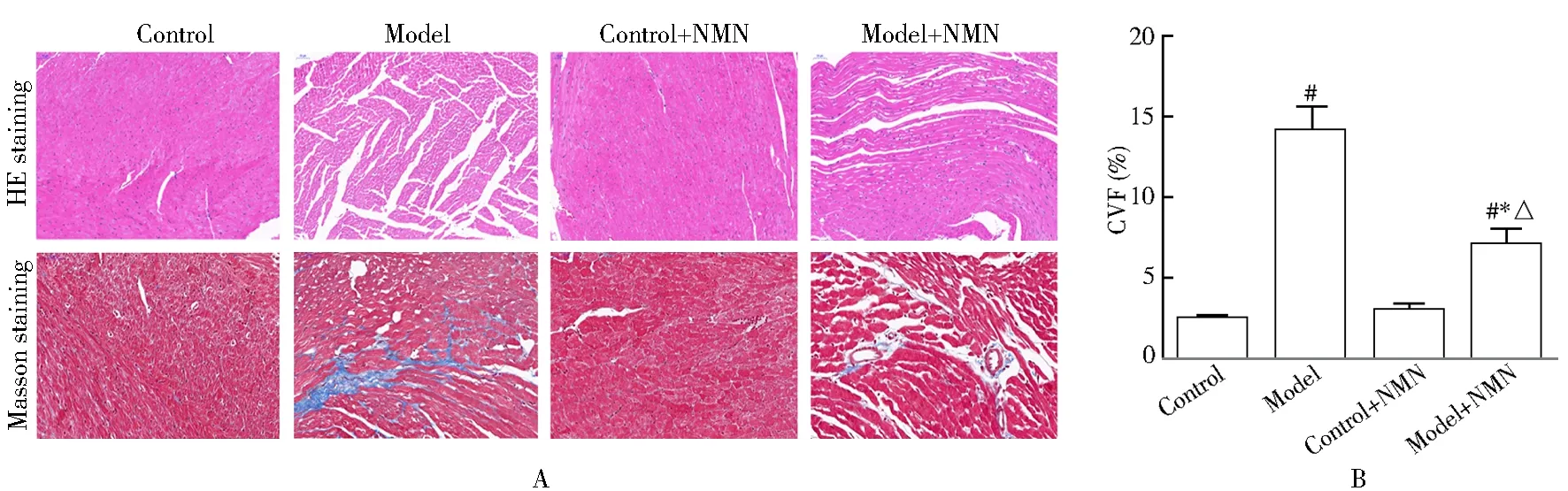
图2 4组小鼠术后病理改变
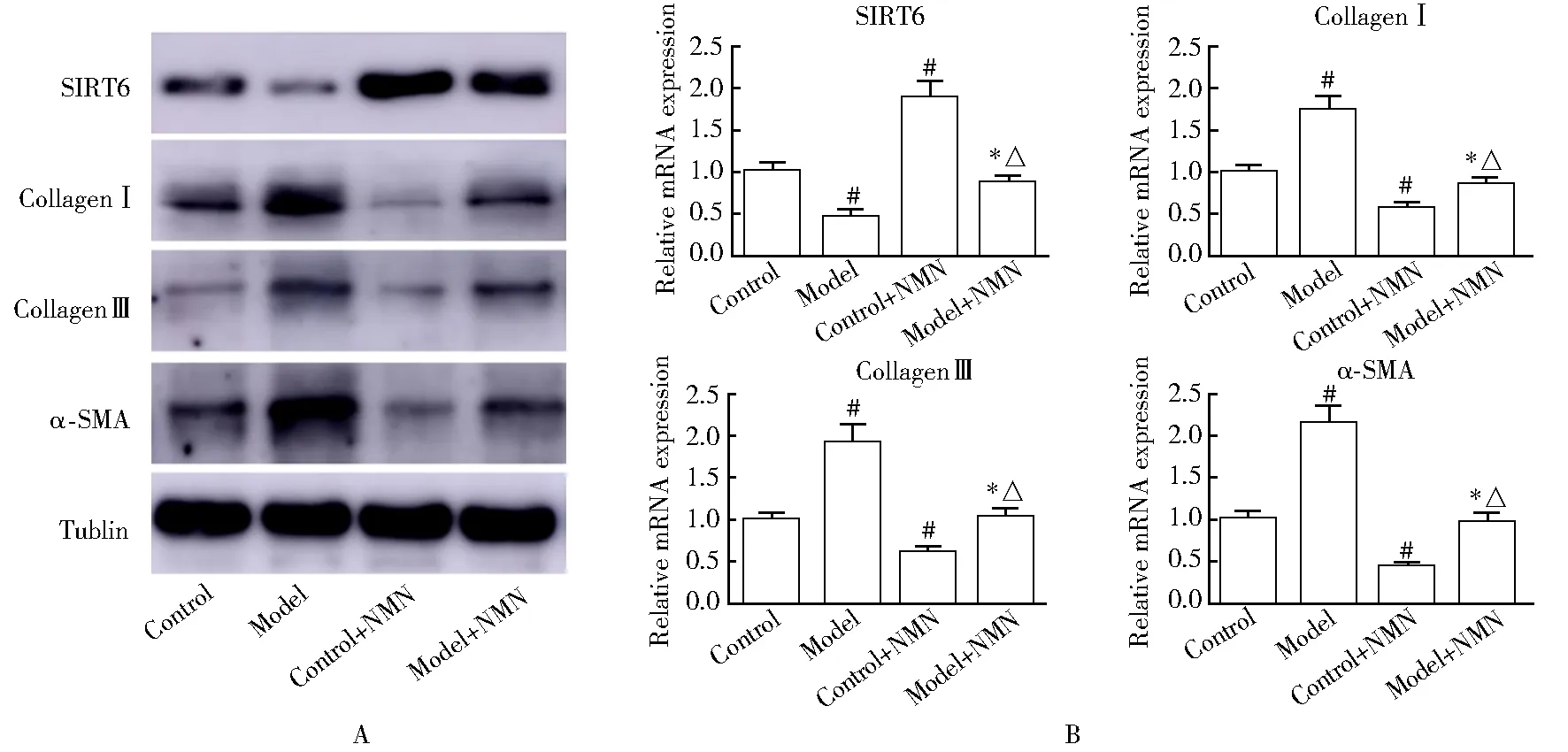
图3 NMN对于小鼠心肌纤维化相关基因及蛋白表达的影响
综上所述,烟酰胺单核苷酸可显著抑制Ang Ⅱ 所致的小鼠心肌纤维化,且该作用是通过激活SIRT6,抑制Collagen Ⅰ、Collagen Ⅲ 以及α-SMA的表达来实现的。本研究虽然为治疗心肌纤维化提供了新的思路和方向,但仍有一定局限性,机制探索不够深入,并且需要进一步使用SIRT6抑制剂来对NMN抑制AngⅡ致小鼠心肌纤维化的SIRT6途径进行验证。
