烤后健康烟叶和霉烂烟叶真菌群落结构分析
2020-06-24陈乾丽汪汉成梁永进蔡刘体
陈乾丽,汪汉成,梁永进,蔡刘体,黄 宇,周 浩,李 忠,韩 洁
(1.贵州大学 农学院,贵州 贵阳 550025; 2.贵州省烟草科学研究院,贵州 贵阳 550081; 3.广西中烟工业有限责任公司,广西 南宁530001; 4.长江大学 农学院,湖北 荆州 434025; 5.贵州中医药大学 基础医学院,贵州 贵阳 550025)
烟叶烘烤是烤烟生产的重要环节之一,采收的鲜烟叶需经烘烤才能体现和固定其优良品质,成为商品烟叶[1]。随着密集烘烤烤房的发展,贵州大部分烟区烘烤烟叶出现霉烂现象,严重影响烤烟品质和产量。目前对于烤后烟叶微生物群落结构与多样性的研究大多集中于仓储期和醇化过程中,且多采用传统分离方法。高通量测序作为新兴技术独具优点,应用高通量测序技术可研究烘烤霉变与健康烟叶的真菌群落组成差异,为烤房烟叶霉烂病防治提供科学依据。烟叶面上存在细菌、真菌、放线菌等大量的微生物群落,它们在烟叶烘烤过程中对烟叶品质有较大影响[2]。烤坏烟是烘烤调制过程中的主要问题,烤坏烟叶的类型有烤青烟叶、青痕烟叶、挂灰烟叶等,烤坏烟叶的原因包括烟叶品质差、采收技术不规范、编烟和烤房装烟密度不当、烘烤期温度和湿度控制不当等。烟叶发生霉烂是烘烤期常见的现象,有关烘烤期烟叶霉烂的研究多有报道,烘烤过程中烟叶霉烂与烟叶自由水含量、主脉硬度、还原糖、可溶性总糖含量密切相关[3]。烟叶吸湿性强,在环境适宜情况下,各类霉菌摄取其糖类蛋白质和水分等营养物质,分解烟草成分,破坏其组织结构,其产生的青、绿、黑色素和霉腐臭气,致使烟叶霉烂变质[4]。陈二龙等[5]研究发现,烘烤过程中烟叶主脉组织结构的损伤为霉菌的生长繁殖提供了环境。彭清云等[6]研究发现,引起烟叶霉变的真菌包括青霉属、曲霉属、根霉属、毛霉属,细菌主要有芽孢杆菌属和乳杆菌属。顾钢等[7]认为,烤房烟叶霉烂病可分为叶基霉烂型和叶片霉烂型2种。苏家恩等[8]研究发现,如果不及时处理烘烤过程中霉变烟叶的霉菌孢子,将导致储存期间烟叶发霉,造成烟叶质量和品种的损失。
高通量测序技术在土壤[9-10]、水体[11-12]、肠道[13-14]、空气[15-16]等微生态系统的微生物多样性研究中得到广泛应用,具有测序通量高、准确度高、性价比高等特点[17-18]。如今高通量测序技术在烟草上的应用也十分常见,常安然等[19]运用高通量测序技术对烟草根际土壤细菌群落组成进行了分析;李珊辉[20]基于高通量测序技术研究了卷烟加工和储存过程中微生物群落结构与其品质关系;龚俊等[21]通过高通量测序技术准确反映烟叶表面微生物群落结构。本文通过高通量测序技术发掘烤后健康与霉烂烟叶样品真菌群落组成和结构差异,以期为今后指导烟叶霉烂病的防治提供科学依据。
1 材料与方法
1.1 试验材料
DNA抽提试剂盒(FastDNA®Sin kit for Soil,MP Biomedicals);TransGen AP221-02(货号,AXYGEN);TransStart Fastpfu DNA Polymerase(货号,AXYGEN);AxyPrepDNA凝胶回收试剂盒(货号,AXYGEN)。PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量;Miseq PE300高通量测序系统由上海美吉生物医药科技有限公司提供。
1.2 试验样本采集
于贵州省黔西南州兴义市烟草公司(24°57′8″N,104°53′9″E),选取烟叶霉烂病暴发严重的烤房,烟叶品种为云烟87。随机采集烤房中健康烟叶(MJ1、MJ2、MJ3)和霉烂烟叶(MB1、MB2、MB3)样品放置于无菌采样袋中,-80 ℃条件保存。
1.3 样品DNA提取
采后称取各样品0.5 g研磨样,采用FastDNA®Sin kit for Soil提取样品DNA,按说明书操作程序进行总DNA的提取。完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。
1.4 目的片段扩增与Illumina HiSeq高通量测序
以样品DNA为模板,采用正向引物ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′(5 μmol·L-1)和反向引物ITS2:5′-GCTGCGTTCTTCATCGATGC-3′(5 μmol·L-1)对样品的ITS1-ITS2区进行PCR扩增。PCR扩增体系为20 μL:5×FastPfu 缓冲液(4 μL),2.5 mmol·L-1dNTPs(2 μL),正向引物(5 μmol·L-1)0.8 μL,反向引物(5 μmol·L-1)0.8 μL,FastPfu 聚合酶 0.4 μg,BSA 0.2 μL,模板DNA 10 ng,ddH2O补至20 μL。PCR反应程序参数:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,30个循环;最后72 ℃延伸10 min。PCR扩增产物用2%的琼脂糖凝胶进行电泳检测其扩增质量,使用GeneJET胶回收试剂盒纯化产物。将合格的纯化样品送至上海美吉生物医药科技有限公司利用Illumina公司的Miseq PE300平台进行高通量测序,并于I-Sanger 生物信息分析云平台(http://www.i-sanger.com/)进行数据处理和生物多样性分析。
1.5 测序数据处理与统计分析
1.5.1 原始数据处理
原始测序序列使用Trimmomatic软件进行质控,首先过滤reads尾部质量值在20以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的reads,去除含N碱基的reads;然后根据PE reads之间的overlap关系,将成对reads拼接(merge)成一条序列,最小overlap长度为10 bp;拼接序列的overlap区允许的最大错配比率为0.2,筛选不符合序列;最后根据序列首尾两端的barcode和引物区分样品,并调整序列方向,barcode允许的错配数为0,最大引物错配数为2。使用FLASH软件进行拼接。
1.5.2 OTU聚类及注释
使用UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行OTU聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier (http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Unite(Release 6.0 http://unite.ut.ee/index.php)真菌数据库统计各样本的群落组成。通过对样品进行Alpha多样性分析,Alpha多样性指数采用软件mothur (version v.1.30.1)计算物种组成分析、样品比较分析、物种差异分析等评估健康烟叶组与霉烂烟叶组真菌群落结构及多样性。LEfSe(LDA EFFECT SIZe)多级物种差异判别分析首先使用非参数因子克鲁斯卡尔-沃利斯秩和验检(non-parametric factorial Kruskal-Wallis sum-rank test)检测具有显著丰度差异特征,并找到与丰度有显著性差异的类群,然后采用线性判别分析(LDA)来估算每个物种丰度对差异效果影响的大小,最终确定组间差异存在显著影响的真菌类群。
1.5.3 FUNGuild功能预测
通过FUNGuild数据库分析烘烤烟叶的真菌的营养方式(trophic mode)和对环境资源的吸收利用的方式(guild)。置信度(confidence)选取:“极可能”(highly probable)、“很可能”(probable)和“可能”(possible)3个等级。以上分析均在上海美吉生物医药科技有限公司的I-Sanger生信云网站平台(http://www.i-sanger.com/project/index.html)完成。
2 结果与分析
2.1 数据质控
烘烤结束后共取了2类烟叶样品:健康烟叶组(MJ)包含的样本为MJ1、MJ2和MJ3;霉烂烟叶组(MB)包含的样本为MB1、MB2和MB3。
原始序列经优化处理后,健康烟叶组(MJ)和霉烂烟叶组(MB)6个样本共得到207 134条高质量序列片段,59 106 670个碱基,单一样本序列数在203~349条,序列平均长度为286 bp;健康烟叶组(MJ)样品共得到100 774条高质量序列片段,29 489 959个碱基,单一样品序列数在205~349条,序列平均长度为292 bp;霉烂烟叶组(MB)样品共得到106 360条高质量序列片段,29 616 711个碱基,单一样品序列数在232~346条,序列平均长度为278 bp。
2.2 测序深度分析
稀释曲线(rarefaction curve)既反映了不同测序数据量下各样品中物种的丰富度,又可表示测序深度是否覆盖了一个环境样品中的所有测序对象。由图1稀释曲线可知,本次测序样品的稀释曲线在测序深度为5 000时就趋于平缓,曲线趋于平坦表明测序已趋于饱和,增加测序数据无法再找到更多的OTU。因此,可以认为测序深度已经覆盖到样品中所有的物种,测序数据量足以反映样品中的物种多样性。
2.3 真菌多样性指数分析
丰富度指数(richness index):Sobs指数、Ace指数、Chao指数,用于表示样品中真菌群落丰富度,数值越大,说明其相应的群落丰富度越高。丰富度指数结果表明,健康烟叶组(MJ)检测到的真菌OTU数量均高于霉烂烟叶组(MB)。多样性指数(diversity index),如Shannon指数、Simpson指数,用于表示样品中真菌群落多样性,其中,Shannon指数值越大,说明群落多样性越高,Simpson指数值越大,说明群落多样性越低。多样性指数结果表明,健康烟叶组(MJ)真菌群落多样性均高于霉烂烟叶组(MB)。覆盖度指数用于表示样品测序的覆盖度,Alpha多样性指数表中,健康烟叶样品与霉烂烟叶样品中各部位样品的覆盖度指数均到达了0.999,表明测序结果合理(表1)。
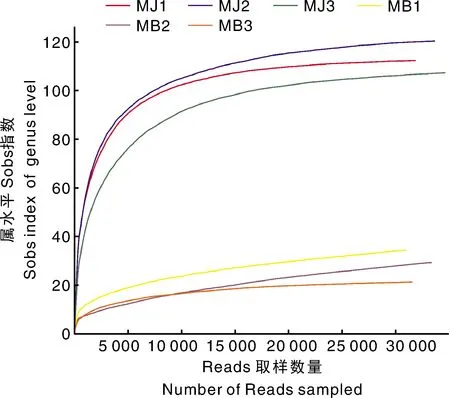
图1 稀释曲线(OTU水平Sobs指数)Fig.1 Rarefaction curve (Sobs index of OTU level)
2.4 OTU聚类分析
为了得到每个OTU对应的物种分类信息,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并分别在各个分类学水平对样品序列进行OTU聚类,在健康烟叶组(MJ)3个样品中共鉴定出真菌6个门,25个纲,58个目,111个科,182个属,253个种,383个OTU;霉烂烟叶组(MB)3个样品中共鉴定得出真菌的4个门,15个纲,22个目,33个科,54个属,69个种,82个OTU(表2)。
2.5 真菌群落基本组成和结构分析
结果表明,在门水平上,健康烟叶组(MJ)优势菌门为子囊菌门(Ascomycota)和担子菌门(Basidiomycota);霉烂烟叶组(MB)优势菌门为子囊菌门(Ascomycota);其中子囊菌门(Ascomycota)在健康烟叶组(MJ)中相对丰度为57.13%,在霉烂烟叶组(MB)中相对丰度为99.11%;担子菌门(Basidiomycota)在健康烟叶组(MJ)中相对丰度为3.08%,在霉烂烟叶组(MB)中相对丰度为0.10%,接合菌门(Zygomycota)在两组样本中丰富度均低于0.10%(图2)。
在属水平上(图3),健康烟叶组(MJ)优势真菌为链格孢属(Alternaria),相对丰度为31.65%;其次为曲霉属(Aspergillus),相对丰度为9.95%;新凸轮孢菌属(Neocamarosporium),相对丰度为1.34%;支顶孢属(Acremonium),相对丰度为1.32%;赤霉属(Gibberella),相对丰度为0.95%。霉烂烟叶组(MB)优势真菌为曲霉属(Aspergillus),相对丰度为94.18%;其次为青霉属(Penicillium),相对丰度为2.35%;根霉属(Rhizopus),相对丰度为0.77%;链格孢属(Alternaria),相对丰度为0.42%。非优势真菌所占比例不到总真菌数量的0.1%,其在各样品间的含量不存在差异。
表1 不同组别真菌群落Alpha多样性指数(OTU level)
Table 1 Alpha diversity index between different groups (OTU level)

样品Sample丰富度指数Richness indexSobsAceChao多样性指数Diversity indexShannonSimpson覆盖度指数Coverage indexMJ11121131131.950.310.999MJ21201231222.060.250.999MJ31071101101.660.320.999合计Total113±7115±7115±61.89±0.200.29±0.040.999MB13449450.520.80.999MB22967590.230.920.999MB32123220.170.950.999合计Total28±746±2242±190.30±1.90.89±0.80.999
表2 健康烟株与霉烂烟叶各真菌群落不同分类水平下的总量
Table 2 Total amount of fungus communities of healthy and rotten tobacco leaves were at different taxonomic levels
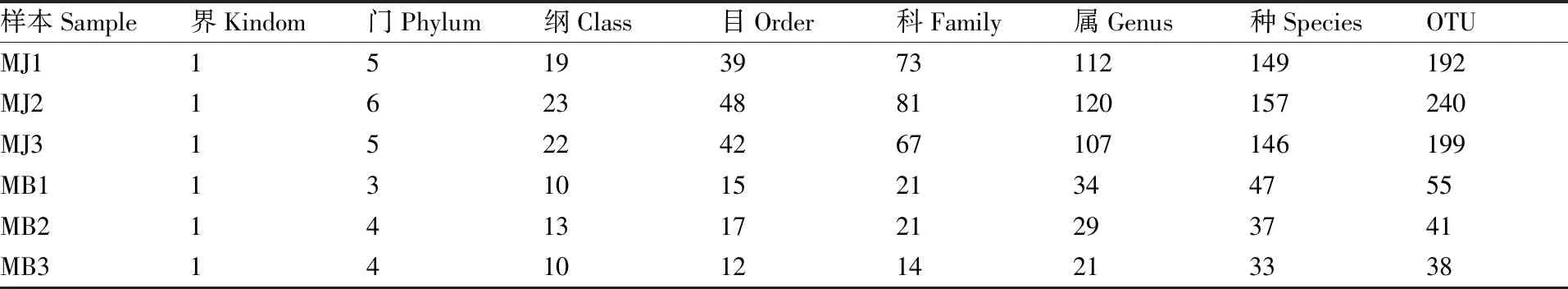
样本Sample界Kindom门Phylum纲Class目Order科Family属Genus种SpeciesOTUMJ115193973112149192MJ216234881120157240MJ315224267107146199MB113101521344755MB214131721293741MB314101214213338
在健康烟叶组(MJ)中独有属为节担菌属(Wallemia)、光盖伞属(Psilocybe)、烟管霉属(Bjerkandera)、拟盘多毛孢属(Pestalotiopsis)、尾梗霉属(Cercophora)等133个;在霉烂烟叶组(MB)中独有属为木霉属(Trichoderma)、异茎点霉属(Paraphoma)、Meyerozyma、Symbiotaphrina、丝衣霉属(Byssochlamys);两者共有菌属有曲霉属(Aspergillus)、链格孢属(Alternaria)、青霉属(Penicillium)、根霉属(Rhizopus)、支顶孢属(Acremonium)等49个。
样品聚类根据每个样品属的组成情况聚类分析,展示各个样品之间的关系,组成越相似,样品聚类的关系越近。各样品前30个属的相对丰度热图如图4所示,通过颜色的变化直观表示出属相对丰度的高低。热图上部样品层级聚类树表明,健康烟叶样品与霉烂烟叶样品组间的真菌菌群的相似性较低,群落组成存在明显差异,其中健康烟叶样品MJ1、MJ2和MJ3的3个样品群落结构较相似聚为一类,MB1、MB2、MB3聚集为一大类。结果表明,健康烟叶样品与霉烂烟叶样品在组内属水平相似,因此,烘烤期烟叶霉烂病的发生对烟叶真菌群落结构存在较大影响。
2.6 LEfSe多级物种差异判别分析
运用LEfSe分析健康烟叶和霉变烟叶组间显

图2 不同组别样品门水平上的相对丰度Fig.2 Relative abundance of different samples at phylum level
著性差异菌群,其中分值大于4.0中共有18个不同分类水平的真菌存在显著性差异(图5)。其中霉变烟叶组曲霉属、散囊菌纲Eurotiomycetes、散囊菌目Eurotiales、发菌科Trichocomaceae、子囊菌门,健康烟叶组座囊菌纲Dothideomycetes、座囊菌目Pleosporales、链格孢属、担子菌门、肉座菌目Hypocreales等是导致健康烟叶与霉变烟叶真菌群落差异的主要类群。
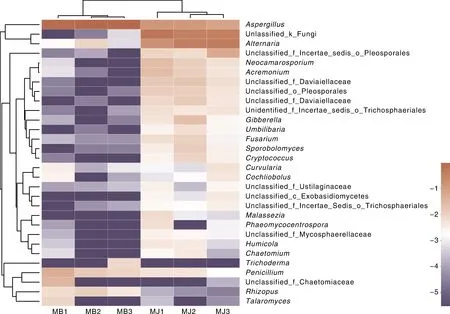
图4 样品属水平的相对丰度热图Fig.4 Heatmap of the relative abundance of genera identified in each sample
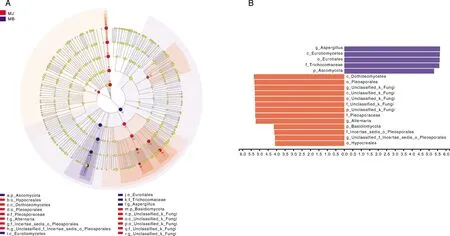
A, 多级物种层级树;B,LDA判别结果。A, Multistage species hierarchical tree map; B, LDA discriminant results.图5 LEfSe 物种差异分析Fig.5 LEfSe species difference analysis
2.7 FUNGuild功能类群预测
利用FUNGuild对烘烤期烟叶真菌群落进行功能预测,结果显示,在394个OTU中,有280个OTU被划分为8个真菌功能类群,约占总OTU数量的71.06%,分别为共生菌群(Symbiotroph)、腐生菌群(Saprotroph)、腐生-共生过渡型(Saprotroph-Symbiotroph)、病理寄生-共生菌群(Pathotroph-Symbiotroph)、病原菌/腐生/共生菌群(Pathotroph-Saprotroph-Symbiotroph)、病理寄生-腐生菌群(Pathotroph-Saprotroph)、病理寄生菌群(Pathotroph)、病原-腐生-共生菌群(Pathogen-Saprotroph-Symbiotroph)。其中霉变烟叶组腐生菌群(Saprotroph)显著高于健康烟叶组。
根据对环境资源的吸收利用的方式烘烤烟叶真菌可分为46个共位群,其中在健康烟叶组中Animal pathogen-dung saprotroph-endophyte-epiphyte-plant saprotroph-wood saprotroph丰富度最高,其次为Undefined saprotroph和Fungal parasite-Litter saprotroph。霉变烟叶组中Undefined Saprotroph的丰富度最高,其次为Plant pathogen(图6)。

图6 基于OTU水平注释表的真菌功能群相对丰度Fig.6 Relative abundance of fungal functional groups (guilds) based on OTU annotation table with distribution frequency level
3 结论与讨论
烟草烘烤期微生物的活动影响着烟叶品质[22]。早期对烟叶烘烤过程中微生物群落多样性通常是平板分离并培养可培养微生物来确定,虽该方法能获得部分可培养微生物种类和丰度,但该技术受环境变化的影响,并且不同微生物的增殖有差异,仅有1%的微生物能在实验室条件下分离培养[23-24]。本文基于Illumina高通量测序技术,选取烤后健康烟叶与霉烂烟叶样品为研究对象,分析健康和霉烂烟叶的真菌群落结构与多样性差异。
本文通过OTU数量、Chao、Ace等指数反映了烘烤期健康烟叶和霉烂烟叶的真菌群落和多样性。Alpha多样性分析结果表明,健康烟叶各部位样品真菌丰富度、均匀度和多样性均高于霉烂烟叶样品。烟叶霉烂病害的发生,导致烟叶真菌种类和真菌群落丰富度降低。
物种群落组成结果表明,健康烟叶组与霉烂烟叶组真菌物种组成丰富,二者在种群结构上有一定的差异。在门水平上,健康烟叶组为子囊菌门(Ascomycota)、担子菌门(Basidiomycota),霉烂烟叶组的优势菌门为子囊菌门(Ascomycota)。子囊菌门(Ascomycota)为植物中常见的内生菌群[25],陈善义等[26]通过对烟叶真菌群落组成研究报道发现,子囊菌门(Ascomycota)为不同产地和不同部位的烟叶的共有的优势菌门;陈乾丽等[27]研究指出,子囊菌门、担子菌门、接合菌门是霉变烟叶中的优势菌门。以上研究结论与本研究结果相似。
在属水平上,健康烟叶组和霉烂烟叶组共有的优势菌属主要为链格孢属(Alternaria)和曲霉属(Aspergillus),其中霉烂烟叶组中的曲霉属(Aspergillus)占比明显高于健康烟叶组;健康烟叶组的链格孢属(Alternaria)显著高于霉烂烟叶组,在霉烂烟叶组中曲霉属(Aspergillus)、青霉属(Penicillium)、根霉属(Rhizopus)的丰富度较高。本文结果与吴阔等[28]所报道的霉烂烟叶中引起霉烂的真菌类群结论相似。在本研究中霉烂烟叶组中存在大量青霉属(Penicillium),赵文姬[29]研究表明青霉属(Penicillium)是霉变烟叶的优势菌属;朱桂宁[30]明确曲霉属(Aspergillus)是引起烟叶霉变的主要微生物类群;曾婷英等[31-32]研究表明,根霉属(Rhizopus)能引起烘烤期烤房烟叶霉烂病。本研究表明,在健康烟叶与霉烂烟叶中都存在大量的根霉属(Rhizopus),但霉烂烟叶(0.77%)中所占比例明显高于健康烟叶(<0.01%)。烟叶烘烤过程中叶表存在大量的微生物,它们在鲜烟叶调制过程中对烟叶产品的形成及其品质产生了不同的作用[33]。烟叶烘烤变黄期,烤房温度与湿度迅速升高,为青霉属(Penicillium)、根霉属(Rhizopus)和曲霉属(Aspergillus)等腐生真菌提供了适宜的生长环境,加快微生物分解烟叶蛋白质的速度,引发烟叶发生霉烂,严重影响烟叶品质。在本研究中,霉变烟叶组腐生菌群(Saprotroph)高于健康烟叶组,可能是由于烟叶霉变引起的。Pythiumaphanidermatum和Erwiniacarotovora能在烤房内引起烟叶腐烂霉烂,因此烘烤期的细菌也是影响烟叶发生霉变的重要原因,下一步可对烘烤期健康烟叶和霉变烟叶的细菌群落组成与结构进行分析,研究烟叶烘烤中与烟叶霉变有关的细菌类群。
本研究的结果显示,烘烤期健康烟叶与霉烂烟叶样品间真菌群落结构与多样性差异较大,样品组内差异较小,能够反映烘烤期烟叶真菌群落结构及多样性的差异情况。烟草霉烂是由环境、微生物等多因素共同作用所导致的,各类真菌随环境变化与烟叶代谢作用的关系也有待于进一步研究。对烤后健康烟叶和霉烂烟叶真菌群落组成分析,将有助于根据真菌群落结构的组成和差异制定防霉方案和措施,减少烘烤期烟叶霉烂的发生概率。
