木霉水分散粒剂的培养条件优化及其对黄瓜枯萎病的防治效果
2020-06-24朱森林王丹媚唐秀梅徐月妹金璐懿任晴雯
朱森林,王丹媚,唐秀梅,陈 瑞,杨 蓉,徐月妹,金璐懿,任晴雯,刘 鹏,罗 军,*
(1.金华职业技术学院 农业与生物工程学院,浙江 金华 321007; 2.浙江师范大学 植物学实验室,浙江 金华 321004; 3.广西壮族自治区农业科学院 经济作物研究所,广西 南宁 530007)
黄瓜(CucumissativusL.)是葫芦科(Cucurbitaceae)黄瓜属(Cueumis)植物,具有较高的经济、医药与营养价值[1]。黄瓜枯萎病是由尖孢镰刀菌(Fusariumoxysporum)引起的一种严重真菌土传病害[2-3],目前的防控措施多样,但效果均不够理想,存在药剂持效期短、易残留、破坏土壤微生物区系和污染环境等一系列问题,因此,开展生物防治显得尤为重要。木霉菌(Trichoderma)是一类环境友好型生防真菌,其适应范围广,生长繁殖速度快,可用来防治部分植物土传病害[4]。因此,探讨木霉水分散粒剂对黄瓜枯萎病的防治效果,对黄瓜的安全生产和土传病害的生物防治具有重要意义。国内外的许多关于木霉菌剂的报道指出,木霉菌不仅能够拮抗土壤中多数病原真菌,而且可以显著优化植株品质[5]。也有研究表明,添加木霉菌可以提高根际不同微生物的相对丰度和多样性,其对土著微生物群落的调控过程同样有助于拮抗土传病原真菌[6],如茶树病害[7-9]等,且有利于土壤养分改善和植物生长[10-11]。牛鑫斌等[12]明确提出长枝木霉(Trichodermalongibrachiatum)T6水分散粒剂对黄瓜白粉病、黄瓜立枯病(Cucumber damping-off disease)和油菜(BrassicanapusL.)根腐病(root rot)均具有较好的应用成效。木霉菌制剂现已开始在市面上流通,如美国的Topshield (哈茨木霉T22)和以色列的Trichodex (哈茨木霉T39),以及日本的防治烟草白绢病木霉菌剂。浙江大学等研制的木霉菌制剂对根腐病的防效达到70%,增产幅度为7%~15%[13]。目前虽然已经开展了木霉菌株对黄瓜枯萎病的拮抗作用相关研究[14-16],但目前对木霉制剂的探究以可湿性粉剂为主[17],关于木霉水分散粒剂对黄瓜枯萎病的防治效果还未见报道。本研究通过测定相关生理指标,以探讨木霉水分散粒剂的促生防病效果,揭示木霉水分散粒剂的最优固体基质比例和母药助剂的最佳配比,研制出应用效果良好的水分散粒剂,为后期木霉菌剂的开发应用提供科学依据,为黄瓜设施优质栽培奠定基础。
1 材料与方法
1.1 试验材料
供试黄瓜品种为津研4号,种子由河北省沧州市百盛种业有限公司提供。供试培养基为马铃薯葡萄糖琼脂培养基(PDA)。供试菌株来自于中国农业微生物菌种保藏管理中心的深绿木霉(Trichodermaatroviride菌株编号:ACCC33804)、哈茨木霉(Trichodermaharzianum菌株编号:ACCC33104)和尖孢镰刀菌(Fusariumoxysporum菌株编号:ACCC38875)。
1.2 木霉水分散粒剂的研制
主要参考Kirby等[18]的方法。木霉固体培养基基质的优化:设置草炭∶蛭石∶牛粪质量比分别为1∶1∶1、1∶1∶2、1∶2∶1、2∶1∶1,进行条件优化。木霉母药助剂的筛选:通过测定不同助剂条件下木霉的产孢量,筛选出最佳紫外保护剂、稳定剂、黏结剂、崩解剂、载体和湿润剂及其比例,挤压造粒,得到木霉水分散粒剂。
1.3 试验方法
试验于2018年1月至2019年6月在金华职业技术学院植物学实验室内进行。将黄瓜种子置于烧杯中充分吸水,播种前取种子在10% H2O2中浸泡10 min进行表面消毒,然后用蒸馏水洗净药液,在55 ℃条件下水浴浸种,浸种时不断搅拌,持续20 min,使种子吸水膨胀,供给种子萌发所需基本水量,并起到种子表面消毒的作用,取出后于28 ℃恒温箱中黑暗催芽。当黄瓜苗长出2~3个真叶时,选取生长健壮、长势一致的黄瓜幼苗,栽培于学校植物学实验室。接种前,用质量体积分数为5%的高锰酸钾溶液对所用花盆进行消毒。试验设7个处理:接种哈茨木霉水分散粒剂(T1),接种深绿木霉水分散粒剂(T2),接种哈茨木霉水分散粒剂和尖孢镰刀菌(T1B),接种深绿木霉水分散粒剂和尖孢镰刀菌(T2B),接种尖孢镰刀菌(B),接种多菌灵和尖孢镰刀菌(CB),无菌水对照组(P)。接种处理采用层施法,施接种菌剂85 g·盆-1,每处理重复3次,每盆种植黄瓜幼苗3株,每处理共种植黄瓜9株。
1.4 指标测定方法
在试验进行的第5、10和15天,用打孔器取相同质量的幼苗中上部叶片作为样品,将采集的样品放入液氮中保存,进行相关生理指标的测定。叶绿素含量测定采用丙酮乙醇法[19],用硫代巴比妥酸法检测丙二醛(MDA)含量[20],茚三酮显色法测定脯氨酸含量[21];NBT光化还原法测定超氧化物歧化酶(SOD)活性[22];愈创木酚法测定过氧化物酶(POD)活性[23];紫外吸收法测定过氧化氢酶(CAT)活性[24];茚三酮显色法测定游离脯氨酸的含量[21]。
从黄瓜植株出现第1株病株开始,每天调查所有植株发病情况,进行病情指数统计。防治效果参照张素平[25]的分级标准,病情指数参照宗兆锋等[26]的标准。0级:无症状;1级:真叶、子叶黄化或萎蔫面积不超过总面积的50%;2级:真叶、子叶黄化或萎蔫面积超过总面积的50%;3级:叶片萎蔫或枯死,仅生长点存活;4级:全株严重萎蔫,以致枯死。病情指数=[∑ (病级株数×代表级数)/(植株总数×最高代表级值)]×100;防治效果(%)= (对照病情指数-处理病情指数)/对照病情指数×100。
1.5 数据处理
利用SPSS 21.0对数据进行统计,通过单因素方差分析和Duncan法计算平均值和标准误,分析差异显著性(α=0.05),使用Origin 8.5软件绘制图表。图表中数据为平均值±标准误。
2 结果与分析
2.1 不同培养基质和母药助剂对木霉菌产孢量的影响
由表1可知,在各种培养基质和母药助剂中,2种木霉的菌丝均能生长,但产孢量差异显著,表明不同的培养基质、木霉菌母药助剂对哈茨木霉33104和深绿木霉33804菌丝生长的影响不同。草炭∶牛粪∶蛭石质量比为1∶1∶1的培养基中,2种木霉菌的产孢量最大。添加炭黑紫外保护剂使2种木霉菌产孢量显著高于其余各组,说明炭黑能有效抵御紫外线对木霉的伤害,提高木霉水分散粒剂的利用效率。磷酸钾、羧甲基纤维素分别是哈茨木霉33104的最佳稳定剂和黏结剂,而深绿木霉33804则在添加羧甲基纤维素钠、PVP条件下最稳定。可溶性淀粉作为崩解剂时,2种木霉菌的产孢量都显著高于对照,说明3种崩解剂都与木霉菌有较好的相容性。凹凸棒土为载体时,2种木霉菌产孢水平均较低于对照组,说明凹凸棒土对木霉菌生长存在抑制作用;硅藻土为载体时,哈茨木霉产孢量最大,显著大于其他处理;高岭土为载体时,深绿木霉产孢量最大,显著大于其他处理。湿润剂中木质素磺酸钠对木霉菌有较好地保护作用,而十二烷基硫酸钠和十二烷基苯磺酸钠的保护作用不明显。
对哈茨木霉33104、深绿木霉33804水分散粒剂的相关指标和贮存稳定性进行筛选,最终确定哈茨木霉33104水分散粒剂中助剂的最佳配方(质量分数)为:炭黑0.5%、磷酸钾4%、羧甲基纤维素5%、可溶性淀粉5%、硅藻土5%和木质素磺酸钠5%。该配方水分散粒剂的孢子含量为6×108g-1,pH 6.5,水分含量2.5%,湿润时间38 s,颗粒强度强,各项检测结果均符合国家标准。最终确定深绿木霉33804水分散粒剂中助剂的最佳配方(质量分数)为:炭黑0.4%、羧甲基纤维素钠5%、聚乙烯基吡咯烷酮(PVP)5%、可溶性淀粉4%、高岭土3%和木质素磺酸钠5%。该配方水分散粒剂的孢子含量为7.6 × 108g-1,pH 5.6,水分含量4.5%,湿润时间25 s,颗粒强度较弱,各项检测结果均符合国家标准。
2.2 木霉水分散粒剂对黄瓜抗氧化酶系统的影响
在受到病原菌侵害时,植物体内会产生过量的活性氧,对植物产生危害[27],抗氧化系统可以减少活性氧积累和逆境条件下的氧化损伤。由图1得出,接种木霉水分散粒剂后,黄瓜叶片SOD、POD和CAT活性较P处理有显著提高。不同木霉水分散粒剂对抗氧化酶活性的调节程度存在差异,处理5、10和15 d,T1B处理的黄瓜叶片SOD、POD和CAT活性均低于T2B处理。由此可见,接种木霉水分散粒剂可提高黄瓜叶片的抗氧化酶活性,且其对黄瓜叶片抗氧化酶活性的影响存在品种间差异,深绿木霉作用效果更佳。
表1 不同培养基质和母药助剂对2种木霉菌产孢量的影响
Table 1 Effects of different culture medium and mother medicine additive on sporulation yield of twoTrichodermasp. strains
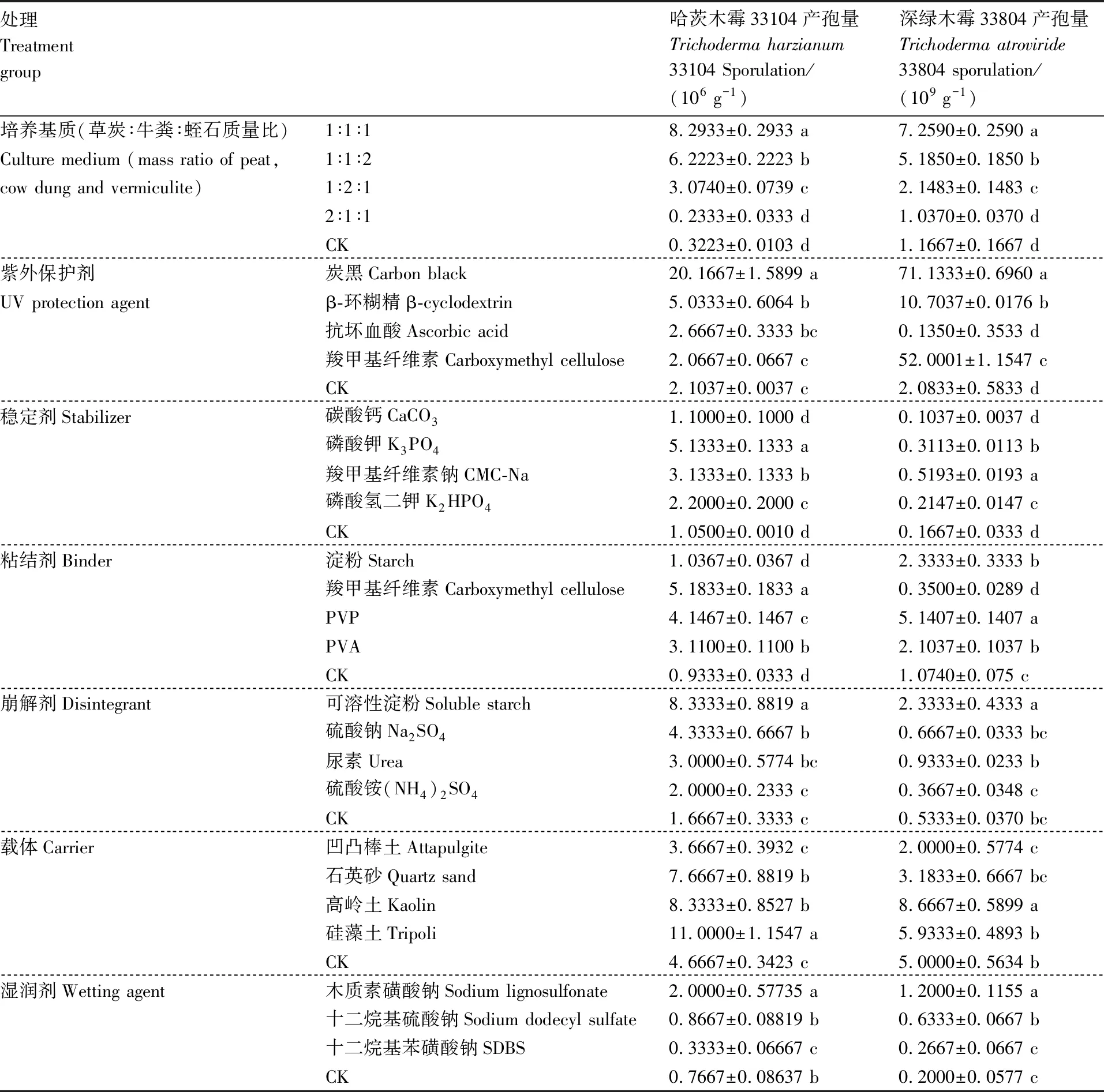
处理Treatmentgroup哈茨木霉33104产孢量Trichoderma harzianum33104 Sporulation/(106 g-1)深绿木霉33804产孢量Trichoderma atroviride33804 sporulation/(109 g-1)培养基质(草炭∶牛粪∶蛭石质量比)1∶1∶18.2933±0.2933 a7.2590±0.2590 aCulture medium (mass ratio of peat, 1∶1∶26.2223±0.2223 b5.1850±0.1850 bcow dung and vermiculite)1∶2∶13.0740±0.0739 c2.1483±0.1483 c2∶1∶10.2333±0.0333 d1.0370±0.0370 dCK0.3223±0.0103 d1.1667±0.1667 d紫外保护剂炭黑Carbon black20.1667±1.5899 a71.1333±0.6960 aUV protection agentβ-环糊精β-cyclodextrin5.0333±0.6064 b10.7037±0.0176 b抗坏血酸Ascorbic acid2.6667±0.3333 bc0.1350±0.3533 d羧甲基纤维素Carboxymethyl cellulose2.0667±0.0667 c52.0001±1.1547 cCK2.1037±0.0037 c2.0833±0.5833 d稳定剂Stabilizer碳酸钙CaCO31.1000±0.1000 d0.1037±0.0037 d磷酸钾K3PO45.1333±0.1333 a0.3113±0.0113 b羧甲基纤维素钠CMC-Na3.1333±0.1333 b0.5193±0.0193 a磷酸氢二钾K2HPO42.2000±0.2000 c0.2147±0.0147 cCK1.0500±0.0010 d0.1667±0.0333 d粘结剂Binder淀粉Starch1.0367±0.0367 d2.3333±0.3333 b羧甲基纤维素Carboxymethyl cellulose5.1833±0.1833 a0.3500±0.0289 dPVP4.1467±0.1467 c5.1407±0.1407 aPVA3.1100±0.1100 b2.1037±0.1037 bCK0.9333±0.0333 d1.0740±0.075 c崩解剂Disintegrant可溶性淀粉Soluble starch8.3333±0.8819 a 2.3333±0.4333 a硫酸钠Na2SO44.3333±0.6667 b0.6667±0.0333 bc尿素Urea3.0000±0.5774 bc0.9333±0.0233 b硫酸铵(NH4)2SO42.0000±0.2333 c0.3667±0.0348 cCK1.6667±0.3333 c0.5333±0.0370 bc载体Carrier凹凸棒土Attapulgite3.6667±0.3932 c2.0000±0.5774 c石英砂Quartz sand7.6667±0.8819 b3.1833±0.6667 bc高岭土Kaolin8.3333±0.8527 b8.6667±0.5899 a硅藻土Tripoli11.0000±1.1547 a5.9333±0.4893 bCK4.6667±0.3423 c5.0000±0.5634 b湿润剂Wetting agent木质素磺酸钠Sodium lignosulfonate2.0000±0.57735 a1.2000±0.1155 a十二烷基硫酸钠Sodium dodecyl sulfate0.8667±0.08819 b0.6333±0.0667 b十二烷基苯磺酸钠SDBS0.3333±0.06667 c0.2667±0.0667 cCK0.7667±0.08637 b0.2000±0.0577 c
同列数据后无相同小写字母表示差异显著(P<0.05)。
Data marked without the same lowercase letter in each column indicated significant differences atP<0.05.
2.3 木霉水分散粒剂对黄瓜MDA和脯氨酸含量的影响
由图2可以看出,T1、T2处理的黄瓜叶片MDA含量均显著低于P处理,差值最大可达P处理的17.17%和22.20%,T1、T2处理之间差异不显著。深绿木霉水分散粒剂或多菌灵和病原菌同时施用有利于减缓黄瓜叶片MDA含量的累积,B处理的叶片MDA含量最高,T1B、T2B和CB处理的MDA含量均显著低于B处理,T2B处理的MDA含量最低,较B处理最大降幅分别达22.66%、24.17%、23.17%,T2B处理与CB处理无显著差异。由此可以得出,接种木霉水分散粒剂可有限缓解黄瓜叶片中MDA的积累,减少活性氧自由基生成量,减轻膜脂过氧化程度。
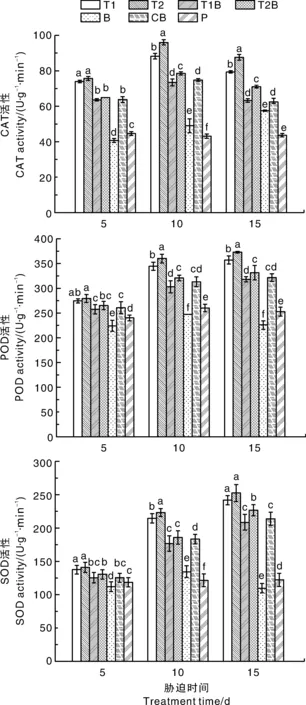
数据以鲜质量计。柱上无相同小写字母表示差异显著(P<0.05)。T1,接种哈茨木霉水分散粒剂;T2,接种深绿木霉水分散粒剂;T1B,接种哈茨木霉水分散粒剂和尖孢镰刀菌;T2B,接种深绿木霉水分散粒剂和尖孢镰刀菌;B,接种尖孢镰刀菌;CB,接种多菌灵和尖孢镰刀菌;P,无菌水对照组。下同。Data was detected based on fresh weight. Data on the bars marked without the same lowercase letter indicated significant differences at P<0.05. T1, Inoculated with Trichoderma harzianum water dispersing granule; T2, Inoculated with Trichoderma atroviride water dispersing granule; T1B, Inoculated with Trichoderma harzianum water dispersing granule and Fusarium oxysporum; T2B, Inoculated with Trichoderma atroviride water dispersing granule and Fusarium oxysporum; B, Inoculate with Fusarium oxysporum; CB, Inoculated with carbendazim and Fusarium oxysporum; P, Control group, inoculated with sterile water. The same as below.图1 木霉水分散粒剂对黄瓜抗氧化酶系统的影响Fig.1 Effects of Trichoderma water dispersing granule on antioxidant enzyme system of Cucumis sativus
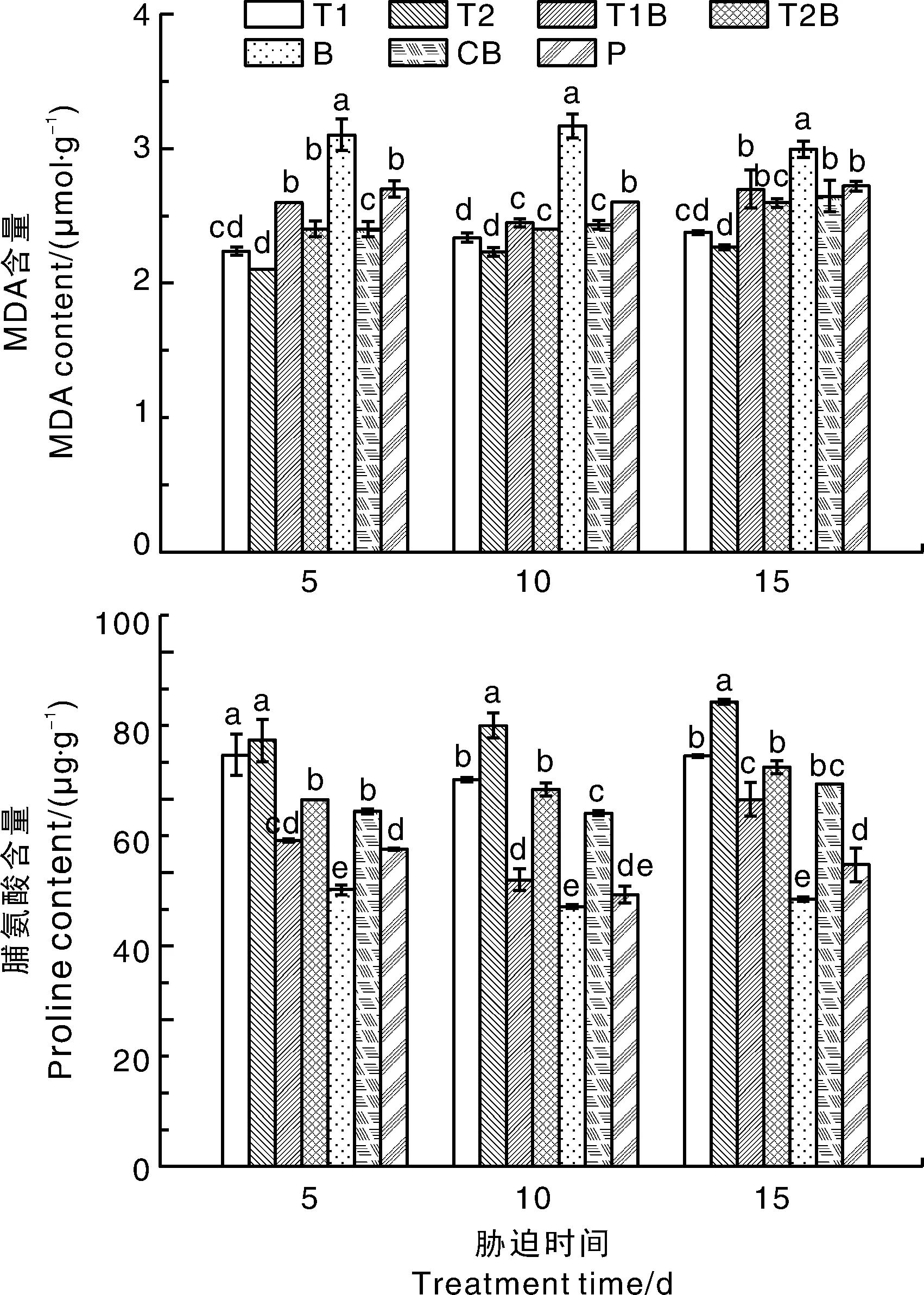
图2 木霉水分散粒剂对黄瓜MDA和脯氨酸含量的影响Fig.2 Effects of Trichoderma water dispersing granule on MDA and proline content of Cucumis sativus
脯氨酸是植物蛋白质的组分之一,以游离状态广泛存在于植物体中,是植物体内的一种重要抗逆境调节物[28]。由图2可见,较P处理而言,B处理脯氨酸含量显著下降,在5、10、15 d降幅分别达12.78%、4.46%、11.35%,T1B和T2B处理的叶片脯氨酸含量分别比B处理最大提高了37.42%、49.36%,说明木霉水分散粒剂对尖孢镰刀菌有抑制作用,接种深绿木霉水分散粒剂(T2B)比接种哈茨木霉水分散粒剂(T1B)效果更佳。
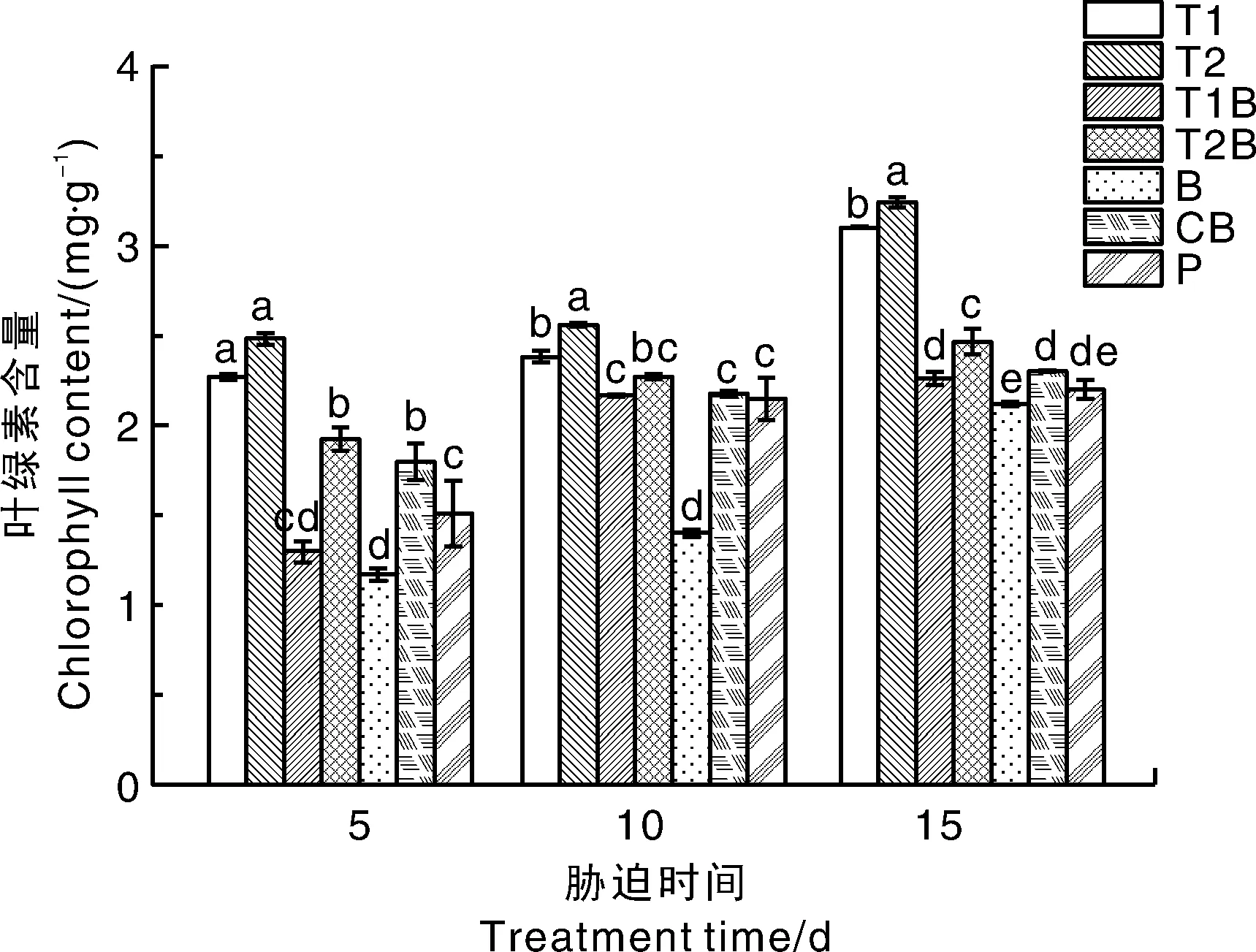
图3 木霉水分散粒剂对黄瓜叶绿素含量的影响Fig.3 Effects of Trichoderma water dispersing granule on chlorophyll content of Cucumis sativus
2.4 木霉水分散粒剂对黄瓜叶绿素含量的影响
叶绿素含量可直接反映植物光合作用的情况[29]。由图3可知,T2处理叶片叶绿素含量最高,在试验后期(处理10、15 d)显著高于T1、T1B和T2B处理。处理15 d,T2B处理叶绿素含量显著高于T1B和CB处理。处理不同时间,T2B处理叶绿素含量均显著高于B处理,处理10 d,T2B处理比B处理叶绿素含量高64.68%;处理15 d,T2B处理比P处理叶绿素含量高27.51%。可见不同木霉水分散粒剂对染病幼苗叶绿素含量的影响存在差异,但2种木霉水分散粒剂均可提高黄瓜叶片的叶绿素含量。
2.5 木霉水分散粒剂对黄瓜枯萎病病情指数和防治效果的影响
由图4可知,木霉水分散粒剂处理组(T1B、T2B)和施加多菌灵组(CB)的病情指数分别为22.22、11.11和16.67,显著低于尖孢镰刀菌处理组(B),且施加深绿木霉水分散粒剂组的黄瓜发病程度最低。从防治效果看,接种病害15 d后,T2B的防效显著高于T1B处理,与多菌灵处理组(CB)差异不显著,而T1B的防效也与多菌灵处理(CB)组差异不显著。可见,深绿木霉水分散粒剂组的防效较哈茨木霉水分散粒剂好。
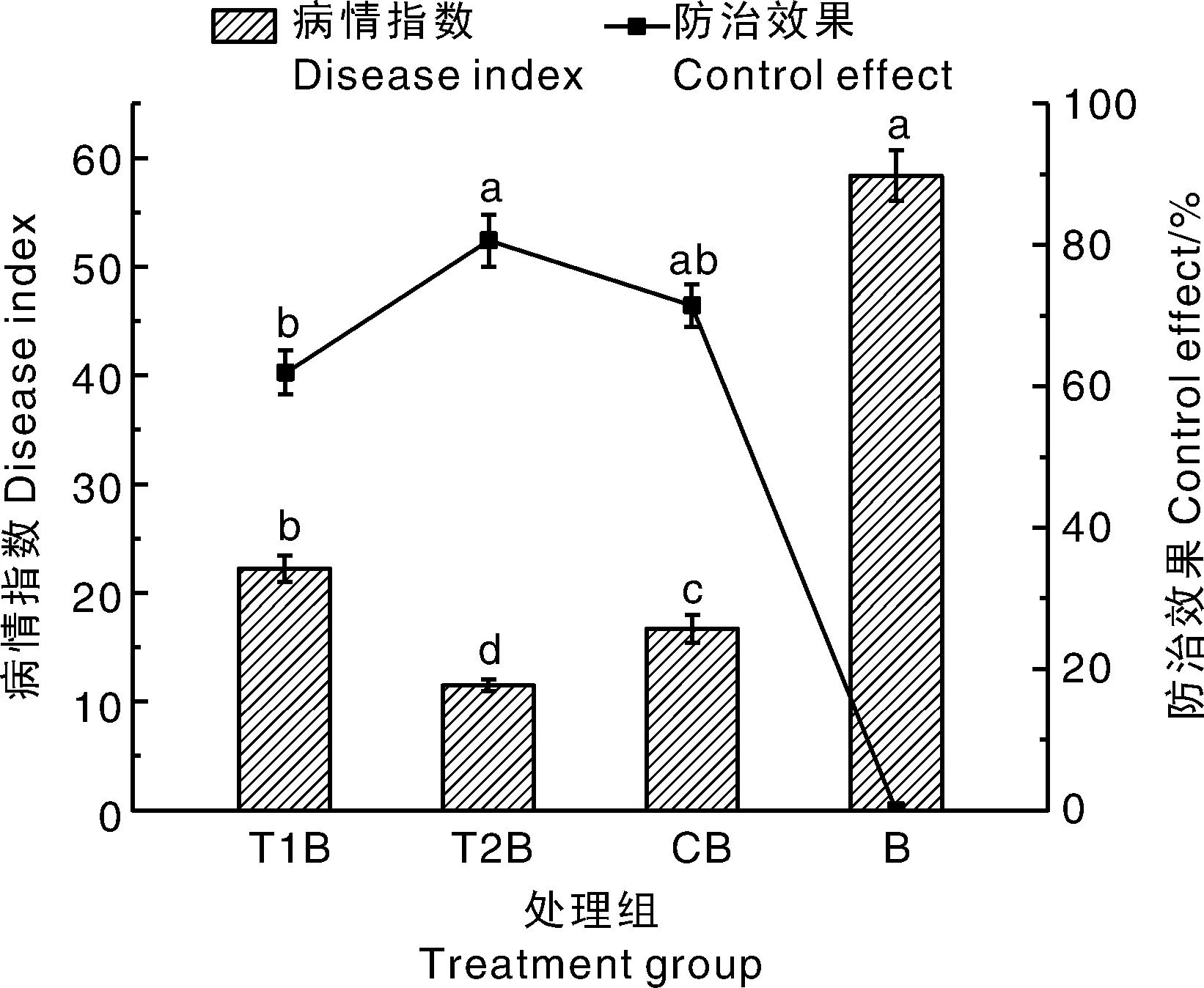
图4 木霉水分散粒剂对黄瓜病情指数和防治效果的影响Fig.4 Effects of Trichoderma water dispersing granule on disease index and control effect of Cucumis sativus
3 讨论
木霉菌作为一类环境友好型生防真菌,对多种植物病原菌有拮抗作用[30]。有研究表明,其通过调节黄瓜体内抗氧化酶活性、生物膜过氧化程度和脯氨酸含量等,对植物体内因逆境胁迫而产生的大量氧自由基进行清除,防止活性氧(ROS)诱导细胞损伤[31]。本研究显示,在受尖孢镰刀菌侵害初期,黄瓜体内SOD、POD和CAT活性上升、MDA含量降低,中后期则呈相反趋势,而木霉水分散粒剂处理组可以明显提高SOD、POD和CAT活性,由此推测2种木霉水分散粒剂可以率先激活SOD、POD和CAT活性,并有效缓解MDA的积累,激活植物本身的防御系统,减轻生物膜抗氧化程度,增强植物抵抗病原菌侵害的能力。脯氨酸能保持植物原生质体与环境的渗透平衡[32]。黄瓜脯氨酸含量在木霉水分散粒剂灌根后显著提高,并随着处理时间的延长而缓慢上升,由此可见,木霉水分散粒剂能提高黄瓜的抗逆性,进而减轻尖孢镰刀菌对其的危害。本研究中,木霉水分散粒剂明显促进了黄瓜叶片叶绿素的合成,提高了植物的光合能力,这与姜传英等[33]揭示的棘孢木霉可有效提高植物叶绿素含量的结论相一致。深绿木霉水分散粒剂的防效超过传统的化学药剂,高达80.95%,表现出良好的治病能力。辛鑫等[34]研究表明,绿色木霉H6-L4对香蕉枯萎病有显著抑制作用,与本研究中木霉水分散粒剂对黄瓜枯萎病防效结果相似。综上所述,在木霉水分散粒剂作用下,黄瓜的抗氧化酶活性、脯氨酸和叶绿素含量显著提高,MDA含量降低,有利于缓解黄瓜枯萎病对植株造成的伤害,表明木霉水分散粒剂对该病有良好的防治效用。
木霉菌对植物病原菌的拮抗存在多种机制,分别为竞争、重寄生和抗生作用[35]。竞争作用表现为对生长生存所需条件的竞争,木霉菌生长迅速、生命力较强,在本实验中可能较尖孢镰刀菌更快占领空间,吸取养分。通过对多组木霉菌基因组信息进行分析得出,重寄生是木霉最初的生存模式[36],可清晰观察到从识别病原菌到寄生的复杂过程[37]。木霉菌对病原物最直接的生防机制是重寄生作用,在这个过程中,木霉菌通过产生大量真菌壁的降解酶来降解病原菌的细胞壁,从而达到寄生和杀死病原菌的效果,与本实验得出木霉水分散粒剂具有良好的防病成效结果相一致。此外,土壤中的木霉菌对植物地上部分发生的病害也有一定的防治效果,即木霉菌的诱导抗性作用[38],Bigirimana等[39]首次证明了木霉菌具有诱导植物抗性的效果。木霉菌在植物根部定殖,刺激植物产生胞壁沉积物,可不同程度上阻止病原菌入侵[40],并增加植物体内与防御有关酶的合成与积累,使植物产生防御反应[41]。本实验结果显示,接种木霉水分散粒剂后,黄瓜抗氧化酶系活力显著提升。因此,推测木霉水分散粒剂能增强黄瓜抗性的主要原因是竞争、重寄生和诱导抗性等多种机制共作的结果。
环境因素对生物制剂的稳定性影响较大,且药效也随之改变,其中,以孢子制剂为甚[42]。选择与木霉菌有较好相容性的各类母药助剂加入木霉水分散粒剂中,可有效减小外界环境造成的药效不稳定性[43]。本研究的4种紫外保护剂中,炭黑作为紫外保护剂时2种木霉菌产孢量最高。4%磷酸钾作为稳定剂时对哈茨木霉孢子的相容性最好,深绿木霉的最佳稳定剂为5%羧甲基纤维素钠。测定备选颗粒剂的粒度、堆密度、松密度[44],从中筛选出与木霉菌相容性较好且成粒率高者作为黏结剂。在供试的4种黏结剂中,5%羧甲基纤维素和聚乙烯基吡咯烷酮(PVP)分别对哈茨木霉、深绿木霉孢子萌发影响较小,可考虑利用两者作为哈茨木霉、深绿木霉水分散粒剂的黏结剂。崩解剂以崩解时间小于180 s为合格[45]。可溶性淀粉对2种木霉菌孢子活性的影响低于其他处理,其产孢量分别较对照组高399.98%、337.52%,所以,可溶性淀粉可作为木霉水分散粒剂的崩解剂。哈茨木霉的最佳载体为5%硅藻土,而深绿木霉的最佳载体为3%高岭土。本试验所选的4种湿润剂对木霉菌丝的生长均没有影响,最佳湿润剂为5%木质素磺酸钠。
合理采用物理、化学、生物手段进行土传病害的防治,对农作物的安全生产至关重要。本研究探讨了木霉水分散粒剂对黄瓜生理特性的影响,阐明了其对于黄瓜枯萎病的防治效果,对黄瓜的安全生产具有一定意义。但木霉水分散粒剂对黄瓜生长的影响是多方面的,下一步需深入探究木霉水分散粒剂对黄瓜生长发育各方面的影响,以提高其生产效益和经济价值,促进黄瓜的开发利用和推广种植,为生防菌的施用环境与剂量探索提供理论依据。木霉水分散粒剂可与化学手段配合解决植物病虫害问题,逐渐减少农药用量,为营造绿色生态环境贡献力量。木霉水分散粒剂对黄瓜枯萎病具有拮抗作用,且深绿木霉33804水分散粒剂较哈茨木霉33104水分散粒剂防治效用更好。木霉水分散粒剂能通过重寄生和诱导抗性作用等过程增强植株的抗氧化酶活性、促进其光合作用和调节其MDA及脯氨酸含量,进而减缓尖孢镰刀菌对黄瓜生长的抑制。因此,在黄瓜规模化生产中,可选择适宜剂量的深绿木霉水分散粒剂进行处理,以期达到黄瓜的最佳栽培效果。
