副肿瘤性天疱疮纵隔肿物CT及PET/CT二例
2020-06-23岑国荣关键张皓钦
岑国荣,关键,张皓钦
病例资料患者1,男,42岁,反复口腔糜烂2个月,全身红斑、丘疹20余天。患者2个月前无明显诱因下出现口腔糜烂并加重。外院诊断为“扁平苔藓”。体查:全身红斑、丘疹、颜面红肿,伴瘙痒。患者自起病以来偶有气促,无发热、畏寒。精神、睡眠、食欲较差,有便秘,小便正常,近2个月体重减轻6 kg。实验室检查:WBC 26.99×109/L(4.0~10.0),中性分叶粒细胞比值0.955(0.46~0.75),抗核抗体ANA 140.99 U/mL(0.00~12.00 U/mL),抗双链DNA抗体30.23 IU/mL(0.00~12.00 IU/mL),特异性神经元烯醇酶22.68 ng/mL(0.00~16.30 ng/mL),CA125 38.3 U/mL(0.0~35.0 U/mL),其他实验室检查未见明显异常。
影像学检查:胸部CT平扫及增强(图1a~c)示中后纵隔偏右侧相对应气管隆突下水平见一软组织密度肿块影,大小约76 mm×45 mm×50 mm,CT值约48~72 HU,内见多发斑点状钙化影,肿块境界清楚,周围脂肪间隙尚清楚,右肺中间段支气管及右肺下叶支气管受压,管腔变窄。PET/CT(图1d)肿块内异常FDG摄取,最大SUV值约2.6。CT及PET/CT诊断考虑Castleman病。
1个月后行开胸右中纵隔肿物切除术,病理(图1e)示少许胶原纤维中见多量淋巴细胞、浆细胞浸润,间质小血管明显增生。皮肤活检术病理(图1f)示表皮棘层松懈,见表皮内疱及表皮下裂隙形成,基底细胞液化变性,海绵水肿,见表皮坏死及单个坏死角质形成细胞,淋巴细胞、中性粒细胞浸润,真皮浅层血管周围见淋巴细胞及较多嗜酸粒细胞浸润,呈天疱疮样改变。最终诊断:副肿瘤性天胞疮并感染;后纵隔Castleman病。该患者于2个月后因脓毒血症、多器官衰竭死亡。
患者2,女,47岁,主因“咳嗽、气促7个月,全身皮疹6个月,再发1个月余”入院。患者7个月前无明显诱因出现咳嗽,活动后明显,平卧休息能自行缓解。6个月前出现口腔糜烂,全身水疱疹,一直予激素治疗,皮疹好转,1个月余前患者气促加重,伴有心慌。予抗感染、强的松治疗无好转。体查:全身皮肤及黏膜散在色斑沉着,口腔黏膜糜烂,无溃疡。实验室检查:CA125 73.4 U/ml(0.0~35.0 U/ml),抗核抗体ANA 13.7 U/ml(0.0~12.0 U/ml),余实验室检查未见异常。
影像学检查:胸部CT平扫及增强(图2a~d)示纵隔隆突下-右肺门团块软组织影,大小约30 mm×26 mm×63 mm,密度不均匀,推压右肺下叶支气管,与同层食管分界不清,局部管腔狭窄。增强扫描明显强化。双肺下叶支气管扩张合并肺不张。PET/CT(图2e):68Ga-DOTANOC显像示肿块明显摄取。CT及PET/CT均倾向于恶性肿瘤,未能进一步定性。
手术过程:开胸于后纵隔气管隆突下水平见40 mm×60 mm×40 mm肿物,包膜较完整,周围见较多毛细血管,质韧,肿瘤与隆突及肺门关系密切,完整游离后切除肿物并取出。术后镜下病理(图2f)示肿物表面为厚壁纤维组织,并深入肿块内,包膜下见少量淋巴滤泡样结构,由小B细胞组成,无滤泡生发中心,符合Castleman病。肿物绝大部分由厚壁小血管和多量小淋巴细胞、较多浆细胞和少量分散嗜酸性白细胞构成,形态类似于透明血管型Castleman的滤泡间结构。紧贴小血管壁见多量滤泡树突细胞,核大,圆形或卵圆形,空泡状,核仁显著,无明显核分裂。免疫组化:CD21阳性,成网状紧贴小血管壁,符合增生的滤泡树突细胞。部分细胞SSTR2阳性,S-100、CD68、CD30部分细胞阳性,Ki-67(+)约10%。TdT、Syn、CK、CK19均阴性。病变符合由Castleman病发展(或转变)的滤泡树突/间质细胞肿瘤。本例患者未做皮肤活检术。
讨论肿瘤性天疱疮(paraneoplastic pemphigus,PNP),又称副肿瘤自身免疫性多器官综合征(parane-oplastic autoimmune multiorgan syndrome,PAMS)[1]。1990年Anhalt首先报道[2],是一种具有自身免疫性并且伴发肿瘤的大疱性皮肤病。临床上罕见,该疾病常常合并潜在肿瘤,并在多个方面有其特征性的改变,分别表现在临床表现、免疫学及组织病理方面[3]。临床上天疱疮有多个分型,PNP属于其中一个分型,皮肤及黏膜损害、糜烂为其最典型的临床表现[4]。伴发PNP的潜在肿瘤主要包括非霍奇金淋巴瘤(42%)、慢性淋巴细胞白血病(29%)、Castleman病(10%)、胸腺瘤(6%)、华氏巨球蛋白血症(6%)、肉瘤(6%)[5],国外文献报道以非霍基金淋巴瘤较多见,而我国最多见于Castleman病[6]。我国PNP伴发的肿瘤中Castleman占的比例约77%[7],好发部位常见为纵隔[8],其次为颈部及腹部,Castleman病理分型有透明血管型、浆细胞型及混合型[9]。除了淋巴组织增生性肿瘤以外,PNP还可伴发非淋巴细胞增生性肿瘤,包括乳腺癌、前列腺等腺癌,脂肪肉瘤、皮肤或黏膜的鳞状细胞癌及恶性黑色素瘤等[10]。本文例1术后病理为经典Castleman病,例2则考虑为由Castleman病发展(或转变)成滤泡树突细胞肉瘤。滤泡树突状细胞肉瘤(follicular dendritic cell sarcoma,FDCS)是一种临床上非常罕见,原发于淋巴组织的滤泡树突状细胞的恶性肿瘤[11]。该病与Castleman病的发生部分相同。研究提示FDCS与Castleman病有关,尤其是与透明血管型关系密切,认为其产生增生,发展为异常增生,进而形成FDCS[12-13]。
Castleman病形成天疱疮的机制:Castleman病的肿瘤B细胞分泌IgG自身抗体作用于皮肤表皮的棘层细胞连接蛋白而形成棘层细胞松解或水疱,作用于基底层使基底细胞液化坏死,同样真皮浅层淋巴细胞浸润引起血管扩张充血[14]。PNP患者血清中存在能识别复层鳞状上皮、移行柱状上皮和单层上皮蛋白的自身抗体。除了累及口腔、口唇黏膜及皮肤,还可累及支气管,导致闭塞性细支气管炎[15]。CT见外周细支气管壁增厚,细支气管扩张,马赛克灌注气体滞留征及肺不张,可引发难以控制的肺部感染,从而发生呼吸衰竭[17]。Castleman患者并发肺部损害者预后不良[16],本文例2双肺下叶同时存在支气管扩张与肺不张,考虑因为闭塞性细支气管炎造成。
本文2例患者均于纵隔隆突下发现肿块,边界大部分清晰,增强扫描不均匀强化,核医学检查示肿块内核素明显摄取。此2例影像特点应鉴别以下疾病:①神经源性肿瘤(副神经节细胞瘤或神经鞘瘤;②肺隔离症(肺外型);③转移瘤。上述2例影像诊断均倾向于恶性肿瘤,未能进一步定性,但如果了解Castleman病及其相关肿瘤与天疱疮的内在联系,则有助于术前诊断。临床上不同内脏肿瘤可以产生相关的皮肤损害,当患者存在内脏肿瘤合并皮肤损害时,还需要注意以下4种情况:①鼻咽癌,乳腺癌等伴发皮肌炎;②神经纤维瘤病伴发牛奶咖啡斑;③神经内分泌肿瘤(如胰高血糖素瘤等)伴发坏死松解性游走性红斑;④子宫癌、宫颈癌、食道癌等伴发匐形性回状红斑。
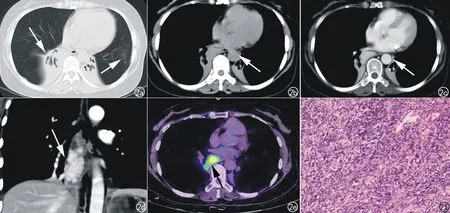
图2 a)CT轴面肺窗示双肺下叶不张并支气管扩张,左肺上叶舌段少量炎症(箭);b)平扫轴面纵隔窗示纵隔隆突下-右肺门团块软组织影,边界清楚(箭);c)轴面纵隔窗示肿块增强后明显均匀强化(箭);d)冠状面重组图示肿块呈纵行长条状,明显强化(箭);e)68Ga-DOTANOC显像示肿块明显摄取(箭);f)病理示肿物由厚壁小血管和多量小淋巴细胞,较多浆细胞和少量分散的嗜酸性细胞等组成,紧贴小血管壁见多量滤泡树突细胞,核大,圆形或卵圆形,空泡状,核仁显著。
放射科医生应该认识到Castleman病与天胞疮的内在联系,工作中如遇到天胞疮患者,同时发现纵隔、颈部及腹部肿瘤或肿瘤样病变,需要考虑到Castleman病或相关肿瘤的可能,因为该类患者的肿瘤具有导致闭塞性细支气管炎[15],引发严重的肺部感染的可能性,所以病死率较高,死亡率可达40%~80%[17]。应尽早切除肿瘤,打断对细支气管损害的免疫过程,提高患者生存率。
