联合中性粒细胞/淋巴细胞比值与纤维蛋白原在分析胃肠道间质瘤预后中的价值
2020-06-19蔡华霞,王曙逢
手术和靶向治疗是治疗胃肠道间质瘤(gastrointestinal stromal tumor,GIST)的主要方法。GIST组织中的自然杀伤(NK)细胞受体亚型可诱导NK细胞产生干扰素γ发挥抗肿瘤作用,免疫炎性反应因素与GIST的发病、进展及预后有关。持续的细胞增殖并伴有炎性细胞浸润、生长因子表达升高以及DNA损伤,会增加肿瘤发生的风险。高血清中性粒细胞/淋巴细胞比值(NLR) 与多种肿瘤包括肾癌、肺癌、卵巢癌、结肠癌和胃癌、GIST的不良预后有关[1]。 血浆纤维蛋白原(fibrinogen,FIB)可以在血浆中聚集,起到增强细胞炎性因子表达的作用[2]。FIB能刺激肿瘤血管生长,致肿瘤进展,与结直肠癌病人不良预后相关[3-4]。本研究旨在评价术前NLR、FIB对GIST术后预后的影响。
对象与方法
一、对象
2010年1月~2015年12月收治的GIST病人170 例,术前均未行靶向治疗并接受根治性手术切除术,相关资料齐全。纳入标准:(1)无远处转移,且术前未行伊马替尼(格列卫)等靶向治疗;(2)行根治性手术切除。排除标准:(1)无明确手术后病理诊断或术后病理诊断提示为其他组织来源恶性肿瘤;(2)除外伴有免疫性疾病及活动性感染性疾病;(3)随访资料不全。
二、方法
1.危险度分级及随访:根据术后石蜡病理结果,参照2008年改良版美国国立卫生署(NIH)GIST危险度分级标准将肿瘤进行分级[5]。170例病人中,极低危18例,低危65例,中危37例,高危50例。均以电话、门诊复诊等方式定期随访,术后2年内每3个月随访1次,以后每6个月随访1次,5年后每年随访1次。局部复发或转移均经多排螺旋CT或核磁、胃肠镜等至少一项影像学检查证实。无复发生存时间(recurrence free survival,RFS)定义为自接受根治性手术之日起至出现肿瘤复发或远处转移所持续的时间。随访截止日期为2016年12月1日,仍然存活并且无肿瘤复发或远处转移的影像学证据病人,或者由于非GIST原因导致死亡的病人我们将其定为截尾数据。170例病人中,随访期间有24例出现转移复发,因复发死亡15例,因车祸死亡1例。术后5年RFS率为75%。
2.观察指标:收集术前最后一次检测的实验室结果,包括血常规、凝血指标,即中性粒细胞计数、淋巴细胞计数、FIB,计算中性粒细胞计数与淋巴细胞计数比值(NLR)。血浆FIB正常范围为2.00~4.00 g/L。
三、统计学分析
采用SPSS 18.0软件处理数据。采用 ROC曲线评估各指标的预测能力,选取各指标的最佳截点值;各指标间的关系用χ2检验、非参数秩和检验,相关性分析采用Pearson 相关检验;远期生存采用 Kaplan-Meier 生存分析并使用Log-rank法检验做单因素分析,多因素分析采用Cox比例风险模型。P<0.05为差异有统计学意义。
结 果
1.ROC曲线分析:以生存结局(出现转移或复发)为状态变量绘制ROC曲线(图1)选取指标的最佳截点值。本研究中,当 NLR为1.864时,曲线下面积为0.608,灵敏度为83.3%,特异度为39.7%,约登指数最大值0.231,95%可信区间(CI)为0.488~0.729,故以1.864作为NLR指标的最佳截点值;当 FIB为3.24 g/L时,曲线下面积为0.758,灵敏度为0.875,特异度为0.616,约登指数最大值0.491,95% CI为0.666~0.850,故以3.24 g/L作为FIB指标的最佳截点值。
2.术前 NLR 和临床变量间的关系见表1。结果显示,高NLR组(NLR≥1.864)109例,低 NLR 组61例。两组年龄、性别、肿瘤大小、部位、危险度分级间比较,差异有统计学意义(P<0.05),高NLR主要集中在非胃以外的部位、肿瘤直径在5 cm以上及NIH危险度分级的中高危组病人,提示有这些特征的GIST病人术后预后较差,生存时间相对较短。
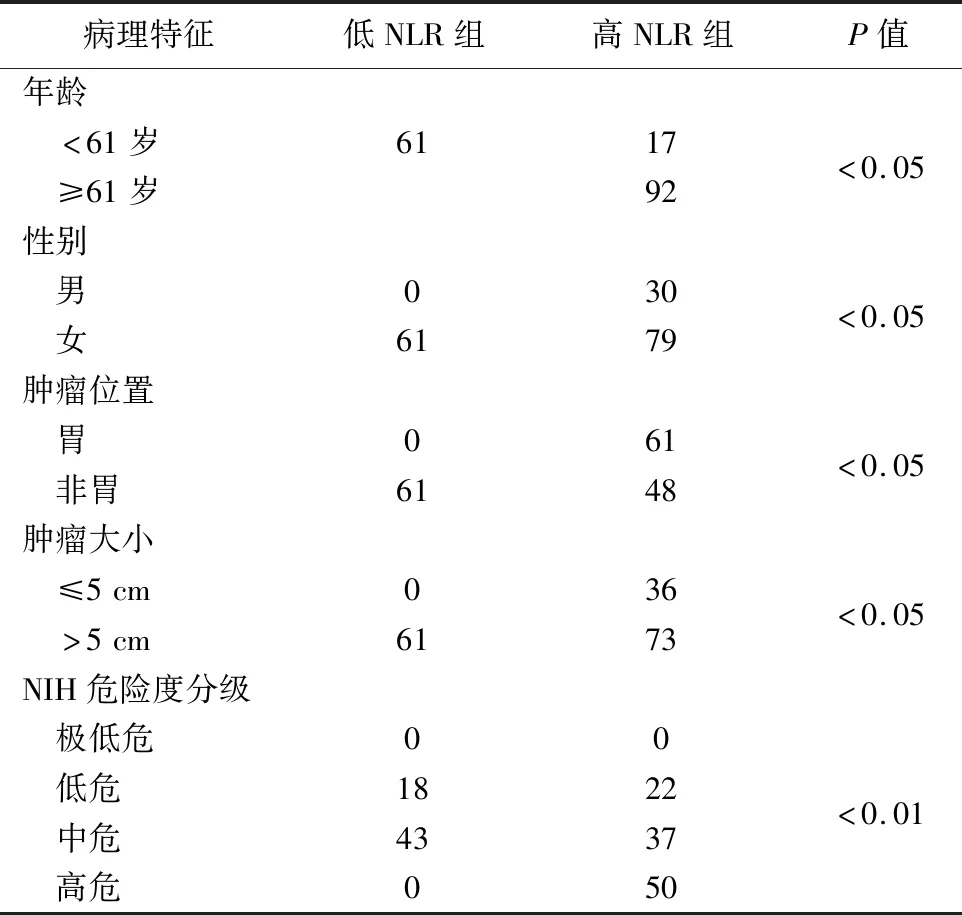
表1 两组相关临床病理特征比较(例)
3.术前 FIB 和临床变量间的关系见表2。结果显示,高FIB组(FIB≥3.24 g/L)75例,低FIB组95例。两组年龄、性别、肿瘤大小、部位、危险度分级比较,差异有统计学意义(P<0.05)。GIST发生在非胃部位、直径≥5 cm、中高危组病人时,其FIB水平倾向于高值,预后较发生在胃部位、直径<5 cm、危险度分级中的极低与低危组病人差、生存时间短。
4.术前NLR与FIB的相关性分析见表3。结果显示,NLR 与FIB间存在正相关关系,相关系数为0.665(P<0.05)。
5.术前NLR、FIB与GIST病人预后的关系见图2。随访截止时,170例病人中,有24例病人出现死亡,其中因GIST复发出现死亡15例,因车祸死亡1例。Kaplan-Meier分析和Log-rank检验结果表明,高 NLR组5年RFS差于低 NLR组(分别为 62%,90%,P<0.05),高FIB组差于低FIB组(分别为50%,95%,P<0.05)。
联合NLR与FIB并将其分为4组:组1 NLR<1.864与FIB<3.24 g/L、组2 NLR<1.864与FIB≥3.24 g/L、组3 NLR≥1.864与FIB≥3.24 g/L、组4 NLR≥1.864与FIB<3.24 g/L。上述4组5年RFS率分别为100%、78%、38%和92%(P<0.05),即组3(高FIB、高NLR)的5年RFS率明显差于组1、组2、组4(图3)。
将术前血NLR、FIB及肿瘤大小、部位、危险度分级等重要的预后因素通过向前法纳入Cox比例风险模型,并以是否服用格列卫等分子靶向治疗为基线分层后,筛选影响GIST病人术后预后的危险因素。结果提示,FIB(P<0.05,HR=0.098,95%CI:0.029~0.333)、NIH危险度分级(P<0.05,HR=0.128,95%CI:0.037~0.443)是影响GIST病人术后预后的独立危险因素,即高FIB组、NIH危险度分级的中高危组术后较低FIB组、NIH危险度分级的极低与低危组出现复发的时间提前(表 4)。
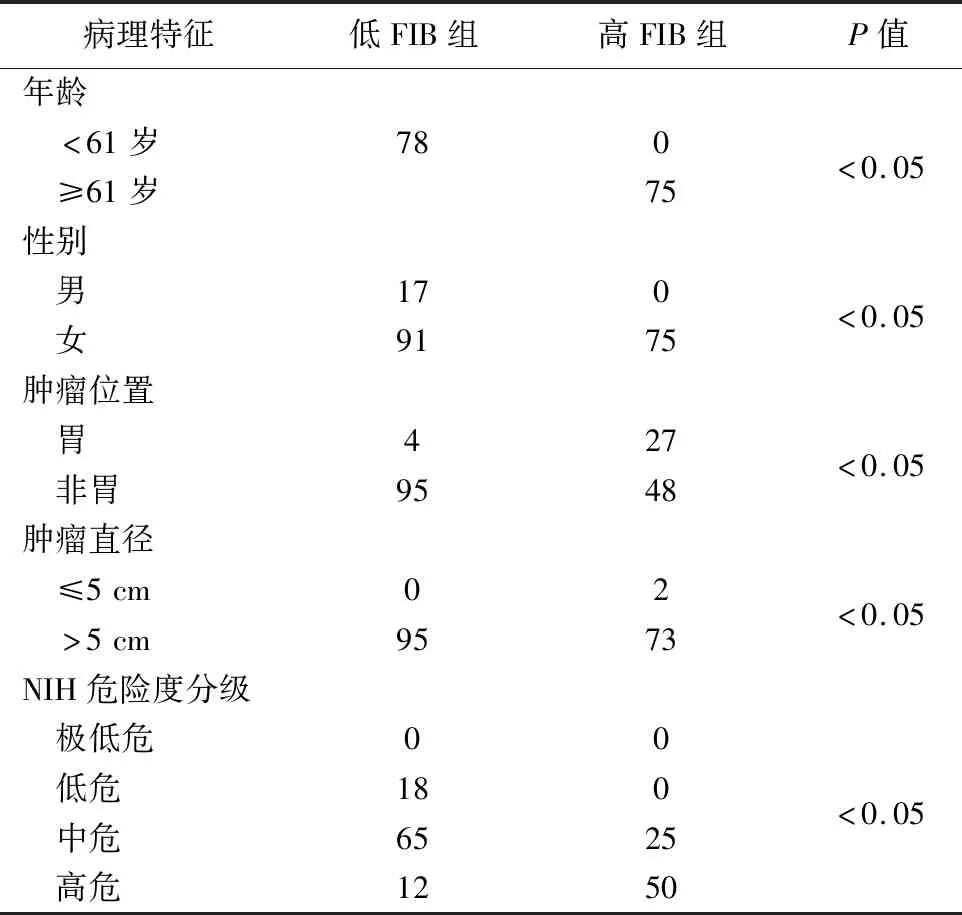
表2 两组相关临床病理特征比较(例)
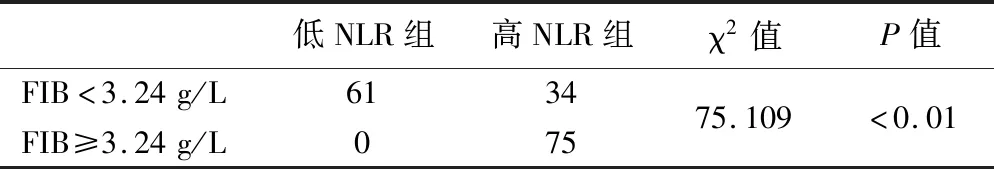
表3 NLR与FIB的相关分析(例)

表4 分层后GIST病人病理资料及预后的多因素分析
注:HRK-Hazard ratio,风险比
讨 论
肿瘤相关的炎症细胞通过释放炎性介质、细胞因子和酶类物质等,导致血管的通透性发生改变,从而诱发更多的炎症细胞参与其中,大量释放出炎性介质,造成氧化损伤、DNA突变及肿瘤微环境的改变,使得这种环境更有利于细胞发生转化、肿瘤细胞生存和繁殖加速[6]。慢性炎症在多种恶性肿瘤的发生发展中起着重要的作用,具体表现为外周血细胞水平的特异性改变,主要是中性粒细胞升高和淋巴细胞减少。NLR检测方便,费用低廉。有研究表明,高NLR的肿瘤病人机体自然杀伤细胞的活性会受到抑制,肿瘤炎症反应和抗肿瘤炎症反应之间的平衡被打破,炎症反应向促使肿瘤生长[7]。本研究发现,NLR较高者GIST病人术后预后比NLR正常者差,提示 NLR 值可作为评估GIST病人术后的预后指标之一。
FIB是血浆中含量最高的凝血因子,是形成血栓的重要分子及反映机体凝血状态的主要指标[8]。恶性肿瘤病人FIB增高的可能机制是肿瘤细胞进入血液循环,与血管内皮细胞和血小板发生作用,激活血小板或释放细胞因子,诱导肝细胞合成并释放FIB;肿瘤的转移与黏附密切相关,FIB可作为不同黏附分子的配体,在肿瘤转移中发挥重要作用;肿瘤细胞的生长能够促使组织产生炎性蛋白质[9]。FIB和炎性介质作用一致,都能够随着肿瘤的生长、转移而合成增多。
本研究将NLR与FIB联合起来,研究其与GIST病人术后预后间的关系。结果表明,NLR、FIB均与GIST病人的性别、年龄、肿瘤部位、大小、危险度分级之间存在相关关系,且NLR与FIB之间也存在正相关关系,生存分析发现,高NLR、高FIB均与GIST病人术后差的预后有关。将NLR与FIB联合并分为4组做生存分析,发现高NLR与高FIB组预后差于其他3组,差异有统计学意义。对GIST病人术后预后有影响的变量进行多因素分析发现,FIB、NIH危险度分级是影响GIST术后预后的独立危险因素,高FIB、高NIH危险度分级组较低FIB、低危险度分级组病人出现复发的时间提前。此结论与文献报道一致[10]。
NLR与FIB联合检测可作为GIST病人术后判断预后的参考指标之一;对于高NLR与FIB的病人,术后早期给予辅助治疗,以期获得好的预后。进一步追踪观察GIST病人在治疗过程中NLR、FIB的变化与预后之间关系,有利于深入探讨NLR、FIB检测在肿瘤临床实际应用中的意义。本研究为一项回顾性研究,存在一些偏倚,研究结果还需更大样本量的前瞻性研究来进一步验证。
