基于TGF-β1/Smad3信号通路观察rb-bFGF在糖尿病大鼠烧伤创面愈合中的作用机制
2020-06-17张萍蒋仕秋陈雪莲王宽刘漪沦
张萍,蒋仕秋,陈雪莲,王宽,刘漪沦
糖尿病(DM)合并难愈合创面是常见的糖尿病并发症之一[1]。其病程长、难以治愈、截肢率高,严重影响了患者的生活质量[2-3]。临床中已有多种药物治疗糖尿病性皮肤创面,且具有治愈率高、无新生创面、不良反应低等特点,其中重组牛碱性成纤维细胞生长因子(rb-bFGF)作为一种最常见的外用药物之一,在促进组织修复及创面愈合中发挥重要的作用,但其作用机制尚不完全明确[4]。TGF-β1/ Smad3 (Smad3蛋白)信号通路是创面愈合中最重要的调控途径[5]。TGF-β1广泛介导细胞的多种功能,其根据细胞活化或分化程度的不同,双向调节目的细胞功能,促进创面的愈合;Smad3蛋白是TGF-β1最重要的细胞内信号转导蛋白[6]。因此本研究通过糖尿病大鼠烫伤模型制备糖尿病难愈合创面,观察TGF-β1/Smad3信号通路关键蛋白的表达变化,以揭示rb-bFGF在创面愈合中的作用机制,报道如下。
1 材料与方法
1.1 材料 (1)动物:无特定病原体(SPF)级雄性 SD 大鼠100只,8~10周龄,体质量200~250 g,由北京中医药大学实验动物中心提供(许可证号2019-0005A);依照北京中医药大学实验动物管理办法,室温下标准饲料、自由饮水、分笼(4笼)适应性饲养1周后用于实验。(2)试药试剂:rb-bFGF(珠海亿胜生物制药有限公司生产),人重组 TGF-β1 购自美国 Peprotech公司,HE染色检测试剂盒购自生工生物工程(上海)股份有限公司,免疫组化试剂盒购自美国Amresco公司,Western-blot试剂盒购自Santa Cruz公司,TGF-β1、Smad3单克隆抗体购自美国CST公司,链脲佐菌素(STZ)购自华北制药厂。(3)仪器:CellInsight激光共聚焦显微镜(Thermofisher生产),E-Gel Imager凝胶成像仪(美国Beckma公司生产),DM2500生物电镜(德国徕卡公司生产),Multiskan MK3酶标仪(美国Fermentas公司生产),血糖仪(美国Johnson公司生产)。
1.2 实验方法 2018年3—9月于成都医学院第一附属医院科研实验中心进行实验。 SD大鼠100只随机数字表法分为对照组、模型组、TGF-β1组、实验组,每组25只。对照组大鼠仅予标准饲料喂养;模型组、TGF-β1组、实验组大鼠高脂高糖饲料喂养1个月后,按STZ 50 mg/kg大鼠腹腔注射,对照组注射等体积无菌生理盐水;3 d后,尾静脉血糖仪测血糖,空腹血糖>16.7 mmol/L即DM大鼠模型构建成功;建模后第10天,所有大鼠以20%乌拉坦5 ml/kg腹腔注射麻醉,而后在其背部距肩胛骨下2 cm处用手术剪剪毛3 cm×3 cm,并用8%硫酸钠脱净残留毛发,75%乙醇消毒处理,各组大鼠用直径为2.5 cm的圆形烫伤仪探头烫伤脱毛区皮肤,形成紧邻筋膜的全层皮肤缺损圆形创面,并即刻皮下注射醋酸氢化可的松0.6 mg/kg,另腹腔注射乳酸林格氏液 5 ml 抗休克。烫伤后当天分组给药:对照组、模型组不进行药物干预,使用生理盐水清洗创口,医用无菌纱布覆盖;TGF-β1组烫伤创面下注射TGF-β1(5 ng/ml)0.5 ml;实验组涂抹rb-bFGF,医用无菌纱布覆盖伤口。模型组、TGF-β1组、实验组大鼠在实验过程均有伤亡2~3只,每组随机选取22只作为观察对象。造模成功后,每周随机检测血糖1次,尾静脉每3天补充注射STZ 5 mg/kg,将大鼠血糖控制在16.7~22.0 mmol/L内,防止在实验过程中大鼠因血糖过高而死亡;烫伤后第28天清晨处死大鼠取创面组织标本放入-20℃冰箱中保存,进行病理学检测。
1.3 观测指标与方法
1.3.1 手术创面愈合情况:烫伤后第5、14、28天,以数码相机拍照并记录创面的愈合情况,包括创面颜色及质地、肿胀程度、新生上皮覆盖、有无渗出等。采用HVviewing8.0图像分析软件测定溃疡创面面积,计算创面愈合率。创面愈合率=(初始创面面积-尚未愈合创面面积)/初始创面面积×100%。
1.3.2 创面组织生态学变化:取每组大鼠30%创面组织,用5%甲醛固定,依照常规方法制成创面组织切片,HE染色,二甲苯处理,切片透明后,使用显微镜观察创面组织的生态学变化,包括毛细血管生长分布、胶原蛋白及上皮组织再生、炎性细胞浸润等情况。
1.3.3 超微病理结构:取每组大鼠50%创面组织,用30%聚甲醛和0.05%锇酸将其固定1 h,无菌脱水5 min,置于预冷4℃乙醇3 min,环氧树脂812浸透5 min,石蜡包埋,醋酸双氧铀及枸橼酸铅进行双重染色,制成50 nm厚切片, 完全干燥后载于铜网上,透射电镜观察超微病理结构。
1.3.4 α-平滑肌肌动蛋白(α-SMA)表达检测:取每组大鼠10%创面组织,10%多聚甲醛固定,石蜡包埋并切片,按照免疫荧光试剂盒要求进行操作。在荧光显微镜下,有红色荧光表示α-SMA表达,蓝色荧光为细胞核染色,使用计算机采集荧光图像,Image J软件重叠红绿荧光,将合成荧光的红、蓝色荧光光密度比值作为荧光强度值,随机选取6个高倍视野计算样品的平均荧光强度值。
1.3.5 TGF-β1、Smad3蛋白表达检测:采用蛋白免疫印迹Western-blot法检测。取每组大鼠10%创面组织,提取目标蛋白样品,经BCA试剂盒测定蛋白浓度后,准确量取50 μg,进行十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE),将样品蛋白经湿转法转至PVDF转膜上,加入10%脱脂奶粉封闭3 h,将一抗以1∶1 500比例稀释后,维持4℃过夜孵育,洗涤加入辣根过氧化物酶(HRP)标记的二抗孵育3 h, 增强化学发光ELC显色30 min,经曝光、显影、定影后,以GAPDH为内参来表示蛋白的表达水平。
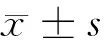
2 结 果
2.1 各组大鼠创面愈合情况比较 各组大鼠手术后创口均无明显感染,随时间推移,大鼠创面逐步愈合。在烫伤28 d后对照组大鼠创面基本愈合;模型组大鼠创面颜色较深,周围组织出现部分水肿,已经好转;TGF-β1组创面明显缩小;实验组创面很小,已有少部分开始愈合。 与对照组比较, 模型组创面愈合率明显降低(P<0.05);与模型组比较,TGF-β1组、实验组创面愈合率明显升高(P<0.05),但2组比较差异无统计学意义(P>0.05),见表1、图1。
2.2 各组创面组织生态学变化比较 对照组创口面新生胶原纤维增多,成纤维细胞团状排列,少量出现新生毛细血管。模型组炎性细胞明显增多,成纤维细胞排列紊乱,未见新生毛细血管。TGF-β1组少量淋巴细胞出现,但成纤维细胞致密分布在毛细血管周围,新生毛细血管少量出现。实验组中成纤维细胞肥大,且密集分布,胶原纤维清晰可见,新生毛细血管呈小圆状,并且已有开始生长的趋势,见图2。
2.3 各组创面组织超微结构比较 对照组大鼠细胞器数量多,细胞核质界限分明,内质网数量多,成纤维细胞数量多,新生胶原纤维较多;与对照组比较,模型组细胞内内质网开始扩张,线粒体空泡,核质间隙不清晰;与模型组比较,TGF-β1组病理改变明显减轻,其内质网基本不扩张,细胞器数量丰富,新生胶原纤维较多;实验组与TGF-β1组相似,细胞内细胞器数量丰富,内质网扩张不明显,核质间隙清晰,新生胶原纤维较多,见图3。
2.4 各组α-SMA蛋白质表达比较 烫伤后28 d,与对照组比较,模型组大鼠创面组织α-SMA蛋白表达明显降低 (t=8.643,P=0.000);与模型组比较,TGF-β1组和实验组α-SMA蛋白表达均升高(F=15.392,P=0.000),但2组间比较差异无统计学意义(P>0.05),见图4、图5。
2.5 各组TGF-β1、Smad3蛋白表达比较 Western-blot检测结果显示,与对照组比较,模型组TGF-β1、Smad3蛋白表达水平明显降低,差异有统计学意义(t=4.632、9.493,P=0.002、0.000);与模型组比较,TGF-β1组、实验组TGF-β1、Smad3蛋白表达水平明显升高,差异有统计学意义(F=16.283、28.832,P均=0.000),但2组间比较差异无统计学意义(P>0.05),见图6。
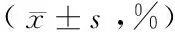
表1 各组大鼠不同时间点创面愈合率比较
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05
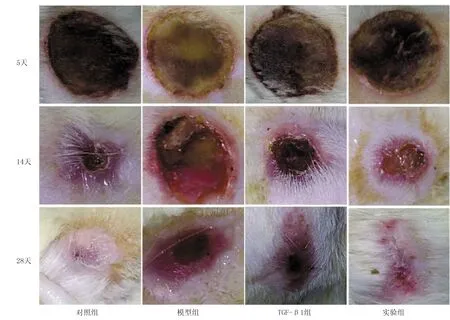
图1 各组大鼠各时间点创面愈合情况

图2 各组大鼠创面的组织生态学变化(HE染色,×800)

图3 各组大鼠造模后第28天后创面组织超微结构特点(×1 500)
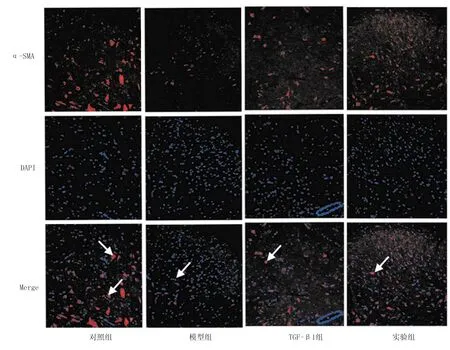
图4 各组大鼠创面组织α-SMA蛋白表达比较(×400)
3 讨 论
糖尿病皮肤病变是多因素、多环节参与,涉及表皮、皮下细胞及信号转导等的病理过程[7]。由于治疗困难、反复不愈,目前有25%患者面临截肢风险,是糖尿病患者致残的最大因素[8],严重影响患者的生活质量。糖尿病患者因病变部位血液循环不畅,白细胞作用失常,伤口容易感染,且高血糖等特点加重伤口初期的炎性反应,影响胶原蛋白合成,伤口愈合受阻[9-10]。
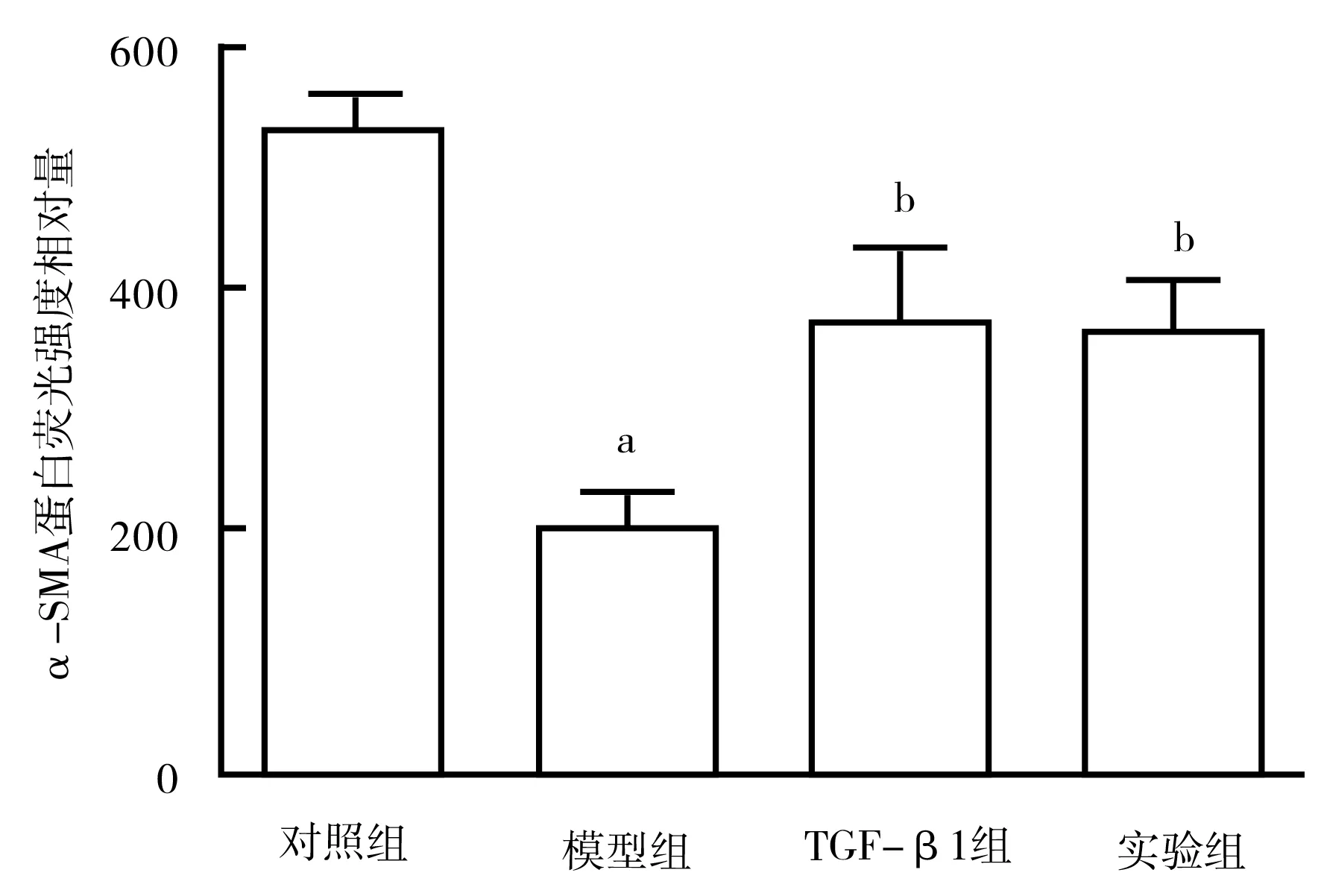
注:与对照组比较,aP<0.05;与模型组比较, bP<0.05

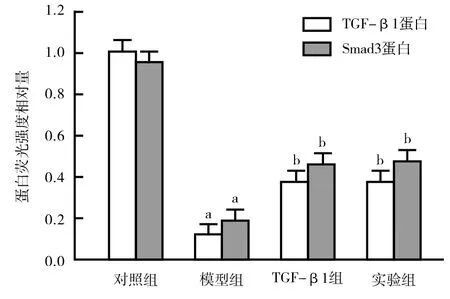
注:与对照组比较,aP<0.05;与模型组比较, bP<0.05
有学者发现[11],rb-bFGF治疗糖尿病创面,可以改善血液微循环,促进创面愈合。另有研究证明[12],rb-bFGF能够促进创面上皮组织再生,促进创面毛细血管新生。本研究构建大鼠糖尿病皮肤烧伤模型,通过HE染色及透射电镜观察术后创面组织的病理学变化和超微结构变化,研究rb-bFGF对糖尿病皮肤创面愈合的作用。实验结果显示,表皮生长因子和rb-bFGF均有促进创面愈合的作用;TGF-β1组和实验组在显微镜下均可见毛细管新生、大量成纤维细胞,与模型组比较,rb-bFGF能提高糖尿病皮肤创面的愈合率(P<0.05)。α-SMA是肌成纤维细胞的重要标志物,在创面愈合过程中血管生成发挥着重要的作用[13]。创面伤口的愈合修复过程往往伴随伤口部位的收缩和瘢痕的形成,而肌成纤维细胞是形成伤口收缩的动力,α-SMA是导致伤口瘢痕收缩的基础,也是决定瘢痕最终结局的关键[14]。α-SMA的数量可以直接反映肌成纤维细胞的增殖状态,同时也是肌成纤维细胞中的特异性蛋白,与瘢痕的收缩功能相关[15]。本研究结果显示,与对照组比较,模型组中α-SMA表达量明显降低,rb-bFGF治疗后,α-SMA表达明显升高,其表达水平与TGF-β1组相近,说明rb-bFGF可通过促进血管生成达到治疗糖尿病皮肤创面愈合的疗效。
已有研究证明,导致糖尿病皮肤病变难愈的原因较为复杂,信号通路表达的变化是其中重要的因素之一。有报道称[16],激活创面TGF-β1/Smad3信号通路,可促进上皮新生组织生成,加速伤口愈合。研究显示[17],TGF-β1/Smad3信号通路是创面愈合的重要调控途径,TGF-β1是促进成纤维细胞的转化因子,能够促进上皮组织生成,加速组织修复。Smad3蛋白主要促进细胞内靶基因的表达,增强α-SMA的表达水平[18]。此外,Smad3蛋白还可加速细胞超微结构增生分化,维持细胞内环境稳定从而加速创面组织纤维化,促进平滑肌生长,多环节治疗难愈合创面;使创面组织短时间内进入细胞增生与迁移期,起到更好的抗炎、消肿作用[19]。本研究基于TGF-β1/Smad3信号通路探讨rb-bFGF促进糖尿病大鼠皮肤创面愈合的作用机制,实验结果显示,糖尿病创面模型大鼠经rb-bFGF治疗后,通路蛋白磷酸化水平均明显升高,提示rb-bFGF可能通过激活TGF-β1/Smad3通路,增强α-SMA蛋白的表达,促进创面愈合。本研究不足之处在于:(1)研究中通过烫伤皮肤构建糖尿病大鼠皮肤病变模型,其病理生理条件与糖尿病内源性皮肤病变模型存在不同之处,可能影响结论的准确性;(2)研究中评价了病理改变及通路调节机制,其不良反应的影响未深入探讨;(3)影响糖尿病皮肤病变的通路较多,rb-bFGF是否还能通过调节其他通路来影响疾病进程,仍需进一步的研究。
综上所述,rb-bFGF可促进糖尿病大鼠皮肤创面的愈合,其作用机制可能与TGF-β1/Smad3信号通路激活有关。
利益冲突:所有作者声明无利益冲突
作者贡献声明
张萍:设计研究方案,实施研究过程,论文撰写;蒋仕秋:提出研究思路,分析试验数据,论文审核;陈雪莲、王宽:实施研究过程,资料搜集整理,论文修改;刘漪沦:课题设计
