激活肝内天然免疫治愈乙型肝炎的进展和新策略
2020-06-16黄葵源刘子英张小勇
黄葵源, 刘子英, 张小勇
南方医科大学南方医院 感染内科肝病中心, 广州 510515
目前全球约有2.37亿慢性HBV感染者,通过垂直感染的婴儿中有80%以上发展为慢性乙型肝炎(CHB)[1]。目前CHB的治疗药物主要有IFNα和核苷(酸)类似物(NAs)两类。虽然两者均可在部分患者中获得持续病毒学应答和肝脏组织学改善,延缓疾病进展,但只有极少部分患者达到CHB功能性治愈,并且大多数CHB患者在停药后出现病毒反弹[2]。宿主免疫系统功能状态是决定病毒清除与否的关键因素。随着对CHB免疫致病机制的研究不断深入,发现机体对HBV出现免疫耐受及免疫功能失调是导致HBV感染慢性化的主要原因之一。因此,基于激活CHB患者体内免疫系统从而清除HBV的免疫治疗策略具有广阔的应用前景。在HBV感染中,天然免疫系统不仅可以识别并抑制病毒复制,在调节HBV适应性免疫应答中也发挥着关键作用,因此激活宿主天然免疫应答可能是将来实现CHB功能性治愈的重要手段之一。
1 宿主肝内天然免疫系统在控制HBV感染过程中的作用
1.1 参与HBV天然免疫应答的天然免疫受体
天然免疫系统是宿主抵御病原微生物入侵的第一道防线。病原体相关分子模式(pathogen associated molecular patterns,PAMP)被病原体识别受体(pathogens recognition receptors, PRR)识别并启动天然免疫应答[3]。PAMP主要为病原体特殊形式的核酸或细胞壁成分,在病原体进入细胞后或复制过程中被细胞的 PRR识别。PRR是细胞内特异识别结合各种PAMP的受体,主要包括Toll样受体(TLR)和视黄酸诱导基因Ⅰ(retinoic acid induced gene Ⅰ,RIG-Ⅰ)样受体(RLR)。这两大类受体主要位于专职抗原提呈细胞,如巨噬细胞和树突状细胞的表面或内部,也广泛表达于肝细胞和肝非实质细胞。
1.1.1 Toll样受体(TLR) TLR在机体识别PAMP并激活天然免疫反应中发挥重要作用,TLR主要识别来自于病原体的脂类、蛋白质和核酸等,通过 MYD88 依赖性或非依赖性途径启动下游信号通路,促进免疫细胞分泌Ⅰ型IFN等细胞因子,发挥抗病毒作用[4]。研究[5]表明,与健康对照相比,急性HBV感染者血清中未检测出较高的Ⅰ型IFN水平。对CHB患者外周血单个核细胞和肝细胞的研究[6]发现TLR3介导的先天免疫反应功能受损。Visvanathan等[7]也发现HBeAg阳性CHB患者的肝细胞、Kupffer细胞和外周血单个核细胞上TLR2的表达量低于HBeAg阴性患者,并且患者外周血中的浆细胞样树突状细胞的TLR7/9表达量降低[8]。这些研究均表明HBV可削弱由TLR介导的天然免疫系统的抗病毒作用。
1.1.2 RIG-Ⅰ样受体(RLR) 最近的研究[9]表明,受感染肝细胞内的胞质DNA/RNA感受器可以识别HBV核酸。RIG-Ⅰ与HBV前基因组RNA的ε茎环结合,诱导肝细胞表达大量Ⅲ型IFN,但是未检测出其他与HBV先天免疫识别相关的炎性细胞因子,如IL-1β、IL-6和TNFα等。亦有研究[10]发现,HBV DNA暴露于细胞质中时,胞质DNA感受器环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS)可以识别dsDNA,进而催化合成环二核苷酸(cGAMP),cGAMP激活干扰素刺激因子(stimulator of interferon genes,STING),促进Ⅰ型IFN的表达。研究[11]发现,破坏病毒的衣壳或影响HBV反转录酶的活性可以产生RNA-DNA杂化双链,使HBV暴露于DNA传感器并激活天然免疫。
1.2 参与HBV天然免疫应答的细胞类型及抗病毒效应
肝脏作为人体重要的免疫器官,其丰富的自然杀伤细胞(NK细胞)和巨噬细胞(如Kupffer细胞)是肝内天然免疫的主要防线。此外,肝细胞PRR介导的天然免疫应答在HBV感染初期以及慢性化过程中亦发挥着重要的作用。
1.2.1 NK细胞 NK细胞是抗HBV的重要天然免疫细胞,主要集中在肝窦内皮层,其表型和生物学功能均不同于外周血中的NK细胞。肝脏中的NK细胞主要分为CD56dimCD16+和CD56brightCD16+两个亚群。CD56dimCD16+NK细胞主要通过穿孔素/颗粒酶介导的细胞毒性作用直接破坏HBV感染的肝细胞发挥抗病毒作用,其数量减少可能会导致HBV持续存在。而CD56brightCD16+NK细胞主要通过分泌IFNγ、TNFα、IL-10等细胞因子,参与调节树突状细胞、Kupffer细胞、T淋巴细胞、B淋巴细胞和内皮细胞的免疫应答[12]。在土拨鼠肝炎病毒(woodchuck hepatitis virus,WHV)急性感染模型中已证明NK细胞具有抗HBV活性[13],所以NK细胞介导的免疫应答可能是早期清除HBV的关键因素。但慢性HBV感染后NK细胞表型和功能都发生改变,研究[14]已证明,CHB患者的NK细胞在产生IFNγ等细胞因子及其介导的细胞毒作用方面存在功能缺陷。此外,NK细胞通过细胞毒作用或Fas/Fas配体相互作用清除感染HBV的肝细胞从而加重与HBV相关的肝损伤[15-16]。
1.2.2 单核(巨噬)细胞 单核细胞是重要的天然免疫细胞,可分化成树突状细胞和巨噬细胞。在免疫活跃的HBV感染者中,CD14+CD16+单核细胞数量有所增加,且增高幅度与ALT水平呈正相关,提示这类细胞可能参与肝脏炎症和纤维化的形成[17-18]。 Kupffer细胞是一类定居于肝内的巨噬细胞,多聚集在肝窦,与肝窦内皮细胞一起构成肝脏抵御入侵病原体的第一道防线。Kupffer细胞表面表达多种TLRs和清道夫受体。在静息状态下,Kupffer细胞清除血液中的细菌产物,产生IL-10和TGFβ,促进调节性T淋巴细胞的扩增。当肝内出现炎症时,可诱导单核细胞来源的炎性巨噬细胞在肝内聚集,从而打破肝脏免疫耐受环境,加剧肝内炎症状态。在高压水动力法建立HBV转染小鼠模型中,HBcAg可诱导Kupffer细胞TLR2表达上调和IL-10分泌增加,从而抑制HBV特异性T淋巴细胞应答[19]。Kupffer细胞也可通过清除抗病毒免疫反应中凋亡的肝细胞从而减轻肝内炎症[20]。
1.2.3 树突状细胞 树突状细胞是机体最重要的抗原提呈细胞,分为前体期、未成熟期、迁移期和成熟期四个阶段。前体期树突状细胞参与抗原的摄取、加工和提呈,进而激活机体的适应性免疫系统[21]。HBV可以抑制树突状细胞与NK细胞相互作用,从而抑制浆细胞样树突状细胞诱导的NK细胞分泌IFNγ的功能[22]。同时,研究[23]发现CHB患者的树突状细胞抗原递呈能力减弱,不能有效的将HBV抗原提呈至T淋巴细胞,导致T淋巴细胞活化障碍,从而机体出现针对HBV的免疫耐受状态。
1.2.4 肝细胞 肝细胞是HBV入侵的主要宿主细胞,其通过表达多种PRRs介导天然免疫应答。此前研究[24]已证明,TLR2配体激活NF-κB、PI3K/Akt和MAPK信号通路的不同分支,诱导肝细胞产生炎症因子。TLR2介导的先天免疫应答可分别降低HBV和WHV在HepG2.2.15细胞和土拨鼠原代肝细胞中的复制和基因表达。另一项研究[25]表明小鼠原代肝细胞高表达TLR3/4,在特异性配体刺激下,TLR信号通路活化并刺激肝细胞分泌炎症因子,抑制HBV的复制。此外,RIG-1 可能是肝细胞识别HBV最重要的先天免疫传感器[26],通过拮抗HBV聚合酶(P蛋白)与ε茎环的相互作用,从而抑制HBV复制。
1.3 参与HBV天然免疫的重要细胞因子
1.3.1 IL家族 IL-8能够上调TNF相关的凋亡诱导配体(TNF related apotosis inducing ligand,TRAIL)的表达,在IL-8、IFNα存在的条件下,NK细胞可以通过TRAIL途径诱导受感染肝细胞凋亡以减少病毒载量,但同时也导致肝损伤。在Fisicaro等[27]的研究中,发现在自限性感染者体内,早期IL-2的产生有助于宿主控制病毒和抗原清除,而IL-10的高表达可以抑制NK细胞的激活,从而增加HBV免疫逃逸的概率。
1.3.2 IFN家族 根据IFN氨基酸排列顺序和特异性识别的受体不同将其分为Ⅰ型、Ⅱ型和Ⅲ型IFN。Ⅰ型IFN分为IFNα和IFNβ,参与机体的抗病毒反应与免疫调节,它可以促进多种免疫细胞的抗病毒作用,同时也可直接抑制HBV的复制[28]。Ⅱ型IFN主要是IFNγ,是机体内主要的巨噬细胞刺激因子,能够提高NK细胞和巨噬细胞的免疫活性。Ⅲ型IFN(IFNλ)与I型IFN的抗病毒机制相一致,但由于Ⅲ型IFN其受体分布的组织特异性及较少的副反应,使其在HBV的治疗研究中也备受关注。
1.3.3 肿瘤坏死因子(TNF)α TNFα可以通过使含有病毒RNA和DNA的核衣壳及空的核衣壳去稳态而迅速阻断HBV的复制[29-30],也可以通过诱导HBV cccDNA脱氨基作用和降解来减少肝细胞内cccDNA的水平[31]。在小鼠HBV模型中,敲除TNFR1或者阻断TNFα信号通路可使得HBV持续存在并引起T淋巴细胞功能耗竭,其中细胞凋亡抑制蛋白在TNFα促使细胞存活或死亡中起到关键作用,当小鼠使用cIAP分子拮抗剂后,TNFα可促进HBV感染的肝细胞凋亡,从而清除HBV[32]。
2 基于激活肝内天然免疫应答抑制HBV感染的策略
随着对HBV相关天然免疫研究的不断深入,激活肝内天然免疫应答已成为实现CHB功能性治愈的策略之一(图1)。
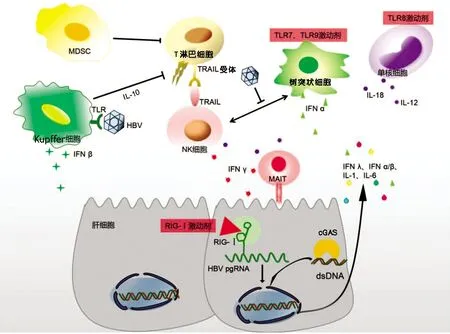
图1 HBV相关的天然免疫以及激活天然免疫治疗HBV的策略
2.1 靶向天然免疫细胞的治疗策略 NK细胞在HBV感染相关的肝脏免疫微环境中发挥着多重作用。急性HBV感染时, CD56dimNK细胞在感染早期促进病毒清除[33],肝内NK细胞的募集和增殖在PEG-IFNα联合NAs治疗CHB中发挥重要作用[34],但TRAIL+NK细胞可导致HBV特异性T淋巴细胞死亡,有研究[35]表明TRAIL+NK细胞比例降低与HBV特异性T淋巴细胞比例增加相关。因此,阻断TRAIL介导的信号通路而不影响NK细胞发挥抗病毒作用为CHB免疫治疗提供了新思路。另外,骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSC)是骨髓来源的一群异质性细胞,具有显著抑制免疫细胞应答的能力。在肿瘤免疫治疗中,已有大量研究聚焦于阻断MDSC免疫抑制来增强T淋巴细胞功能。在CHB患者中,血清HBeAg可诱导MDSC的扩增,削弱T淋巴细胞细胞因子分泌以及增殖功能[36],靶向MDSC有可能成为CHB的治疗方式之一,但由于MDSC在维持肝脏免疫微环境的稳定中发挥着重要作用,需要更加深入的研究来评估靶向MDSC治疗CHB的可行性。
2.2 细胞因子治疗策略 目前IFNα治疗仅能使部分CHB患者获益,且体外试验以及动物实验表明HBV可以抑制IFNα介导的抗病毒作用[37],考虑到IFNα对机体其他器官的效应引起的副作用,靶向肝脏的IFNα治疗值得进一步研究探索。近期研究[38]表明,通过设计融合IFNα的HBV特异性T淋巴细胞受体样抗体,靶向HBV感染的肝细胞,从而使得IFNα高效特异的作用于感染的肝细胞,体外试验结果显示可显著降低上清中HBsAg含量并可促进CXCL-10等趋化因子的分泌。PEG-IFNλ是一种长效Ⅲ型IFN,对天然免疫系统和适应性免疫系统均有调节作用,由于PEG-IFNλ受体表达局限于上皮来源的细胞如肝细胞并且较IFNα耐受性更好,患者有望从中获益[39]。
2.3 PRR激动剂 大量研究表明,通过TLR激动剂激活机体天然免疫可以抑制HBV复制。HBV转基因小鼠分别注射TLR3、TLR7/8或TLR9的配体可通过刺激Ⅰ型IFN分泌抑制HBV复制[40]。激活土拨鼠TLR7和TLR9可促进WHV清除[41]。激活单核细胞TLR所分泌的TNFα可以促进肝内淋巴细胞聚集并且发挥抗病毒作用[42]。当前,多种PRRs激动剂被证实在多种细胞模型和动物模型中发挥显著的抗HBV效应,部分已经进入到临床试验(表1)。
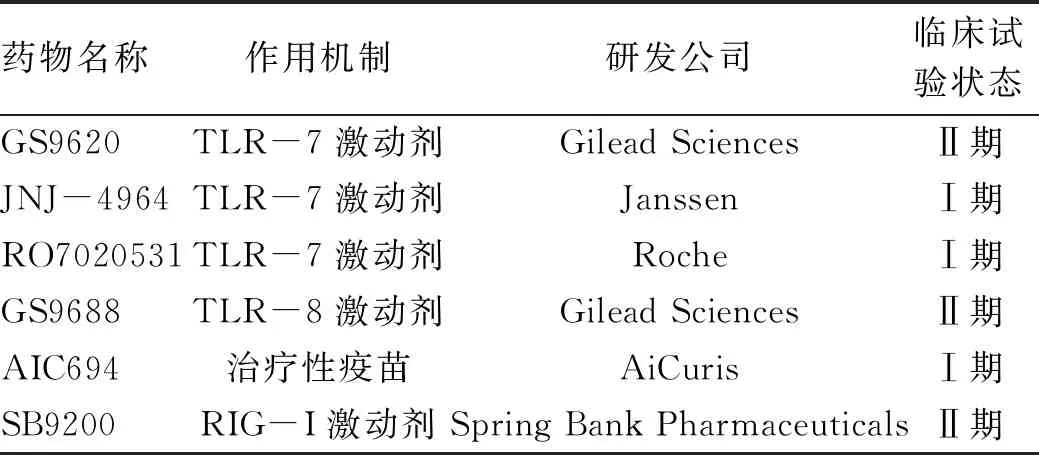
表1 激活天然免疫相关临床试验
在体外HBV感染细胞模型中,Gilead公司研发的TLR7激动剂GS-9620无直接的抗病毒作用,但可通过促进天然免疫细胞(以树突状细胞为主)分泌Ⅰ型IFN、增强肝细胞对HBV抗原肽的抗原提呈功能、促进针对HBV的适应性免疫应答,从而抑制HBV复制[43]。在黑猩猩HBV感染模型中,口服GS-9620可以促进肝脏和外周血IFN刺激基因的表达,增加外周血中IFNα的含量,降低血清HBV DNA和HBsAg[44]。在一项多中心、双盲、随机、安慰剂对照的Ⅱ期临床试验中,共纳入192例CHB患者进行GS-9620联合替诺福韦酯治疗,研究结果表明GS-9620具有良好的安全性,对IFN刺激基因15和IL-12的诱导呈现剂量依赖性,但是未观察到其对HBsAg和HBV DNA的影响[45]。Janssen公司研发的TLR7激动剂JNJ-4964在CHB小鼠模型中实验发现,所有小鼠在连续治疗14 d后HBV DNA和HBsAg均低于检测下限,连续治疗21 d后可检测到抗-HBs,在观察终点前未出现HBV DNA和HBsAg的反弹,JNJ-4964还可促进HBsAg特异性的T淋巴细胞和B淋巴细胞反应[46],目前JNJ-4964正在开展Ⅰ期临床试验。在腺相关病毒-HBV小鼠模型中,Roche公司研发的TLR7激动剂RO7020531联合HBV核衣壳抑制剂可显著降低血清中HBV DNA和HBsAg水平,至随访终点前可见HBV DNA和HBsAg的轻微反弹,RO7020531主要是刺激小鼠脾和淋巴结中的Ⅰ型IFN的免疫应答,其抗病毒作用呈现出剂量依赖性[47]。
TLR8主要表达于髓系细胞中,激活TLR8可促进肝内单核细胞/巨噬细胞分泌IL-12和IL-18,这些细胞因子可以促进肝内驻留的黏膜相关恒定的T淋巴细胞和NK细胞分泌大量的IFNγ[48]。由Gilead公司研发的TLR8激动剂GS9688在土拨鼠HBV模型中表现出较好的抗病毒作用,3 mg/kg,口服给药,1次/周,连续8周给药后,可观察到WHV cccDNA、DNA和RNA均出现下降,部分试验动物出现抗WHsAg抗体[49]。GS9688体外刺激CHB患者外周血单个核细胞后,可促进其分泌细胞因子如TNFα、IL-12p70等,激活CD56+NK细胞,下调经典的Treg细胞频数,但是对于HBV特异性的T淋巴细胞的频数没有影响,目前GS9688正在进行 Ⅱ 期临床试验[50]。
TLR9激动剂CpG主要通过诱导浆细胞样树突状细胞分泌IFNα。在土拨鼠乙型肝炎模型中,CpG联合恩替卡韦显著降低WHV DNA,WHsAg低于检测下限[51]。AIC694是一种靶向抗原递呈细胞的TLR9激动剂,在土拨鼠乙型肝炎模型中,AIC694联合恩替卡韦后WHV DNA和WHsAg平均下降水平分别达到7.6 log和4.1 log,部分动物体内WHsAg低于检测下限,AIC649还可促进WHV特异性T淋巴细胞的功能以及表面抗体的产生[52]。在目前公布的Ⅰ期临床试验的结果中,AIC649显示出良好的安全性,可激活天然免疫系统产生IL-1β、IL-6、IL-8、IFNγ并且下调IL-10,促进CD4+细胞中效应性和记忆性T淋巴细胞的分化,大部分受试对象出现HBeAg血清学转换,少数患者HBsAg水平持续降低并出现短暂的抗-HBs[53]。
TLR3激动剂Riboxxol,是一种50 bp大小的双链RNA。在人肝脏原代细胞感染HBV体系中,Riboxxol可持续的抑制HBV复制,显著降低cccDNA载量[54],目前仍需要大量的临床前研究来评估其药效。
RIG-Ⅰ主要通过识别5′端带有三磷酸化的短链dsRNA或ssRNA促进Ⅰ型IFN产生,Spring Bank公司研发的RIG-Ⅰ激动剂SB9200可激活病毒识别RIG-Ⅰ和核苷酸结合寡聚化结构域样蛋白2,从而使得在病毒感染的细胞中产生IFN介导的抗病毒反应,SB9200还可阻断HBV聚合酶的功能,直接抑制病毒复制[55]。在WHV模型中,口服SB9200可以降低WHV DNA及表面抗原水平并且呈剂量依赖性,使得肝脏以及血液中Ⅰ型IFN和IFN刺激基因的表达量长时间维持在较高水平,并且口服SB9200后肝内的RIG-Ⅰ蛋白表达水平也增高[56]。在Ⅱ期临床试验中,与安慰剂组相比,SB9200可以降低CHB患者体内HBV DNA载量并且呈剂量依赖性,在治疗12周后,SB9200治疗组22%的受试者血清HBsAg下降>0.5 log,其中血清HBsAg下降最大达到1.4 log[57],但由于该药在Ⅱb期临床试验出现重度不良反应事件,目前Spring Bank公司决定停止SB9200用于CHB治疗的研发。
STING可通过cGAS来识别细胞质中DNA[58]。研究[59]表明肝细胞中不表达STING,STING主要表达于肝脏非实质细胞如巨噬细胞等,在人源化肝嵌合体小鼠中,HBV感染可抑制cGAS表达,减弱cGAS-STING通路抗病毒作用,而在HepG2-NTCP中过表达cGAS激活cGAS-STING通路可抑制HBV复制及降低cccDNA载量[60]。在高压水动力法建立HBV转染小鼠模型中,腹腔注射STING激动剂DMXAA可诱导巨噬细胞分泌Ⅰ型IFN,促进IFN刺激基因表达,抑制HBV复制[61]。
3 小结与展望
激活天然免疫不仅可以抵抗HBV感染,对于启动HBV特异的适应性免疫应答也是至关重要的,HBV感染引起的天然免疫应答低下可能是病毒持续感染的重要原因。目前关于天然免疫激动剂的临床试验中,虽然在临床前动物实验中可以观察到HBV DNA以及抗原水平显著降低,但是在临床试验中表现出的抗病毒作用有限,可能由于大部分天然免疫激动剂为口服给药,肠道、肝脏和肠道菌群之间相互作用可能会影响它们的疗效。此外,天然免疫系统激活可能导致细胞因子大量释放,引起不良反应,因此,免疫治疗的安全性问题应引起重视。目前有大量的研究聚焦于肝脏免疫微环境,这对阐明肝脏免疫微环境作用机制及探索天然免疫治疗新策略有极大的帮助。在现有抗病毒治疗的基础上,针对宿主的个体化的免疫调节治疗是实现CHB功能性治愈的重要策略。
