肝细胞移植治疗肝硬化合并小肝综合征大鼠模型的效果观察
2020-06-16温欣慰李海洋
贾 磊, 温欣慰, 李海洋,2
1 贵州医科大学, 贵阳 550004; 2 贵州医科大学附属医院 肝胆外科, 贵阳 550004
Effect of hepatocyte transplantation in treatment of rats with liver cirrhosis and small-for-size syndrome
JIALei,WENXinwei,LIHaiyang.
(GuizhouMedicalUniversity,Guiyang550004,China)
Keywords:cell transplantation; liver cirrhosis; small-for-size syndrome
小肝综合征是指接受扩大肝切除或减体积肝移植术后,部分患者可能发生肝移植物或残余肝脏不能满足受者的功能需要,导致继发肝功能障碍,甚至合并肺、肾衰竭,其实质上属于急性肝衰竭[1]。虽然评估肝脏储备功能及预防术后肝衰竭发生风险的方法很多,但均存在临床应用缺陷[2],目前尚无有效的手段对该并发症进行预防和治疗。因此目前临床迫切需要一种合理、有效的方法来治疗小肝综合征。
肝细胞移植作为一种新的方法和手段,在治疗严重肝脏疾病和急性肝功能损害方面越来越受到人们的关注。目前对于该治疗的焦点主要集中在肝脏先天性代谢疾病、各种药物、毒物、病毒引起的急(慢)性肝功能衰竭上,对于肝脏切除后引起小肝综合征造成的急性肝衰竭鲜有报道。本研究使用合并肝硬化的大鼠进行大部分肝脏切除,使得动物模型更接近临床病例,观察肝细胞移植对肝硬化合并小肝综合征的治疗效果。
1 材料和方法
1.1 实验动物 雄性SD大鼠,体质量200~250 g,SPF级,购自辽宁长生生物技术股份有限公司,许可证号:SCXK(辽)2015-0001。实验场地:贵州医科大学附属医院临床研究中心,许可证号:SYXK(黔)2015-005。所有动物饲养在恒温21 ℃、70%湿度环境中,消毒饲料喂养,饮用5%~10%乙醇,昼夜照明时间为12 h。本研究方案经由贵州医科大学实验动物伦理委员会审批(批号:1901079),符合实验室动物管理与使用准则。
1.2 试剂和仪器 四氯化碳(分析纯,天津市风船化学试剂科技有限公司),红星二锅头(乙醇浓度56%,市售)。Ⅳ型胶原酶(中国Solarbio公司,货号:C8160),DMEM高糖培养基(美国Gibco公司,货号:8119081),无钙镁D-Hanks液(中国Solarbio公司,批号:H1045-500),Hanks液(中国Solarbio公司,货号:H1015-500)。台盼蓝溶液(中国Solarbio公司,货号:c0040),EDTA(中国Solarbio公司,超纯级,批号:524J051)。ALT测试盒( 南京建成科技有限公司,货号:C009-2)、AST测试盒(南京建成科技有限公司,货号:C010-2)、Alb测试盒(南京建成科技有限公司,货号:A028-1)。蠕动泵(上海沪西分析仪器厂有限公司,型号:BT-100),倒置显微镜(德国Leica公司)。
1.3 肝硬化大鼠模型的建立 雄性SD大鼠40只,按0.2 ml/100 g背部多点皮下注射分析纯四氯化碳,每周2次,开始予5%乙醇(二锅头+灭菌蒸馏水)为唯一饮水源,2周内逐渐增加浓度至10%,持续时间14周,建模过程中死亡4只大鼠。14周后随机解剖2只大鼠,观察成模情况。肝脏肉眼观:体积缩小,质地变硬,表面凹凸不平,可见大小不等结节(图1a)。肝脏组织HE染色病理切片:纤维组织增生,正常肝小叶结构消失,被增生的纤维结缔组织分割成大小不等的假小叶,中央静脉偏曲、消失,肝细胞片状坏死(图1b、c)。认为整批大鼠建模成功,停药1周后开始手术。
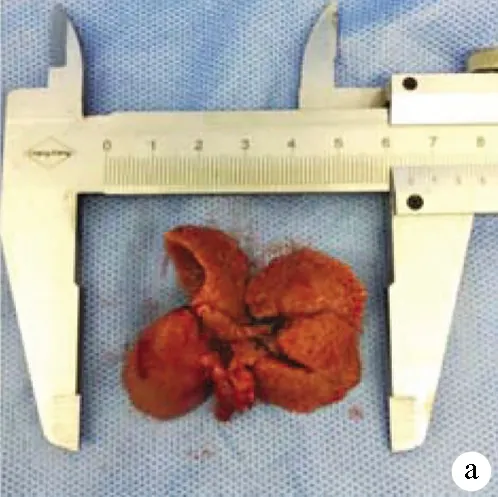

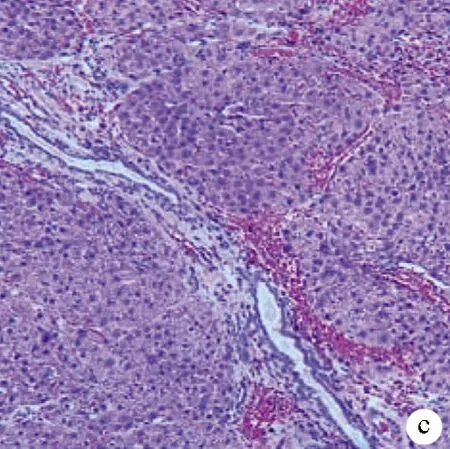
注:a,肝脏大体标本;b、c,肝组织病理检查(HE染色,×100)。
图1肝硬化大鼠肝脏大体和病理标本
1.4 原代肝细胞的分离
1.4.1 分离前准备 配制含0.01%EDTA的D-Hanks溶液及含0.05%Ⅳ型胶原酶的Hanks液预温37 ℃。蠕动泵接7.5号输液器,用预温的D-Hanks液排出管内空气待用。
双气泡图的对比运用到更高层次的思维技能。在课堂上,教师可通过双气泡图设计练习题,让学生上台训练,学生也可通过双气泡图来整理复习相关事物的异同点,如分子与原子的异同点。
1.4.2 肝脏灌注 参照SEGLEN两步灌注法并略有改动,取正常SD大鼠1只,10%水合氯醛按0.2 ml/100 g腹腔注射麻醉,将大鼠仰卧位固定于超净工作台上,消毒术区,“十”字切口入腹,门静脉下方置线备用,以准备好的输液器穿刺入门静脉,并用预置好的线固定,打开蠕动泵以20 ml/min速度灌注D-Hanks液,可见肝脏逐渐膨胀,剪断下腔静脉,继续灌注,待下腔静脉流出清凉液体后改换含0.05%Ⅳ型胶原酶的Hanks液继续以20 ml/min速度灌注,待肝脏表面有渗液,弹性明显降低时提示灌注完毕(图2a)。
1.4.3 肝细胞的分离及纯化 完整取下已灌注好的肝脏,放入盛有20 ml含胶原酶的Hanks液的无菌培养皿中,撕开肝脏包膜,用平镊轻轻刮下肝脏细胞,200目的滤网滤去残余结缔组织,肝细胞滤液以500 r/min、4 ℃低速离心2 min,去上清液,加入适量DMEM培养液再次予500 r/min速度离心2 min,此过程重复3次得到纯净的肝实质细胞(图2b)。
1.4.4 肝细胞活率测定 反复吹打混匀纯净的肝细胞,取80 μl细胞悬液+20 μl台盼蓝溶液混合,静置1 min后,用血细胞计数盘显微镜下计数,细胞蓝染的为死亡的肝细胞,得到活率>95%的肝实质细胞(图2c、d)。
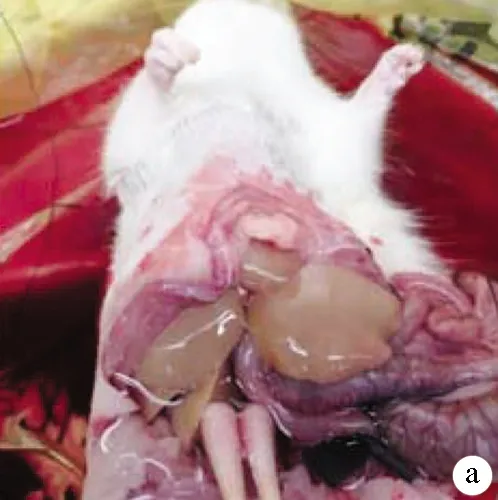
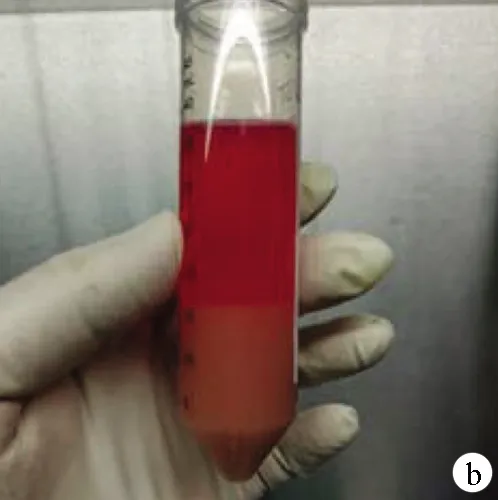
注:a,灌注好的肝脏;b,新鲜肝细胞悬液;c,镜下肝细胞;d,台盼蓝染色的肝细胞。
图2肝脏的灌注及肝细胞的分离
1.5 肝硬化大鼠肝细胞移植
1.5.1 大鼠分组 从肝硬化大鼠中随机抽取30只,随机分为A、B、C 3组,每组10只。A组:手术前3 d腹腔注入新鲜肝细胞1×108个细胞。B组:手术时腹腔注入新鲜肝细胞1×108个。C组:不进行肝细胞移植处理。
1.5.2 小肝综合征的建立 70%肝脏切除:10%水合氯醛按0.2 ml/100 g行腹腔麻醉,待麻醉生效后,大鼠仰卧位置于超净工作台中的手术台上,碘伏酒精消毒术区,正中切口入腹,切除肝左外叶、左内叶及右叶,术毕腹腔注射青霉素20万单位。术后3 d饮用10%葡萄糖水,自由饮食。
1.5.3 血清学检查及HE染色 分别于术后12、24、72、120、168、240 h断尾取血,根据试剂盒说明书分别检测ALT、AST、Alb水平。用多聚甲醛固定肝组织,石蜡包埋,切片,HE染色。
2 结果
2.1 3组大鼠生存率比较 A组大鼠术后死亡1只,生存率为90%,死亡时间节点为术后8 h。B组大鼠术后死亡5只,生存率为50%,死亡节点为术后6、7、13、20、40 h。C组死亡7只,生存率为30%,死亡时间节点为术后3、7、11、20、22、25、35 h。死亡大鼠均行尸体解剖排除出血、肠漏等引起的死亡。3组生存率差异有统计学意义(χ2=6.440,P=0.04)。
2.2 3组大鼠肝生化比较 分别于术后12、24、72、120、168、240 h断尾取血查ALT、AST、Alb水平。3组大鼠术前即存在轻度的肝损伤,表现为ALT、AST轻度上升、Alb轻度下降,但各指标3组之间差异均无统计学意义(P值均>0.05),结合肝组织病理学检查提示各组大鼠肝硬化水平一致。术后24 h ALT、AST逐渐升至顶峰,Alb下降至最低值,其后各组指标逐渐好转。术后各时间节点各指标3组之间比较,差异均有统计学意义(P值均<0.05),A组的恢复情况均有好于B、C两组的趋势,但进一步两组之间比较,部分时点存在无统计学差异的情况,考虑与术后肝功能恢复的个体差异性有关(表1,图3)。
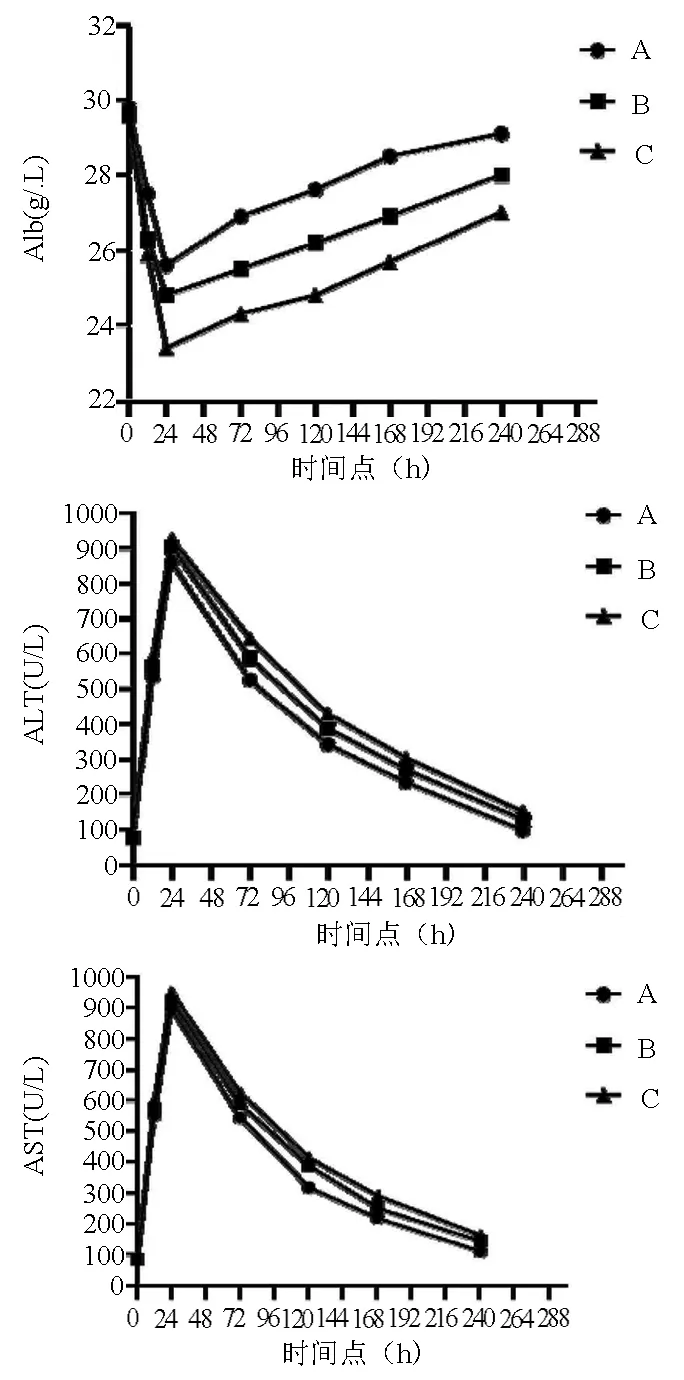
图3 3组之间ALT、AST、Alb水平在不同时间点的比较

表1 3组大鼠各时间点ALT、AST、Alb水平比较
2.3 3组大鼠肝组织学情况 术后72 h每组随机抽取1只大鼠处死行肝脏组织学检查。A组大鼠可见肝细胞水肿,少许气球样变及炎细胞浸润(图4a)。B组见肝细胞排列紊乱,严重水肿,肝脏点状坏死(图4b)。C组见肝索消失,大片肝细胞严重水肿,变性坏死,呈空泡状改变,大量炎细胞浸润(图4c)。


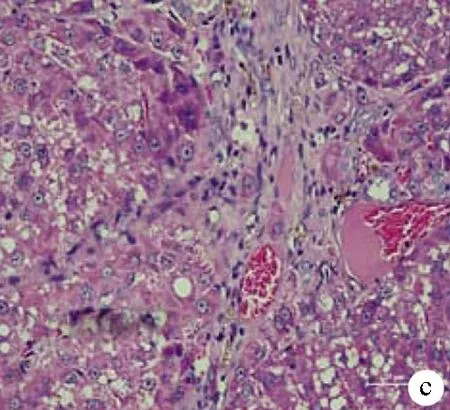
注:a,A组;b,B组;c,C组。
图43组大鼠术后72h肝脏病理组织学检查(HE染色,×200)
3 讨论
肝细胞移植是将正常的肝细胞体外进行分离、处理,然后植入受体体内,重建肝脏组织结构,恢复肝功能的一种技术。它被认为是原位肝移植有希望的替代治疗,用于包括急性肝衰竭和代谢性肝病在内的多种疾病。与原位肝移植相比,它有较小的侵入性、并发症和死亡风险,并且可以重复进行[3]。该技术目前的治疗焦点主要集中于肝脏先天性代谢性疾病,如Crigler-Najjar综合征、家族性高胆固醇血症、尿素代谢障碍等[4],对于此类疾病,目前认为该治疗方法可在短期内改善肝脏代谢,改善临床症状,但无法达到长期治疗效果,故对于代谢性疾病,目前肝细胞移植多作为在等待原位肝移植过程中的过渡性治疗[5]。对于急性肝衰竭的治疗目前的共识是可以通过细胞治疗,特别是肝细胞移植中受益[6]。有动物实验[7]结果表明,少量肝细胞移植即可对肝功能的改善产生深远影响,并显著增加急性肝衰竭动物的存活率。移植途径的选择优先选择门静脉,但对于肝脏结构改变的疾病如肝硬化,推荐脾脏途径,腹腔因为其容量大、易于操作而成为异位肝细胞移植的优选场所之一[8]。
小肝综合征的临床症状并无特异性,需要结合临床、实验室和组织病理学评估来诊断[9-11],主要的特征为术后肝功能障碍,伴有胆汁淤积和凝血功能障碍、门静脉高压症和腹水,生化特征包括转氨酶和胆红素水平升高[12]。残肝体积较小是术后肝衰竭的独立危险因素,当术后标准残肝体积<250 ml/m2时患者发生肝衰竭的概率为38%。因此应针对不同患者具体病情采取个体化治疗方案,选择合适手术方式,对预防肝切除术后肝衰竭发生至关重要[13]。在行扩大肝切除的患者,目前的共识是肝功能良好的情况下至少保留正常肝组织的30%,合并有肝硬化的患者,至少保留原肝组织的50%,而对于肝功能受损的患者,则需保留更多甚至不适宜行肝切除[14-15]。目前对于扩大肝切除引起的小肝综合征,多采取护肝药物、人工肝、血液超滤等治疗,但效果欠佳,而对于肝移植造成的小肝综合征通常需再次进行移植。
原发性肝癌是目前我国第4位的常见恶性肿瘤及第3位的致死性肿瘤,严重威胁我国人民的生命和健康,手术切除是肝癌治疗的首选[16],相较于欧美,我国肝癌患者多合并有肝硬化,且以大肝癌为主,进一步造成了术后小肝综合征肝衰竭的发生。笔者前期先制作了肝硬化的大鼠模型,在此基础上进行大部分肝脏切除(70%),造成小肝综合征急性肝衰竭,使动物模型更接近于我国患者的临床特点。本研究显示,术前行肝细胞移植的大鼠生存率明显高于其他两组,且肝功能的恢复情况也好于其余两组,但进行两组间比较时部分时间节点的组别并无明显统计学差异,仅有好转趋势,考虑与样本量较小有关及个体恢复差异有关。由此认为:肝细胞移植可有效促进肝硬化术后小肝综合征的肝功能恢复及提高生存率;细胞移植的时间也影响了肝细胞移植的治疗效果。
综上所述,肝细胞移植治疗肝硬化合并小肝综合征疗效确切,该实验不仅在适应证上增加了肝细胞移植的范围,也为临床上治疗肝切除术后小肝综合征提供了一种新的方法。
