microRNA-18a通过PPARα/γ信号通路上调慢性乙型肝炎患者调节性免疫功能
2020-06-16韩山山卢盺奕商玉涛冯志强
叶 军, 韩山山, 卢盺奕, 商玉涛, 冯志强,
1 安徽医科大学空军临床学院 肝胆外科, 合肥 230032; 2 空军特色医学中心 肝胆外科, 北京 100142;3 安徽医科大学药学院创新药物研究所, 合肥 230032; 4 北京朝阳急诊抢救中心 普通外科, 北京 100122
microRNA-18a upregulates the regulatory immune function in patients with chronic hepatitis B through the PPARα/γ signaling pathway
YEJun,HANShanshan,LUXinyi,etal.
(DepartmentofHepatobiliarySurgery,ClinicalCollegeofAirforce,AnhuiMedicalUniversity,Hefei230032,China)
Abstract:ObjectiveTo investigate the effect of microRNA-18a (miRNA-18a) on the regulatory immune function in patients with chronic hepatitis B (CHB) through the PPARα/γ signaling pathway.MethodsA total of 98 CHB patients and 96 patients without hepatitis B, who were treated in Air Force Special Medical Center (formerly known as General Air Force Hospital, PLA) from April 2017 to October 2018, were enrolled as experimental group and control group, respectively. There were no significant differences in age and sex between the two groups (P>0.05). RT- PCR was used to measure the relative mRNA expression of miRNA-18a in serum; flow cytometry was used to measure the expression of miRNA-18a in peripheral blood mononuclear cells (PBMCs); ELISA was used to observe the effect of miRNA-18a on the frequency of CD4+CD25+regulatory T (Treg) cells; Western blot was used to measure the expression of proteins associated with the PPARα/γ signaling pathway. PBMCs were further divided into si-miRNA-18a inhibitor group (transfected with si-miRNA-18a inhibitor) and si-miRNA-18a normal control group (transfected with si-miRNA-18a plasmid); flow cytometry was used to investigate the effect of miRNA-18a inhibition on the frequency of CD4+CD25+Treg cells, and Western blot was used to measure the expression of proteins associated with the PPARα/γ signaling pathway. Thet-test was used for comparison of normally distributed continuous data between two groups, and a Pearson correlation analysis was performed to investigate the correlation between miRNA-18a expression and proteins associated with the PPARα/γ signaling pathway.ResultsCompared with the control group, the experimental group had significantly upregulated mRNA expression of miRNA-18a in serum and liver tissue (t=9.634 and 9.863, bothP<0.01). The experimental group had a significantly higher frequency of CD4+CD25+Treg cells than the control group (t=9.854,P<0.01). Compared with the control group, the experimental group had significantly upregulated levels of interferon-γ and interlukin-9 (t=8.235 and 8.382, bothP<0.05). Compared with the control group, the experimental group had significantly upregulated expression of PPARα and PPARγ (t=4.229 and 3.545, bothP<0.05). Compared with the si-miRNA-18a normal control group, the si-miRNA-18a inhibitor group had a significantly lower percentage of peripheral blood CD4+CD25+Treg cells among CD4+T cells (t=3.968,P<0.01). Compared with the si-miRNA-18a normal control group, the si-miRNA-18a inhibitor group had significantly lower expression of PPARα and PPARγ (t=5.023 and 4.983, bothP<0.05). miRNA-18a was positively correlated with the protein expression of PPARα and PPARγ in the PPARα/γ signaling pathway (r=0.701 and 0.682, bothP<0.05).ConclusionmiRNA-18a may affect the regulatory immune function in CHB patients by activating the PPARα/γ signaling pathway and thus upregulate the frequency of cell surface factors and cytokine secretion levels associated with immune function.
Keywords:hepatitis B, chronic; peroxisome proliferator-activated receptors; microRNAs; T-lymphocytes, regulatory
HBV感染后,HBsAg、HBeAg诱发并启动宿主细胞对HBV不同程度免疫耐受,而CD4+CD25+调节性T淋巴细胞(Treg)在维持免疫耐受中起着决定作用[1-2]。过氧化物酶体增殖物激活受体α/γ(PPARα/γ)信号通路中PPAR有效的参与非酒精性脂肪性肝病的发病过程,并以脂肪浸润、肝细胞损害、炎症和纤维化为临床病理表现[3]。microRNA-18a(miRNA-18a)以其广泛参与生物学调控、在各种疾病中表达均异常等特点成为现代医学研究新方向[4],有研究指出,miRNA-18a在肝病的发生发展中具有一定的作用[5],而PPAR信号通路在非酒精脂肪性肝炎的发生发展发挥了十分重要的作用[6]。但目前miRNA-18a对慢性乙型肝炎患者调节性免疫功能的影响缺乏系统性报道,因而本文对miRNA-18a在PPARα/γ信号通路上对慢性乙型肝炎患者调节性免疫功能影响的相关机制进行研究。
1 资料与方法
1.1 血清和组织来源 抽取来自空军特色医学中心(原中国人民解放军空军总医院)肝胆外科2017年4月-2018年10月收治的确诊慢性乙型肝炎行肝脏手术的98例患者为试验组。纳入标准:(1)血清 HBsAg和HBeAg阳性超过6个月;(2)符合我国乙型肝炎防治指南[7]的诊断标准。排除标准:(1)肝功能失代偿病史者;(2)肝细胞癌病史者[8];(3)合并恶性肿瘤患者;(4)合并脏器功能障碍者。另于本院随机抽取同期行肝脏手术非慢性乙型肝炎的96例患者作为对照组。本研究方案经空军特色医学中心伦理委员会审批[批号:空总(科研)第2017-09-YJ 05],患者均签署知情同意书。
1.2 主要试剂和仪器 异硫氰酸荧光素标记小鼠抗人CD4抗体(ANT-145)购自艾美捷科技、藻红蛋白标记抗人CD25抗体(561405)购自北京志杰方远科技有限公司,引物合成由北京金斯瑞生物科技有限公司完成。人IL-9双抗体夹心酶联免疫吸附试验(ELISA)试剂盒(E-E-H0180c)、人IFNγ ELISA试剂盒、PPARα抗体(PPARα/NR1C1)(yboo978)、PPARγ抗体(PPAR-γ/NR1C3)(ATA35811)均购自美国R&D System公司,流式细胞分析仪(Attune NXT)购自美国Beckman公司,紫外分光光度计(S-3100)购自深圳迈昂科技有限公司。
1.3 实时荧光定量聚合酶链反应(RT-PCR) 分别提取2组患者血清、肝组织中的总RNA。反转录成cDNA,然后PCR扩增检测2组miRNA-18a mRNA的相对表达量。按说明书配制PCR反应体系。反应条件为95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火30 s、80 ℃延伸10 s,共45个循环。每个样本均检测3次,采用2-△△CT(Livak)方法计算miRNA-18a mRNA相对表达量[9]。miRNA-18a正向引物:5’-GTGCTAAGGTGCATCTAGTGCAG-3’,反向引物:5’-GTGCAGGGTCCGAGGT-3’;内参U6作为参照基因:5’-CTCGCTTCGGCAGCACA-3’,反向引物:5’-AACGCTTCACGAATTTGCGT-3’。
1.4 流式细胞术检测血清调节性免疫细胞表面因子频率 采集2组患者外周血,肝素抗凝,经Ficoll密度梯度离心法分离获得外周血单个核细胞(PBMC)。用抗人CD4和抗人CD25经免疫磁珠法从中分离出CD4+CD25+Treg细胞亚群(纯度均>85%)。流式细胞仪检测2组患者血清中CD4+CD25+Treg细胞表面因子频率,结果所得流式图运用Beckman分析软件处理。
1.5 ELISA检测相关细胞因子分泌水平 采用人IL-9双抗体夹心ELISA试剂盒、人IFNγ ELISA试剂盒进行检测,操作步骤严格按试剂盒说明书进行,每个样本均设双复孔。
1.6 Western Blot印迹检测相关蛋白的表达 取2组细胞总蛋白并检测浓度。制备电泳样品,12%十二烷基硫酸钠-聚丙烯酰氨凝胶电泳,转模,封闭。加入一抗,浓度分别为PPARα 1∶200,PPARγ 1∶400,β-肌动蛋白 1∶1000,4 ℃冰箱过夜,室温孵育二抗2 h。显影曝光条带,每个标本重复3次。
1.7 细胞培养及转染 将PBMC用DMEM高糖培养基(含10%胎牛血清)在37 ℃、5% CO2的培养箱中进行培养,当细胞生长到融合度达到几乎80%后,用胰蛋白酶处理1 min,每2 d更换一次培养基。将培养的PBMC分为si-miRNA-18a抑制组(转染miRNA-18a 抑制剂)、si-miRNA-18a正常对照组(转染miRNA-18a质粒)。提前1天将细胞以60%的密度接种,使其混匀,第2天当细胞达到融合度40%的时候进行转染。PBS洗涤2次之后每孔加入1 ml的DMEM高糖培养基(含20%胎牛血清),用去离子水溶解siRNA至20 μmol/L,将siRNA与500 μl无血清DMEM相溶,混匀后静置,此为A管;将Li-pofectamineTM2000与无血清DMEM混匀后静置,此为B管,将A、B管混匀静置20 min后加入各孔中,培养4~6 h后更换培养基,继续培养24~28 h。采用RT-PCR检测转染效率,转染成功即可用于后续实验。

2 结果
2.1 一般资料 试验组98例患者中男54例,女44例,平均(60.67±6.91)岁。对照组96例患者中男56例,女40例,平均(61.29±5.73)岁。2组间患者年龄、性别比较差异均无统计学意义(P值均>0.05)。
2.2 2组miRNA-18a mRNA 表达水平 RT-PCR结果显示,试验组血清中miRNA-18a mRNA相对表达量为3.53±0.57,对照组血清中miRNA-18a mRNA相对表达量为1.22±0.27,2组比较差异具有统计学意义(t=9.634,P<0.01)(图1a)。试验组肝组织中miRNA-18a mRNA相对表达量为9.24±1.25,对照组肝组织中miRNA-18a mRNA相对表达量为3.19±0.46,2组比较差异具有统计学意义(t=9.863,P<0.01)(图1b)。
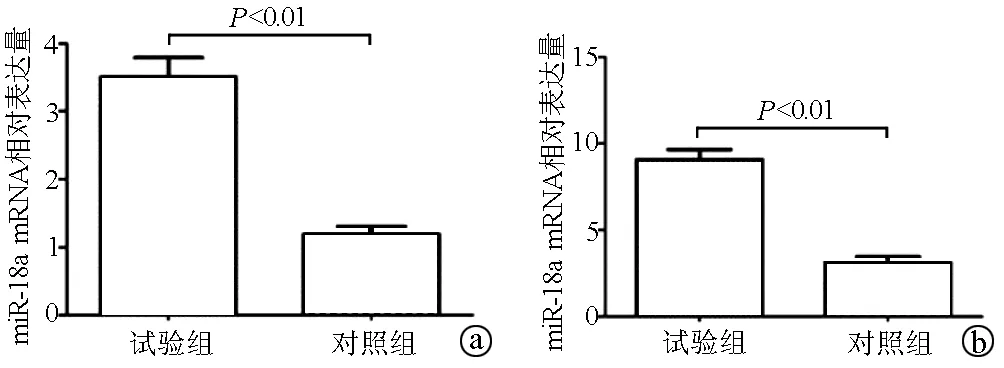
注:a,血清;b,肝组织。
2.3 2组PBMC中CD4+CD25+Treg细胞频率比较 试验组CD4+CD25+Treg细胞频率为58.77±12.33,对照组CD4+CD25+Treg细胞频率为46.68±12.16,2组比较差异具有统计学意义(t=9.854,P<0.01)(图2)。
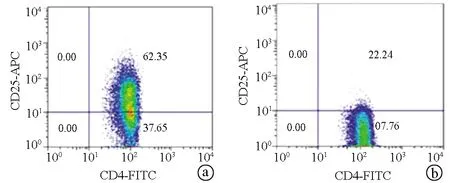
注:a,试验组;b,对照组。
2.4 2组CD4+CD25+Treg相关细胞因子分泌水平 ELISA检测结果显示,试验组IFNγ分泌水平为27.28±5.44,对照组的IFNγ分泌水平为11.45±2.26,2组比较差异具有统计学意义(t=8.235,P<0.05)(图3a);试验组的IL-9分泌水平为30.89±5.79,对照组的IL-9分泌水平为12.76±2.53,2组比较差异具有统计学意义(t=8.382,P<0.05)(图3b)。

图3 miRNA-18a对CD4+CD25+Treg相关细胞因子分泌水平的影响
2.5 2组PPARα/γ信号通路相关蛋白表达水平 蛋白电泳结果显示,试验组的PPARα相对表达水平为0.92±0.11,对照组的PPARα相对表达水平为0.46±0.06;试验组的PPARγ表达水平为0.47±0.05,对照组的PPARγ表达水平为0.22±0.03。PPARα和PPARγ表达水平在2组间差异均有统计学意义(t值分别为4.229、3.545,P值均<0.05)(图4)。
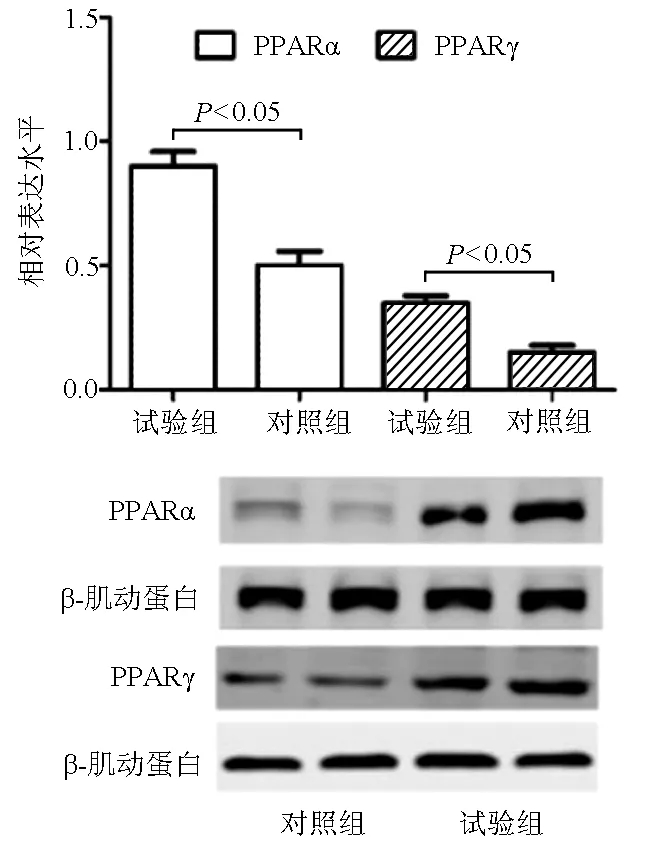
图4 2组PPARα/γ信号通路相关蛋白表达情况
2.6 抑制miRNA-18a表达对CD4+CD25+Treg细胞占外周血CD4+T淋巴细胞频率的影响 si-miRNA-18a抑制组外周血CD4+CD25+Treg细胞占CD4+T淋巴细胞的比例为8.5%±2.2 %,si-miRNA-18a正常对照组外周血CD4+CD25+Treg细胞占CD4+T细胞的比例为11.4%±2.1%, 2组比较差异具有统计学意义(t=3.968,P<0.01)(图5)。
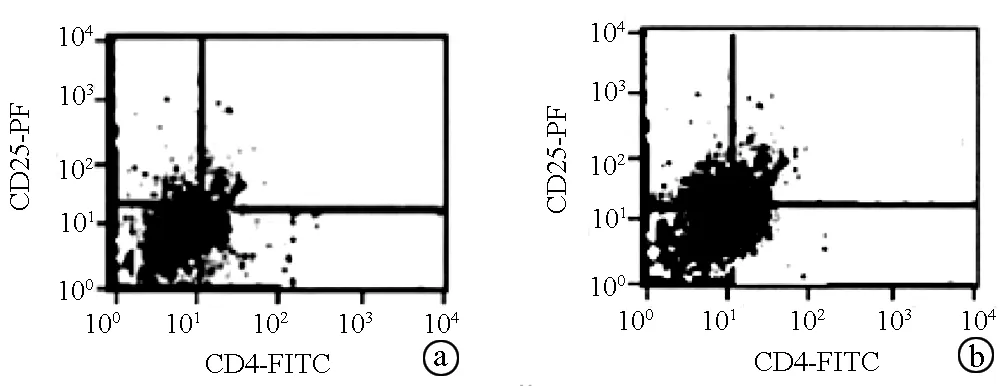
注:a,si-miRNA-18a抑制组;b,si-miRNA-18a正常对照组。
图5抑制miRNA-18a表达对CD4+CD25+Treg细胞占外周血CD4+T淋巴细胞频率的影响
2.7 抑制miRNA-18a表达对PPARα/γ信号通路相关蛋白表达的影响 si-miRNA-18a抑制组的PPARα和PPARγ表达水平均明显较si-miRNA-18a正常对照组低(t值分别为5.023、4.983,P值均<0.05)(图6)。
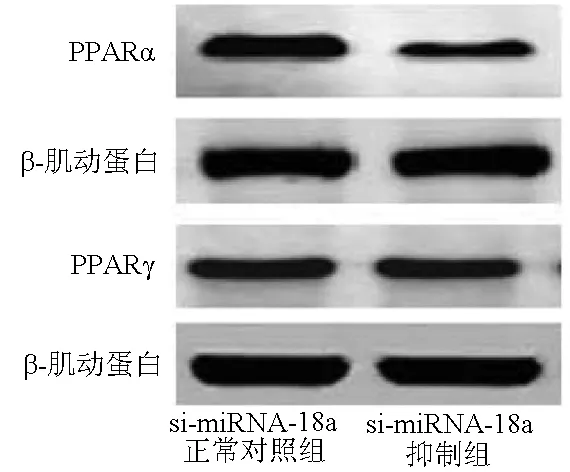
图6 抑制miRNA-18a表达对PPARα/γ信号通路相关蛋白表达的影响
2.8 miRNA-18a表达与PPARα/γ信号通路相关蛋白的相关性分析 miRNA-18a与PPARα/γ信号通路中的PPARα及PPARγ蛋白表达水平均呈正相关(r值分别为0.701、0.682,P值均<0.05)。
3 讨论
慢性乙型肝炎是引起全球性关注的公共卫生问题,机体免疫反应因HBV持续复制诱发而启动,使感染者肝脏及周围组织受到损害[10-11]。慢性乙型肝炎目前尚无特效治疗方法,以药物控制为主要手段,干扰素类和核苷(酸)类似物为主要涉及物[12-13]。本研究以慢性乙型肝炎患者和非乙型肝炎患者作为研究对象,探究了miRNA-18a通过PPARα/γ信号通路对慢性乙型肝炎患者调节性免疫功能的影响。通过RT-PCR检测,发现在血清和组织中试验组较对照组的miRNA-18a mRNA表达水平均显著上调(P值均<0.01)。确定了miRNA-18a 在乙型肝炎中的高表达,说明miRNA-18a在乙型肝炎发生发展中具有一定的作用。采用流式细胞术检测CD4+CD25+Treg细胞表面因子表达频率的影响,结果发现试验组较对照组的CD4+CD25+Treg细胞频率升高(P<0.01)。继续采用ELISA法检测miRNA-18a对CD4+CD25+Treg相关细胞因子分泌水平的影响,结果显示试验组IFNγ和IL-9分泌水平均优于对照组(P值均<0.05),提示miRNA-18a对CD4+CD25+Treg相关细胞因子分泌具有一定的促进作用。最后Western Blot结果显示试验组PPARα和PPARγ表达水平较对照组均明显上调(P值均<0.05),说明miRNA-18a对慢性乙型肝炎患者调节性免疫功能的影响与激活PPARα/γ信号通路有关。si-miRNA-18a抑制组外周血CD4+CD25+Treg细胞占CD4+T淋巴细胞的比例明显低于si-miRNA-18a正常对照组(t=3.968,P<0.01)。si-miRNA-18a抑制组的PPARα和PPARγ表达水平均明显低于si-miRNA-18a正常对照组(P值均<0.05)。而通过相关性分析,miRNA-18a与PPARα/γ信号通路中的PPARα及PPARγ蛋白均呈正相关(P值均<0.05),说明miRNA-18a可能通过PPARα/γ信号通路而对慢性乙型肝炎患者调节性免疫功能产生影响。
PPARα属于核受体家族中的配体激活受体,PPAR与配体结合并激活后,与视黄醇类X受体(RXR)形成异二聚体,形成的PPAR/RXR异二聚体与靶基因启动子上游的PPAR反应元件结合,最终调节靶基因的转录[14-15]。PPARα的激动一方面可以通过调节其靶基因如固醇调节元件结合蛋白、脂肪酸合成酶和低密度脂蛋白的表达改善脂质代谢,另一方面PPARα激活后能够通过抑制NF-κB的活性从而降低炎症因子的水平,并且有些PPARa激动剂本身还具有抗氧化作用,进一步减轻氧化应激,从而减轻肝脏的炎症反应[16-17]。
综上所述,本研究证明miRNA-18a可以通过激活PPARα/γ信号通路对慢性乙型肝炎患者调节性免疫功能产生影响,使其免疫功能相关细胞表面因子频率和细胞因子分泌水平上调,该免疫信号通路可能是治疗慢性乙型肝炎的一种新策略,但miRNA-18a对CD8+T淋巴细胞等适应性调节免疫细胞的影响还需要进一步探究。
