改良单叠氮丙啶-荧光定量PCR法的建立及其检测抗结核药物活性的价值
2020-06-13张静陈曦王彬付雷陆宇陈效友
张静 陈曦 王彬 付雷 陆宇 陈效友
结核病是一种严重威胁人类健康的传染性疾病,2019年WHO[1]报告估算2018年全球约1000万例新发结核病患者,全球平均结核病发病率为130/10万,因结核病而死亡患者约为145.1万例,耐多药结核病(MDR-TB)的治愈率约为56%。面对严重的结核病疫情,亟需发现新的有效抗结核药物。体外抗结核药物活性测定是新药药效学评价的重要环节,传统平板计数法[2],耗时长,现已较少应用;而目前国内外常用快速检测最低抑菌浓度(MIC)的方法包括微孔板Alarmar blue(MABA)法[3]、刃天青微孔板稀释(REMA)法和四唑染料 (tetrazolium dye)法等;因结核分枝杆菌生长缓慢,上述检测方法需要7~9 d才能获得结果。因此,需要建立一种快速、有效的药物活性检测方法,以满足抗结核新药开发的需要。
单叠氮乙醚(ethidium monoazide, EMA)或单叠氮丙啶(propidium monoazide, PMA;本研究使用PMA改良类似物PMAxx)[4]是一种核酸染料,它可以通过受损的细胞膜,在暴露于强可见光后共价插入细菌基因组,形成不可逆结合而干扰DNA扩增;利用EMA/PMA对受损与未受损的细菌进行预处理并联合荧光定量PCR(qPCR)检测,根据被降低或完全抑制的PCR信号来有效鉴别活菌和死菌。尽管PMA特异性渗透及抑制DNA扩增的机制尚不明确,但该方法已广泛应用于检测食品或复杂环境条件下的活菌[4]、寄生虫[5],以及相关的水质鉴定[6]。但是,该方法针对结核分枝杆菌的研究相对较少,尚未见到直接应用于抗结核药物活性检测的报道。
本研究首先通过未经处理和热灭活的结核分枝杆菌来建立PMAxx-qPCR的检测方法,并将该方法直接应用于一线抗结核药物异烟肼(INH)和利福平(RFP)体外活性测定,并且与传统检测方法相比较,以有效评估PMAxx-qPCR方法的适用性。
资料和方法
一、结核分枝杆菌标准株
结核分枝杆菌标准菌株H37Rv(ATCC27294)为北京市结核病胸部肿瘤研究所药物研究室保存菌。
二、主要试剂和仪器
1.试剂:PMAxx(40069,美国Biotium公司);Middle brook 7H9培养基(271310,美国BD公司);Middle brook 7H10培养基(262710,美国BD公司);Middle brook OADC增菌液(由氯化钠、牛血清白蛋白、葡萄糖、过氧化氢酶、油酸组成)(212351,美国BD公司);磷酸缓冲盐溶液(phosphate buffer saline,PBS)(P1022,北京索莱宝科技有限公司);二甲基亚砜(dimethyl sulfoxide,DMSO)(219605580,美国Mp Bio公司);Flash Hot Start Master Mix (SJ22e06351081,北京康为世纪生物科技有限公司);Eva-Green qPCR Master Mix(31000,美国Biotium 公司);吐温80(9005-65-6,北京索莱宝科技有限公司);西班牙琼脂糖(9012-36-6,北京索莱宝科技有限公司)。
2.仪器:多功能酶标仪(型号:Infinite M200pro, 瑞士迪肯公司);电热水浴锅(型号:WBK-3B,上海博讯实业有限公司医疗设备厂);PMA-Lite LED光解仪(型号:E90002,美国Biotium公司);荧光定量PCR仪(StepOnePlus, 美国应用生物系统公司); PCR仪(型号:Genepro,杭州博日科技有限公司);高速离心机(型号:1730R,中国香港基因有限公司)。
三、实验方法
(一)菌液制备
1.标准株培养:结核分枝杆菌H37Rv标准菌株接种于含10% OADC和0.05% 吐温 80的7H9 液体培养基,置37 ℃恒温箱内培养至对数生长期,于酶标仪中在570 nm处测定吸光度值(A值)[7],以A值0.1=1×108菌落形成单位(CFU)/ml为标准,配制成终浓度为1×108CFU/ml的活菌悬液,备用。
2.热灭活菌:取500 μl活菌(浓度:1×108CFU/ml)悬液于水浴锅进行热处理(100 ℃,30 min),冷却至室温,制成热灭活菌,备用。
(二)PMAxx处理条件优化
1.条件设置:曝光时间为10、15、20和30 min;暗孵育时间为10、30和60 min;PMAxx终浓度为5、10、20、40、80和100 μmol/L。
2.处理流程:将PMAxx(浓度分别为:5、10、20、40、80和100 μmol/L)分别加入含500 μl活菌或热灭活菌(终浓度:107CFU/ml)的透光离心管中,37 ℃恒温箱内避光孵育(时间分别为:10、30和60 min),室温下于PMA-Lite LED光解仪(波长λ=465~475 nm,60 W)中进行曝光(时间分别为:10、15、20和30 min),混悬液经25 000×g离心5 min,后经PBS洗涤2次,弃去上清液,取沉淀重悬于200 μl 双蒸水(ddH2O)中。
3.DNA模板制备:将重悬液于沸水中水浴加热30 min,15 520×g离心3 min,取上清液作DNA模板,备用。
4.qPCR检测:反应体系为10 μl 2×Eva-Green qPCR Master Mix、2 μl ROX校正染料(10 mg/ml)、0.5 μl 40×模板缓冲体系、rrs4正反向引物各0.3 μl(表1)、1 μl DNA模板和5.9 μl ddH2O。反应程序(2步法qPCR[8])为95 ℃预变性3 min,95 ℃变性30 s,60 ℃退火及延伸30 s(采集荧光信号);每次PCR反应重复40个循环进行。记录循环阈值(quantification cycle, Cq值)。
(三)PMAxx处理的相关影响因素
1.标识靶基因片段长度的影响: 基于NCBI中提供的结核分枝杆菌16S rRNA基因序列,利用Primer Express 3.0.1软件自行设计PCR的引物(rrs1~3和rrs5~7),其中rrs4引物序列引自相关的参考文献[9]。并对基因库中的序列进行BLAST搜索,以评估所有引物的特异性,引物具体信息见表1,引物由北京睿博兴科生物技术有限公司合成。
常规PCR反应体系:5 μl DNA模板、25 μl的2×Flash Hot Start Master Mix和正反向引物各2.5 μl,并使用 ddH2O配平终体系至50 μl。反应条件为95 ℃持续3 min预变性,95 ℃ 30 s变性,60 ℃ 30 s退火,72 ℃ 10 s延伸,共30个循环,最后一次循环72 ℃延伸 10 min。经琼脂糖凝胶电泳检验扩增产物,比较进行和未进行PMAxx预处理的细菌样本PCR扩增产物的差异。
2. 结核分枝杆菌生长周期:取同株等浓度的H37Rv活菌悬液分别培养2、3和4周。PMAxx处理组设为实验组,以未进行PMAxx预处理的细菌样本为对照组。两组分别进行qPCR检测,比较实验组和对照组间Cq值差异。
(四)抗结核药物活性检测
1.抗菌药物:选用常见的一线抗结核药物INH(批号:#MKBV9475V)和RFP(批号:#BCBP4553V),均购自美国Sigma公司;INH使用ddH2O溶解(储备液浓度:1 mg/ml),RFP使用DMSO溶解(储备液浓度:1 mg/ml),-20 ℃保存,备用。

表1 不同长度标识靶基因片段引物设计
注F=forward(正向);R=reverse(反向)
2.抗结核药物活性测定:具体介绍如下。
1)采用PMAxx-qPCR法测算MIC:分别取INH、RFP药物储备液经2倍系列稀释至合适浓度(0.003125、0.00625、0.0125、0.025、0.05、0.1、0.2和0.4 μg/ml),分别加入200 μl标准株菌液(终浓度为107CFU/ml),在含5% CO237 ℃恒温箱内培养,分别与INH、RFP作用3、5、7和10 d后取混悬液样本应用优化后的PMAxx-qPCR方法检测。计算抑菌活性公式:抑菌活性=(1-2-ΔCq)×100%,ΔCq=Cq含药-Cq不含药(每次计算对应3个独立样本的DNA提取和qPCR扩增)。绘制量效曲线[药物浓度(μg/ml)/抑菌活性(%)],加权法计算药物MIC。
2) MABA法检测药物MIC:(1)将96孔酶标板首行的1~6孔设置为7H9培养基对照(200 μl/孔),7~12孔设为菌对照孔[(100 μl 7H9液体培养基+100 μl菌液)/孔]。(2)在其他行的首孔分别加入200 μl含有单药的7H9培养基混合液(INH、RFP),均经2倍梯度稀释至如下浓度:0.019、0.039、0.078、0.1562、0.3125、0.625、1.25、2.5、5和 10 μg/ml,在除对照孔之外的各孔中加入100 μl H37Rv标准株菌液(浓度:106CFU/ml)。(3)在含5% CO237 ℃恒温箱中孵育,7 d后向各孔加入20 μl Alamar blue和12.5 μl 20%吐温80的混合液,再置回37 ℃恒温箱内孵育。(4)24 h后将酶标板置于酶标仪于激发波长为530 nm且发射波长为590 nm条件下,测定各孔的相对荧光强度值,并计算MIC。
3) PMAxx-qPCR法测算药物抗菌计数:将500 μl 标准株菌液(终浓度为107CFU/ml)与一定量的INH、RFP混合,各药物终浓度设定:16×MIC,8×MIC,4×MIC,2×MIC,1×MIC(MIC单位为μg/ml),以不含药空白孔为阴性对照孔,于含5% CO237 ℃恒温箱内培养10 d,PMAxx-qPCR检测方法同前。取1×108CFU/ml结核分枝杆菌培养液进行连续10倍稀释,获得108CFU/ml至102CFU/ml 7个浓度梯度,经PMAxx预处理后提取DNA,进行qPCR检测,以ddH2O为阴性对照,确定PMAxx-qPCR方法检测敏感度。经线性回归获得标准曲线方程式[Cq值/(lg CFU/ml)],药物抗菌计数为含或不含药条件下lg CFU/ml差值,并将该结果与同条件下CFU计数方法结果相比较。
4)CFU计数:菌液药物浓度设置同前,吸取200 μl药物作用10 d后混悬液用生理盐水进行连续10倍稀释,均匀涂抹在7H10固态培养基上,在37 ℃恒温箱内孵育3~4周后进行菌落计数。
四、统计学处理
结 果
一、 PMAxx处理的优化条件
1. PMAxx曝光时间:使用PMAxx对活菌进行预处理时,与对照组(未经PMAxx处理)比较,曝光10、15和20 min时Cq值无明显变化,而曝光30 min 时Cq值明显升高(q=8.975,P<0.05)(表2),提示曝光时间过长可抑制活菌的扩增;使用PMAxx对等量热灭活菌预处理时,各处理组较对照组间差异均有统计学意义,提示使用PMAxx处理可抑制热灭活菌的扩增,但曝光10 min时,热灭活菌Cq值小于其他时间组(P值均<0.05),提示曝光10 min混悬液中仍存在未与PMAxx结合的游离DNA引起扩增,而曝光15、20和30 min时,各组间Cq值不再随着曝光时间的延长而发生变化(P值均>0.05)(表2)。综合死菌和活菌的结果,以不影响活菌扩增且充分反映死菌的差异为原则,选择15 min作为最佳曝光时间。
2. PMAxx暗孵育时间: PMAxx预处理活菌暗孵育10和30 min与对照组比较差异均无统计学意义,而暗孵育60 min后Cq值出现轻度升高(q=3.991,P=0.006);同时,经PMAxx处理的热灭活菌各组检测的Cq值较对照组结果明显升高(P<0.001),且各时间组间两两比较,Cq值不随孵育时间的延长而发生变化(P值均>0.05),提示10 min即可满足PMAxx预处理孵育要求(表3)。
3. PMAxx最适浓度:PMAxx浓度对活菌和热灭活菌qPCR检测的影响如图1所示,随着PMAxx处理浓度的增加,活菌悬液Cq值总体上有升高趋势,以未经PMAxx预处理菌样本为阴性对照,当PMAxx浓度升高至80 μmol/L 及以上时,活菌扩增Cq值明显增大(26.844±0.376 与 31.625±0.890,t=12.300,P<0.001),说明高浓度的PMAxx将抑制活菌DNA扩增,且浓度越高抑制效果越明显,因此,不影响活菌扩增的适宜浓度范围为5~40 μmol/L。当PMAxx浓度为5 μmol/L时,PMAxx处理的热灭活菌较阴性对照Cq值无明显变化(27.767±0.244与26.830±0.123,t=2.410,P=0.387),说明该浓度下无法抑制样品中DNA的扩增;当PMAxx浓度≥10 μmol/L时,Cq值明显升高且各组间差异均无统计学意义(图1)。

表2 曝光时间对PMAxx-qPCR方法鉴定活菌和热灭活菌的影响
注Cq值:循环阈值。各项数据间比较采用单因素方差分析的Tukey多重检验。a: 对照组与曝光10 min的比较;b: 对照组与曝光15 min的比较;c: 对照组与曝光20 min的比较;d:对照组与曝光30 min的比较;e: 曝光10 min与曝光15 min的比较;f: 曝光10 min与曝光20 min的比较;g: 曝光10 min 与曝光30 min的比较:h: 曝光15 min与曝光20 min的比较;i: 曝光15 min与曝光30 min的比较;j: 曝光20 min与曝光30 min的比较;“-”:空白

表3 暗孵育时间对PMAxx-qPCR方法鉴定活菌和热灭活菌的影响
注Cq值:循环阈值。各项数据间比较采用单因素方差分析的Tukey多重检验。a: 对照组与暗孵育10 min的比较;b: 对照组与暗孵育30 min的比较;c: 对照组与暗孵育60 min的比较;d:暗孵育10 min与暗孵育30 min的比较;e:暗孵育10 min与暗孵育60 min的比较;f:暗孵育10 min 与暗孵育60 min的比较。“-”:空白
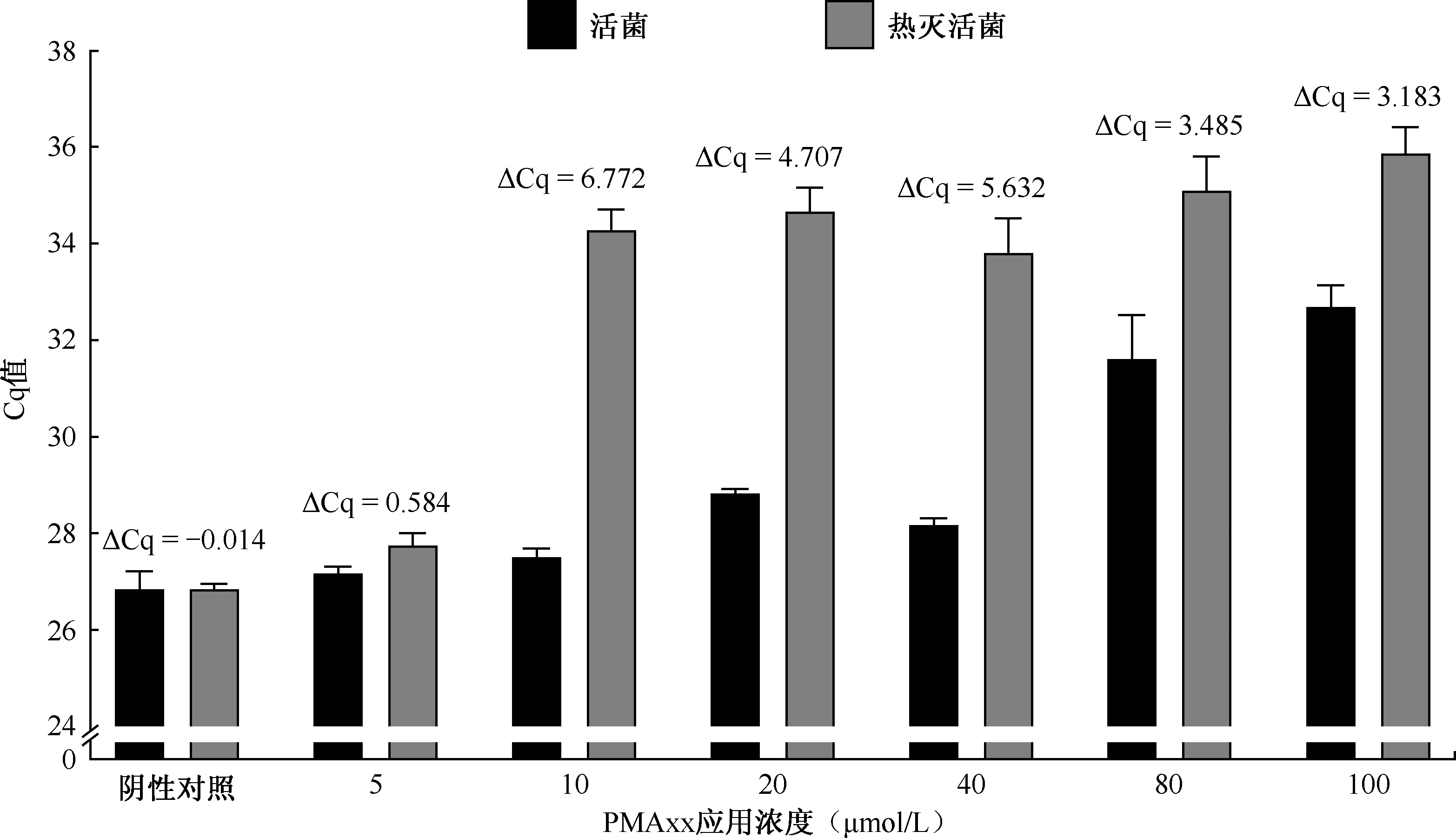
Cq值:循环阈值;“┰”表示标准差图1 不同PMAxx浓度对活菌和热灭活菌qPCR检测的影响
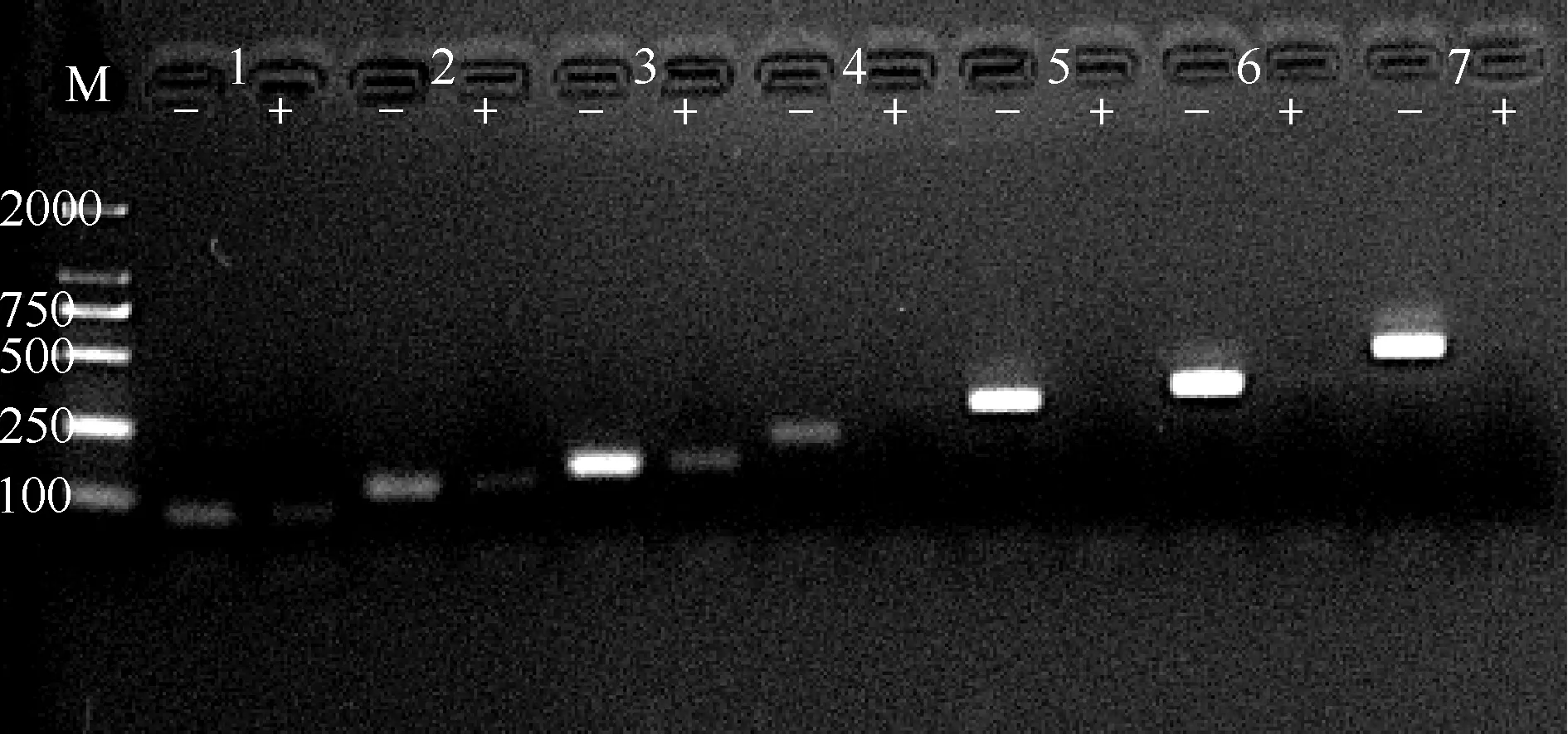
“-”表示未经PMAxx预处理,“+”表示经PMAxx预处理。M:Marker(2000 bp);标记编号1~7分别代表rrs1(81 bp)、rrs2(117 bp)、rrs3(143 bp)、rrs4(206 bp)、rrs5(279 bp)、rrs6(316 bp)、rrs7(433 bp)各扩增产物条带图2 不同扩增片段长度对PMAxx-qPCR方法检测的影响
综合比较各组间死活菌ΔCq,发现10 μmol/L 组ΔCq值明显高于其他组(6.772±0.453)。故选择10 μmol/L作为PMAxx鉴别结核分枝杆菌死活菌的处理浓度。
二、PMAxx-qPCR方法相关影响因素
1. 扩增片段长度:电泳图谱显示所有未进行PMAxx预处理的样品均出现明亮单一条带,而随着靶标片段大小变化,PMAxx处理组电泳条带出现明显差异。当扩增片段长度为81~143 bp时,PMAxx处理组仍存在较明显条带;当扩增片段长度为206~433 bp时,处理组电泳条带消失,表示经PMAxx处理的样品DNA扩增被完全抑制(图2)。
2. 结核分枝杆菌的生长周期:随着培养时间的延长,PMAxx处理组与未处理组间ΔCq值逐渐升高,从对数生长期(2周)的0.575个循环升至平台抑制期(4周)的2.866个循环,且当培养时间为3周和4周时,PMAxx处理组较未处理组Cq值差异均有统计学意义,提示不同生长周期的结核分枝杆菌将导致PMAxx检测活菌的背景值存在差异(表4)。
三、 PMAxx-qPCR方法检测抗结核药物的活性
1. 与MABA法比较测定药物MIC:根据PMAxx-qPCR法检测获得的量效曲线(图3,4)进行择点加权测算,得到INH的MIC为0.06 μg/ml(0.049~0.076 μg/ml),与MABA法(0.032~0.064 μg/ml,t=0.782,P=0.491)一致性良好;而RFP由PMAxx-qPCR方法测算的MIC为0.121 μg/ml(0.102~0.145 μg/ml),与MABA法(0.051~0.079 μg/ml,t=2.828,P=0.066)一致性尚可;实验结果0.5~2倍MIC值视为可接受范围。同时,对比药物作用5、7和10 d 的量效曲线,发现采用PMAxx-qPCR法在作用后第3天即可测算出药物的MIC。
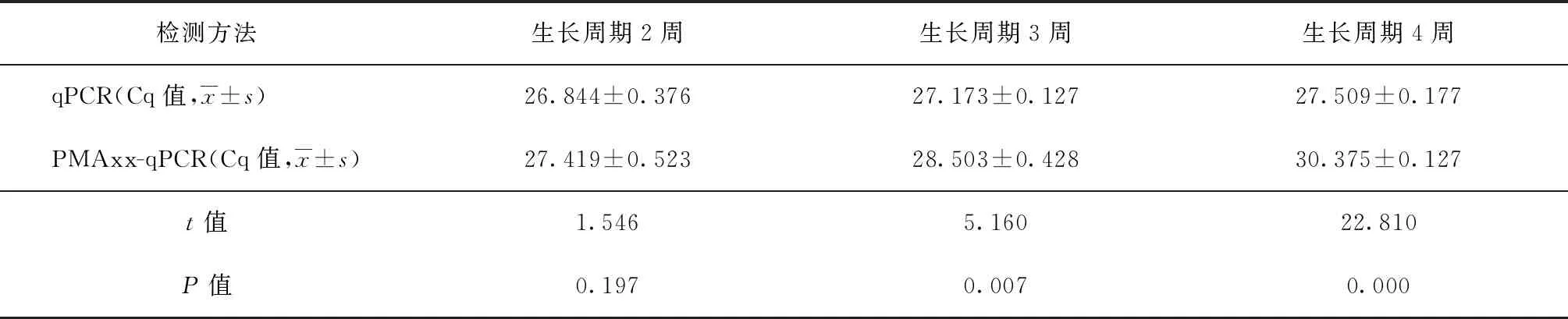
表4 PMAxx处理前后qPCR所测循环阈值(Cq值)在不同生长周期结核分枝杆菌中的比较

虚线表示抑菌率达到90%最低抑菌浓度;“┰”表示标准差 虚线表示抑菌率达到90%最低抑菌浓度;“┰”表示标准差图3 INH量效曲线(PMAxx-qPCR法) 图4 RFP量效曲线(PMAxx-qPCR法)
2. 与CFU计数法比较药物抗菌活性:定量(终浓度为108CFU/ml)结核分枝杆菌悬液连续10倍梯度稀释,经PMAxx处理后分别提取DNA,经qPCR检测以获得标准曲线[Cq值/(lg CFU/ml)],其线性回归方程为y=-2.566x+45.51,R2=0.9863(图5)。最低检测限为102CFU/ml(Cq=39.616±0.317)。

Cq值:循环阈值;CFU:菌落形成单位;“┰”表示标准差图5 结核分枝杆菌PMAxx-qPCR标准曲线
根据方程分别计算各浓度(16×MIC,8×MIC,4×MIC,2×MIC,1×MIC)INH、RFP作用后10 d抗菌计数,CFU计数方法结果和PMAxx-qPCR方法测定结果对比分析见表5,两种方法测算一致性良好(P>0.05)(表5),说明PMAxx-qPCR方法可有效快速检测抗菌药物活性。
讨 论
特异性膜渗透的核酸染料PMA与高敏感度的荧光定量qPCR检测技术结合,可以选择性检测细胞膜完整的活性病原菌,具有特异性强、定量准确、快速检测等优点,现已广泛应用于食品、检疫、农业、畜牧业等多领域微生物活性检测。本研究使用PMA改良类似物PMAxx[10]区分结核分枝杆菌H37Rv活菌和热灭活菌提供一个完整的方案,探讨方法应用的重要影响因素,并应用于抗结核药物的活性检测。

表5 不同MIC倍增浓度的INH、RFP作用10 d后的PMAxx-qPCR法抗菌计数和CFU计数结果的比较
注MIC:最低抑菌浓度;CFU:菌落形成单位
根据多项研究报道,该方法的建立存在多种影响因素[10],包括PMA浓度[9]、细胞死亡方式[11]、样品的种类或浓度[12]等。在本研究中首先研究了曝光时间、暗孵育时间、试剂浓度等几项关键因素。研究结果表明,使用浓度为10 μmol/L PMAxx预处理H37Rv,经暗孵育10 min后曝光15 min,可有效区分活死菌,并避免各项干预条件导致的假阳性反应。Lu等[12]利用该方法检测痰中培养分离的结核分枝杆菌,发现延长暗孵育时间可有效提高PMA对死菌的检出率,适用浓度范围为100~800 μmol/L,Dorn-In 等[8]和Pholwat 等[9]研究得出适用浓度为50 μmol/L,均高于本研究中的10 μmol/L,导致以上差异的原因主要考虑以下两个方面:(1)本研究采用的是纯菌悬液,而Lu等[12]研究中目标是临床痰样本,Dorn-In等[8]研究目标为鹿肉和粪便样本中的结核分枝杆菌复合体,复杂性样本中非细胞物质可能影响PMA的渗透能力,因此需提高试剂浓度和延长预处理时间以提高其与死菌DNA的结合率;(2)本方法中应用的PMAxx已被证实渗透能力优于PMA[13], 所需量少且处理时间更短。另外,本研究发现PMAxx在检出效率上不受孵育时间影响。
qPCR是本方法检测的主要部分,因此标靶基因的识别和检测是影响方法实施的关键。本研究发现使用较长的靶标片段(206~433 bp)区分死活结核分枝杆菌较短片段(81~143 bp)有效,该发现与多项研究结果一致;Contreras等[14]研究发现,应用PMA-qPCR方法鉴别非活性鳗弧菌和嗜冷黄杆菌时,729 bp的靶标产物检出效率明显优于140 bp,且死活菌检测差异随靶标片段的扩大逐渐升高;Alonso 等[15]研究也发现应用PMA-qPCR方法检测热灭活的十二指肠贾第虫囊肿时,采用143 bp/133 bp靶标片段的检出率分别为97.0%和98.2%,而采用77 bp/75 bp时检出率明显降低(89.9%和83.2%)。以下原因可能解释该现象:据Opel等[16]报道,与DNA结合的PCR抑制剂主要通过影响DNA聚合酶的作用而影响延伸率,而长片段较短片段出现DNA聚合酶功能抑制的概率更高,因此使得长片段对该类抑制剂更为敏感。
本研究将优化后的PMAxx-qPCR方法直接应用于一线抗结核药物INH、RFP的体外抗菌活性检测,首先发现该方法在药物作用后3 d即可获得与国际通用的MABA法一致性良好的MIC结果,该发现与Pholwat等[9]研究结果一致。因此与需时较长的MABA法相比可有效提高检测效率。其次,本研究还通过Cq值/lg CFU/ml标准曲线转换获得药物作用后活菌计数,与传统CFU计数方法结果一致性良好。Scariot等[17]研究证实PMA-qPCR方法检测酸奶中副干酪乳杆菌和CFU计数法的结果具有极佳的符合率,Roussel等[18]也通过对大肠杆菌研究充分证实PMA-qPCR方法和CFU计数法结果的高度一致性。本研究证实PMAxx-qPCR方法对结核分枝杆菌菌落计数的测算同样有效,且最低检测限可至102CFU/ml,与Zi等[19]研究中的检测限结果一致。总之,PMA-qPCR方法在保证有效、准确、高敏感度评价药物抗菌活性的前提下,可大大节省时间成本,提高检测效率,具备成为药物抗菌活性研究及评价工具的潜力。
本研究的局限性在于应用PMAxx-qPCR方法仅评估INH、RFP两种抗结核药物,而抗结核药物种类繁多且作用靶点各异,仍需要完善对其他抗结核药物的活性检测以评估方法的应用价值。
本研究结果表明,PMAxx在适宜的处理条件下,可有效抑制对死菌DNA的扩增,联合qPCR时可作为一种快速、准确的分子药敏检测方法,敏感度高,可有效检测药物抗菌活性,与传统检测方法相比,一致性良好且需时更短。
