猪繁殖与呼吸综合征病毒华南株GDjm全基因组测序与遗传进化分析
2020-06-08张驰董建国于林洋王爽云范兰兰张乐宜刘燕玲王磊宋长绪
张驰,董建国,于林洋,王爽云,范兰兰,张乐宜,刘燕玲,王磊,宋长绪*
(1. 华南农业大学动物科学学院,广东 广州 510642;2. 信阳农林学院牧医工程学院,河南 信阳 464000)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)可引起任何品种、性别、年龄的猪发病,其中易感性最高的是母猪和仔猪,且感染后出现严重的临床症状[1]。PRRS是导致母猪发热、厌食、早产、流产、死胎、弱仔等繁殖障碍和仔猪呼吸道症状为主要特征的传染病[2]。目前猪繁殖与呼吸综合征病毒(PRRSV)分为2个基因型:基因型1和基因型2,代表性毒株分别为欧洲型Lelystad Virus和美洲型VR-2332[3]。中国内陆于1995年首次发现PRRSV,并在1996年成功分离出第1株PRRSV毒株CH-1a[4];2006年,中国南方地区出现由变异性毒株引起的高发病率和高死亡率的疫情[5-6],随后蔓延至全国大部分地区,给我国养猪业造成了严重的经济损失。
PRRSV为单股正链RNA有囊膜病毒,基因全长约为15~15.5 kb[7],至少含有10个开放阅读框(ORF),包括ORF1a、ORF1b、ORF2a、ORF2b、ORF3、ORF4、ORF5、ORF5a、ORF6和ORF7[8]。在ORF1a中的NSP2基因最容易变异,主要含3个区域:N末端的半胱氨酸酶区、中部的高变区和C末端疏水的转膜区,NSP2发生的变异主要位于中部的高变区[9]。NSP2区域在许多PRRSV分离毒株中存在氨基酸缺失,这是PRRSV基因组长度差异的一个主要原因。ORF5编码的糖基化囊膜蛋白GP5有较强的免疫原性,可诱导机体产生中和抗体,常被作为构建PRRSV诊断的重要靶标[10]。GDZS2016为近年来广东地区流行毒株,与JXA1毒株在同一分支,相关文章报道其能造成临床发病率为90%,死亡率为10%,不具有感染Marc-145细胞的能力,但可感染PAM细胞[11]。PRRSV发生基因重组的频率很高,可能导致新型高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV)的出现[12-13]。
2018年7月,本实验室从广东省江门市某PRRS发病猪场采集肺脏组织样本,PCR检测结果为PRRSV阳性,在Marc-145细胞上无法分离纯化,最终在原代猪肺泡巨噬细胞(porcine alveolar macrophages,PAM)上成功分离,将其命名为GDjm株。对全基因组进行测定,将测序结果与其他代表PRRSV毒株进行序列比对和进化树分析,进而分析GDjm毒株与国内流行的PRRSV毒株的相似性和重组情况,为深入研究该病毒株的遗传与变异奠定了基础。
1 材料与方法
1.1 病料
肺脏病变组织来源于广东省江门市疑似发生PRRS某养殖场,-20 ℃冻存备用。
1.2 细胞、菌体
Marc-145细胞、PAM细胞、大肠杆菌感受态细胞,由华南农业大学国家生猪种业工程技术研究中心种猪疾病防控实验室保存。
1.3 主要试剂
病毒DNA/RNA提取试剂、反转录试剂盒以及胶回收试剂盒盒购自Promega公司;RT-PCR相关试剂盒购自Vazyme公司;DNA Marker DL2000等购自广州东盛生物科技有限公司;EB替代染料(GoldviewⅠ)购自广州华奇盛生物科技有限公司;pEASY-Blunt Simple Cloning Vector购自北京全式金生物技术有限公司。大肠杆菌感受态细胞购自天根生物科技(北京)有限公司。
1.4 引物的设计与合成
根据GenBank中发布的PRRSV毒株全基因组序列进行生物信息学分析,选取保守区域设计14对特异性引物(表1)用于扩增序列,引物由生工生物工程(上海)股份有限公司合成。
1.5 病料处理
取1 g肺脏组织剪碎,加入1 mL PBS在冰上充分研磨。将研磨液倒入洁净的1.5 mL 离心管中,12 000 r/min离心3 min,收集上清后在超净工作台中用0.22 μm微孔过滤器过滤,取200 μL 滤液用于病毒核酸提取,并通过PCR进行猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)、猪细小病毒(PPV)检测,其余滤液置于-80 ℃保存备用。
1.6 病毒分离
采用PAM细胞和Marc-145细胞从样品中分离PRRSV。将处理好的临床样品感染PAM和Marc-145细胞,盲传3代,并观察细胞病变效应(cytopathic effect,CPE)。收毒后反复冻融3次,每代取200 μL细胞培养液于无RNA酶的离心管中,用于提取核酸和PCR检测。
表1 扩增全基因序列引物
1.7 间接免疫荧光试验(IFA)
将PAM细胞和Marc-145接至24孔细胞培养板中,置于细胞培养箱中培养24 h后弃掉培养液,PBS缓冲液洗涤3次。每孔接种10 μL上述滤过液,设立空白对照,放在于细胞培养箱中孵育1 h后弃掉液体,PBS轻轻冲洗3次,各孔加入500 μL含有2% FBS的细胞维持液,观察培养25 d后弃掉培养液,PBS洗涤3次,各孔加进200 μL固定液于-20 ℃固定20 min,弃掉液体,PBS洗涤3次;然后各孔加入200 μL 0.5% Triton X-100室温穿膜10 min,弃掉液体后PBS洗涤3次;加入200 μL的1∶400倍稀释的一抗(鼠源抗N蛋白单抗),置于37 ℃孵育1 h,期间每20 min轻轻摇晃1次,确保充分吸附,弃去液体后PBS洗涤5次;避光加入200 μL稀释后的荧光二抗(FITC标记的羊抗鼠IgG),37 ℃条件下避光作用1 h,PBS洗涤5次,置于荧光显微镜下进行观察。
1.8 提取核酸及反转录
将收集的上清液取200 μL,采用Promega公司提供的试剂盒进行病毒核酸提取和反转录,反转录产物置于-20 ℃冰箱保存。
1.9 目的基因分段扩增
采用TAKARA公司提供的高保真酶对目的片段进行扩增,PCR扩增体系为50 μL,PrimeSTAR Max Premix (2×) 0.5 μL、5× PrimeSTAR Buffer 10 μL、dNTP Mixture 4 μL、RNase-free H2O 27.5 μL、cDNA模版4 μL,上下游引物各2 μL。PCR扩增程序:98 ℃预变性1min;98 ℃变性10s,53 ℃退火15 s,72 ℃延伸2 min,30个循环;72 ℃再延伸10 min。取6 μL PCR产物进行1%琼脂糖凝胶电泳。
1.10 基因克隆、测序
PCR扩增产物经过电泳鉴定后,使用Promega公司提供的胶回收试剂盒进行胶回收。取4 μL胶回收产物1 μL pEASY-Blunt Simple Cloning Vector 25 ℃连接25 min,转化后挑菌鉴定,将阳性菌液送往生物公司测序。
1.11 序列分析
表2所示PRRSV代表毒株基因序列均来自GenBank。运用Lasergene与Mega 5.0软件将测序毒株与国内外代表毒株进行序列比对和进化树构建,并将GDjm毒株NSP2与GP5基因氨基酸序列与国内外代表毒株进行比对分析。通过SimPlot软件对GDjm株进行全基因重组分析。
表2 PRRSV参考毒株信息
毒株名称登录号 来源年份CH-1aAY032626中国2000CH-1REU807840.1中国2008CHsx1401KP861625.1中国2015CWZ-1-F3FJ889130.1中国2009GDEU825724.1中国2008GDZS2016MH046843.1中国2016GM2JN662424.1中国2011HB-1(sh)AY150312中国2002HUN4EF635006.1中国2007HENXX-1KU950372.1中国2014Lelystad virusNC_043487.1欧洲1993NVDC-CQ4-2012KP771777.1中国2015NADC30MH500776.1中国2018JXA1EF112445.1中国2006JXA1 P80FJ548853.1中国2009JXA1 P160KC422731.1中国2013JXwn06EF641008.1中国2007JSWAKY373214.1中国2016QY2010JQ743666.1中国2012QYYZJQ308798.1中国2011RespPRRS-MLVAF066183美国2005SCN17MH078490.1中国2017VR-2332AY150564.1丹麦2002WUH4EU187484.1中国2007
2 结果与分析
2.1 病料的RT-PCR检测
使用ORF5基因检测引物对样品进行扩增,1%琼脂糖凝胶电泳分析结果表明(图 1),检测结果与预期结果(864 bp)相符。
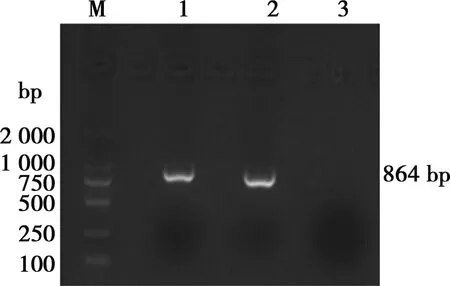
M. DNA Marker DL2000;1. 样品;2. 阳性对照;3. 阴性对照
图1 PRRSV ORF5基因片段扩增电泳结果
2.2 病毒分离与IFA
在Marc-145细胞多次接毒后未出现CPE,随后将处理后的病料分别接种于Marc-145细胞与PAM细胞,培养48 h后进行间接免疫荧光检测N蛋白。如图2所示,Marc-145细胞无荧光,PAM细胞上有明显的荧光信号,证明分离毒可感染PAM细胞但不感染Marc-145细胞。
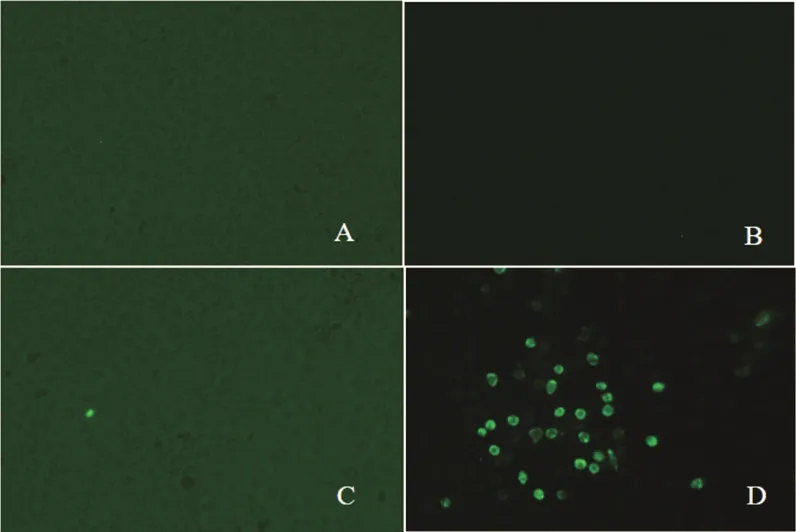
A. 未接毒Marc-145细胞;B. 接毒Marc-145细胞;C. 未接毒PAM细胞;D. 接毒PAM细胞
图2 间接免疫荧光检测结果
2.3 PRRSV GDjm全基因组测定
使用14对相互重叠的特异性引物扩增全基因。琼脂糖凝胶电泳分析显示,扩增的14个产物大小与预期一致(图 3)。将扩增片段胶回收连接载体后测序,使用SeqMan软件拼接序列,获得全基因序列全长为15 249 bp,命名为GDjm株。
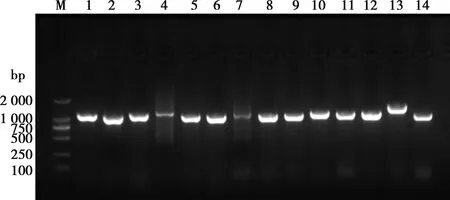
M.DNA Marker DL2000;1~14. PCR扩增的14个片段
图3 PRRSV GDjm全基因RT-PCR扩增琼脂糖凝胶电泳
2.4 PRRSV GDjm基因进化树构建与同源性分析
应用DNAStar软件对GDjm毒株与国内外代表性毒株进行全基因组进化树构建,结果如图4所示。遗传进化树分为欧洲型代表毒株Lelystad virus和美洲型代表毒株VR-2332两大分支,以VR-2332为代表的美洲型又可进一步分为以JXA1、JXwn06为代表的高致病毒株分支,以我国CH-1a与VR-2332为代表的低致病性毒株分支,以及美国NADC30为代表的分支和近年来出现的QYYZ为代表的分支。如图所示,GDjm株与华南地区近年新出现的重组毒GDZS2016同源性最高,并位于JXA1、JXwn06等为代表的高致病性毒株和以CH-1a为代表的经典毒株中间。故判定GDjm株可能为重组毒株。
利用DNAStar软件对PRRSV全基因核苷酸序列分析,结果如图5所示,GDjm与GDZS2016、HUN4、NVDC-CQ4-2012、WUH4、JXA1的同源性分别为96.2%、96.0%、95.7%,95.5%、95.4%,与NADC30同源性为82%,与美洲型代表毒株VR2332同源性为87.4%,与欧洲型代表株Lelystad virus同源性仅为57.9%。
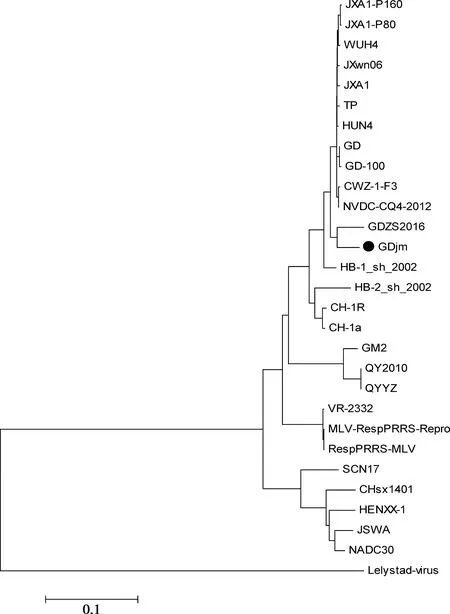
●标注毒株为所测毒株
图4 PRRSV全基因组的进化树分析

图5 PRRSV-GDjm全基因序列比对结果
2.5 GDjm NSP2与GP5氨基酸序列比对及核苷酸同源性分析
运用DANStar对GDjm和国内代表典毒株进行NSP2氨基酸序列比对,结果如图6所示,GDjm毒株在511、534~562位存在30个不连续氨基酸的缺失,此外在531位存在T531I突变。
运用DNAStar软件对GDjm和国内外参考毒株进行GP5氨基酸序列比对(图7)。GDjm在29位有A29V变异;在185位有V185A突变;在189位有I189L突变;在39位有1个L39I突变。此外GDjm还存在多个突变位点,在34位存在D34G突变,58位有N58E突变,107位有V107A突变,196位有Q196R突变。
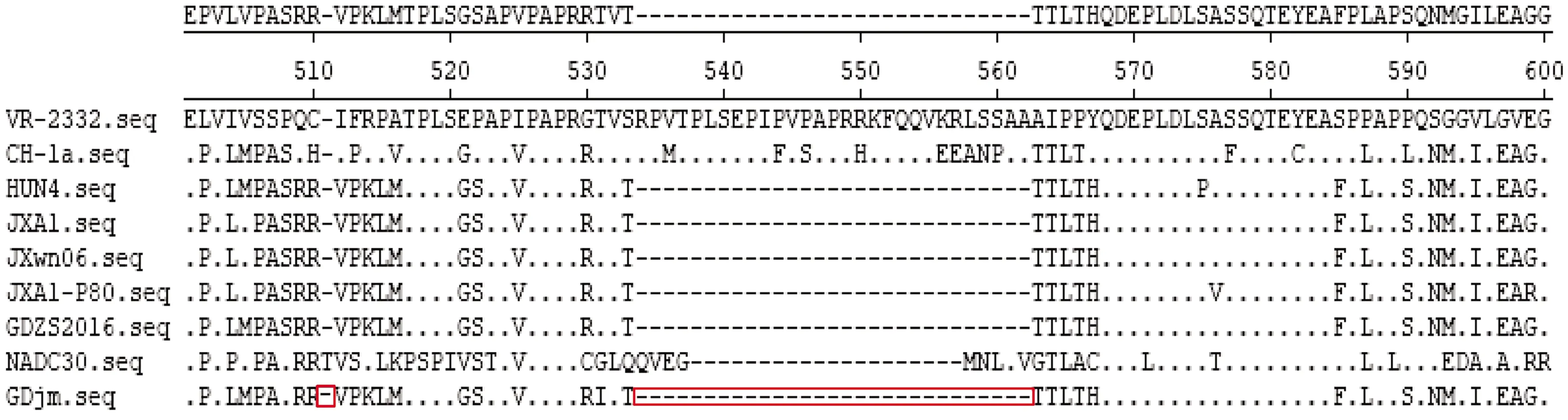
方框中为核苷酸变异位点,下同
图6 PRRSV-GDjm NSP2氨基酸序列比对结果

图7 PRRSV GDjm GP5氨基酸序列比对结果
2.6 PRRSV全基因重组部位特征分析
运用SimPlot软件将GDjm株与高致病性毒株HUN4和近年来华南地区毒株GDZS2016进行全基因组重组分析。经分析得出(图8):GDjm株为高致病毒株HUN4与GDZS2016进行重组的重组毒株。重组区域分别为6 723~9 521 bp、11 998~15 019 bp。
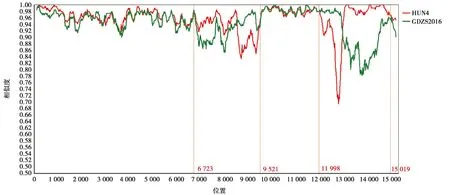
坐标尺:200 bp;区分度:20 bp
图8 PRRSV GDjm毒株重组分析
3 讨论
PRRS是全球养猪业的重大传染病之一。我国分离得到的毒株以北美型PRRSV为主。防控PRRS的疫苗主要有经典毒株和高致病性毒株减毒活疫苗以及灭活疫苗[14]。我国PRRSV流行的种类众多,研发和生产疫苗的厂家众多,毒株的选用以及生产方式皆有不同,导致使用混乱。养殖场也可能在免疫流程中使用不同型号的疫苗,使毒株间发生遗传重组的可能性增加,加上RNA病毒复制酶低保真性和自身免疫系统的影响[15],进而加速PRRSV变异。
本试验对广东省江门市疑似发生PRRS的猪场采集病料进行PCR检测,结果呈阳性;通过对GDjm毒株全基因组测序,并对其与其他PRRSV毒株同源性进行比较和构建进化树分析。全基因组分析中GDjm与GDZS2016同源性最高,为96.2%。NSP2是PRRSV最大的非结构蛋白,容易发生缺失和突变,基因长度约为2.9 kb。 GDjm毒株NSP2氨基酸序列比对结果与高致病性毒株HUN4、JXA1、JXwn06和高致病疫苗株JXA1-P80相似,在511、534~562位存在30个不连续氨基酸的缺失,符合高致病性毒株特点。美洲型毒株GP5蛋白的表位有3个,aa27~aa30和aa180~aa197为非中和表位,aa37~aa45为中和表位[16]。与美洲型代表毒株VR-2332相比,GDjm在非中和表位中有1个A29V的变异;在185位有V185A突变,该突变与高致病性毒株及其疫苗株相同;在189位有I189L突变,该突变与经典毒株和高致病性毒株及其疫苗株相同。中和表位中,在39位有1个L39I突变,该突变与高致病性毒株及其疫苗株相同。
GDZS2016株是华南地区2016年出现的重组毒株,相关文章报道其能造成临床发病率为90%,死亡率为10%,现研究表明该毒株只能感染PAM细胞,对Marc-145不具有感染性[17]。HUN4毒株是高致病毒株,临床试验表明其能造成发病率和死亡率高达100%,均能使Mare-145和PAM感染[18]。全基因重组部位特征分析表明HUN4与GDZS2016重组,重组区域8 558~9 462 bp、11 995~12 982 bp。这2个片段编码病毒RNA复制酶、聚合酶GP2、GP3、GP4、GP5[19],它们的重组可能与GDjm毒株不能感染Marc-145细胞相关。综上所述,GDjm毒株为HUN4与GDZS2016的重组毒株,具有致病性增强的潜在风险,加大了广东地区PRRSV防控的难度,因此有必要开发新型疫苗预防疾病的发生,并早日解决PRRSV感染与流行的问题。
